化学实验探究题如何解答
安徽 汤 伟(特级教师)
化学实验探究题如何解答
安徽 汤 伟(特级教师)
化学实验探究题能够较好地考查考生综合应用知识的能力,是考查考生学科素养的较好题型,如何解答该类高考题型?下面我们以2016高考试题为例,针对该类高考化学实验探究题型做出分析,供参考。
1.对已知物质性质的探究
该类试题注重考查考生能否将所学知识融会贯通,灵活应用所学知识。解答该类试题的关键点是需要熟识所学物质的相关性质及其性质演变出的各种现象。
例题1 (2016全国Ⅱ,28)某班同学用如下实验探究Fe2+、Fe3+的性质。
回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。在FeCl2液中需加入少量铁属,其目的是____________________________________________________。
(2)甲组同学取2mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_________________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mL FeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是______________________________________________________。
(4)丙组同学取10mL 0.1mol/L KI溶液,加入6mL 0.1mol/L FeCl3溶液混合。分别取2mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1mL CCl4充分振荡、静置,CCl4层呈紫色;
②第二只试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是________(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有________(填离子符号),由此可以证明该氧化还原反应为________。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为_________________;一段时间后,溶液中有气泡出现,并放热。随后有红褐色沉淀生成。产生气泡的原因是_________________________;生成沉淀的原因是_________________________(用平衡移动原理解释)。
【解析】(1)亚铁离子具有较强的还原性,能被空气中的氧气氧化,所以在配制的FeCl2溶液中加入少量铁属的目的是防止Fe2+被空气中氧气氧化;(2)Cl2可将Fe2+氧化成铁离子,自身得电子生成氯离子,反应的离子方程式为;(3)防止空气中的氧气将Fe2+氧化,产生干扰,所以煤油的作用是隔绝空气;(4)根据Fe2+的检验方法,向溶液中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀,一定含有亚铁离子;则实验②检验的离子是Fe2+;碘易溶于CCl4,在CCl4中呈紫色,Fe3+遇KSCN溶液显血红色,实验①和③说明Fe3+与I-间的反应为可逆反应;(5)盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,说明产物中有Fe3+,反应为H2O2+;反应一段时间后,溶液中有气泡出现,并放热,说明双氧水分解产生氧气,且该反应为放热反应,而Fe3+水解反应为吸热反应,因为放出的热促使了Fe3+水解正向进行,生成了较多的氢氧化铁,从而产生沉淀。
【答案】(1)防止Fe2+被氧化
(3)隔绝空气(排除氧气对实验的影响)
(4)Fe2+Fe3+可逆反应
2.对未知产物的探究
通过化学反应原理猜测可能生成哪些物质,对这些物质逐一进行检验来确定究竟含有哪些物质。正确解答此类试题的关键是把握反应原理,根据现象和原理猜测要科学、全面。
例题2 (2016全国Ⅰ,26节选)氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。
回答下列问题:
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

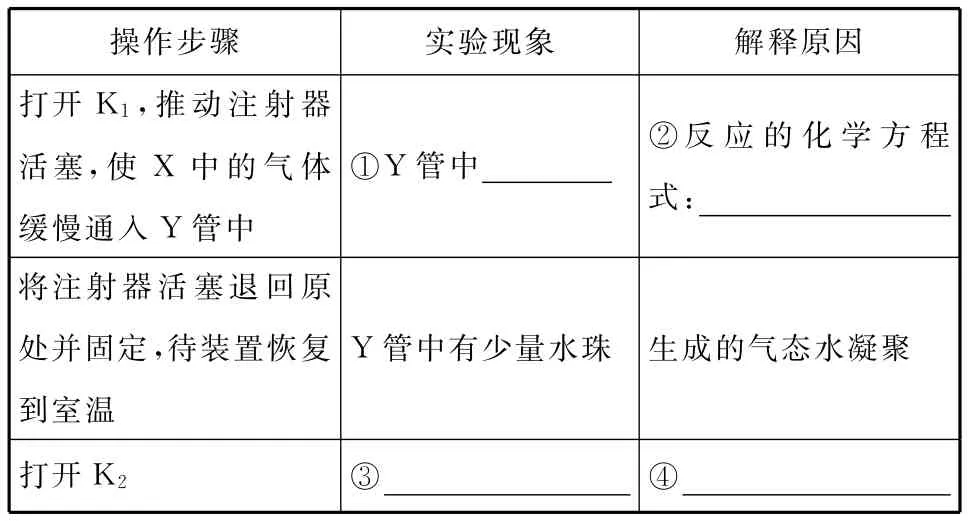
______操作步骤____________实验现象解释原因打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中_____________________________________________①Y 管中________②反应的化学方程式:________________将注射器活塞退回原处并固定,待装置恢复到室温________________________________________________________Y管中有少量水珠生成的气态水凝聚打开K2_____________________③________________④__________________


3.对变化规律的探究
物质性质递变规律的探究是中学化学实验探究的一个重要内容。中学化学教材中学习了众多的变化规律,如同周期、同主族元素性质的递变规律,物质的氧化还原反应规律,物质的酸(碱)性强弱规律,等等,这些规律都是通过实验探究和相关理论结合得出的重要结论,现在它们仍然是高考命题的一些经典情境。解答该类问题的关键点是注意控制变量法应用,即在其他条件相同的前提下,只改变一个条件对研究对象的影响规律。注意:选择数据要有效,且变量统一,否则无法做出正确判断。
例题3 (2016北京,28)以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
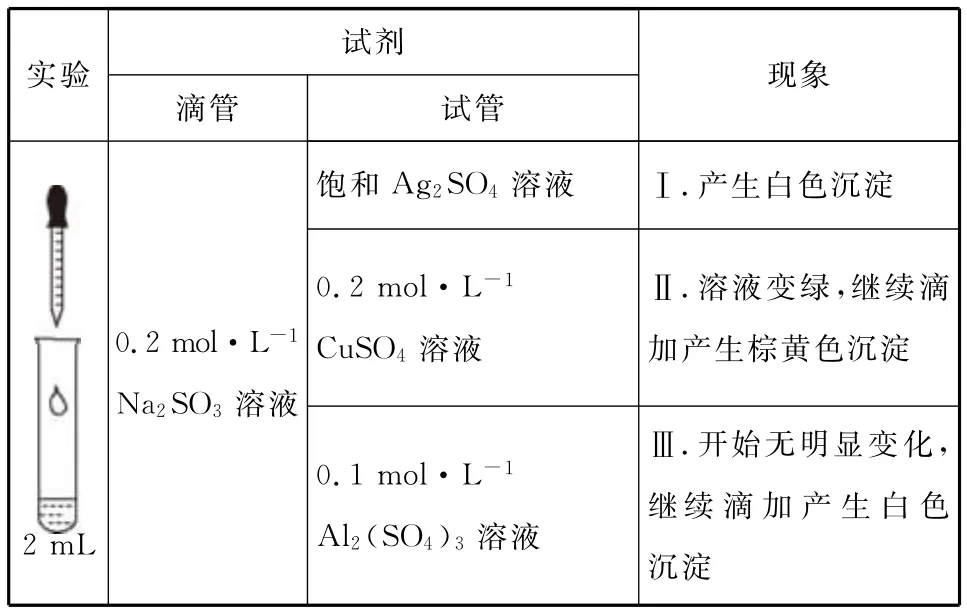
试剂_______________实验现象___________滴管________试管饱和Ag2SO4溶液Ⅰ.产生白色沉淀Ⅱ.溶液变绿,继续滴0.2mol·L-1Na2SO3溶液0.2mol·L-1CuSO4溶液加产生棕黄色沉淀Ⅲ.开始无明显变化,继续滴加产生白色2mL 0.1mol·L-1Al2(SO4)3溶液沉淀
(1)经检验,现象Ⅰ中的白色沉淀是Ag2SO3。用离子方程式解释现象Ⅰ:___________________________________。
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO2-4,含有Cu+、Cu2+和SO2-3。
①用稀硫酸证实沉淀中含有Cu+的实验现象是_____。
②通过下列实验证实,沉淀中含有Cu2+和SO2-3。
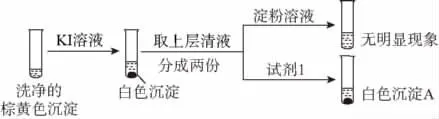
a.白色沉淀A是BaSO4,试剂1是________。
b.证实沉淀中含有Cu2+和SO2-3的理由是__________。
(3)已知:Al2(SO3)3在水溶液中不存在。经检验,现象Ⅲ的白色沉淀中无SO2-4,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。
①推测沉淀中含有SO2-3和________。
②对于沉淀中亚硫酸根的存在形式提出两种假设:i.被Al(OH)3所吸附;ii.存在于铝的碱式盐中。对假设ii设计了对比实验,证实了假设ii成立。
a.将对比实验方案补充完整。
步骤一:
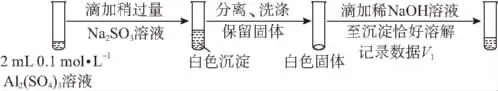
步骤二:________(按上图形式呈现)。
b.假设ii成立的实验证据是______________________。
(4)根据实验,亚硫酸盐的性质有________。盐溶液间反应的多样性与________有关。
【解析】(1)根据现象Ⅰ中的白色沉淀是Ag2SO3,可以得出离子方程式为↓;(2)根据信息Cu+的相关性质,可以得出加入酸后会有红色固体铜洗出;确认白色沉淀为硫酸钡,一般选取盐酸和氯化钡试剂检验,即试剂1是盐酸酸化的BaCl2溶液;证实沉淀中含有Cu+和SO2-3的理由是棕黄色沉淀与KI溶液反应生成白色沉淀(CuI),证明含有Cu+,白色沉淀A为硫酸钡,证明含有SO2-3;(3)①根据题意可知实验Ⅲ的白色沉淀中无SO2-4,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色,则①推测沉淀中含有亚硫酸根和氢氧化铝。②铝的碱式盐与氢氧化钠反应消耗的氢氧化钠的含量大于氢氧化铝,所以反应应该设计一个定量对比试验,根据白色固体消耗氢氧化钠的量不同来证实假设ⅱ成立,即V1明显大于V2,可说明沉淀中亚硫酸根存在于碱式盐中。(4)根据实验白色沉淀能使酸性高锰酸钾溶液褪色,说明亚硫酸盐具有还原性,另外亚硫酸根水解呈碱性。根据实验现象考点盐溶液间反应的多样性与盐的性质和溶液的酸碱性有关。
【答案】(1)2Ag+
(2)①有红色固体生成 ②a.HCl和BaCl2溶液 b.在I-的作用下,Cu2+转化为白色沉淀CuI,SO2-3转化为SO2-4
(3)①Al3+、OH-
(4)亚硫酸盐的溶解性、氧化还原性、在水溶液中的酸碱性 两种盐溶液中阴、阳离子的性质和反应条件
4.对实验方案设计与评价的探究
实验探究中还常常设计到一些实验方案的选取或设计,如何正确评价一个实验方案的优缺点,需要我们能够从多个角度分析,解题的关键点是实验设计要科学、简约、环保等。
例题4 (2016海南,17节选)某废催化剂含58.2%的SiO2、21.0%的ZnO、4.5%的ZnS和12.8%的CuS。某同学用15.0g该废催化剂为原料,回收其中的锌和铜。采用的实验方案如下:
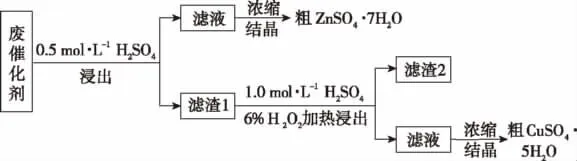
回答下列问题:
(1)在下列装置中,第一次浸出必须用________,第二次浸出应选用________。(填标号)

(2)第二次浸出时,向盛有滤液1的反应器中加入稀硫酸,后滴入过氧化氢溶液。若顺序相反,会造成_____________________。滤渣2的主要成分是________________。
【解析】(1)根据题意,第一次浸出时会因为ZnS与硫酸反应产生有毒H2S气体,该气体需要进行尾气的处理,所以选D装置;第二次反应为CuSO4+S+2H2O,不会产生有毒气体,可以选取装置A。(2)第二次浸出时,向盛有滤液1的反应器中先加入稀硫酸,后滴入过氧化氢溶液,若顺序相反,显然会造成H2O2与固体颗粒接触分解。
【答案】(1)D A (2)H2O2与固体颗粒接触分解
例题5 (2016四川,9节选)CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并进行相关探究。
【资料查阅】

【实验探究】该小组用下图所示装置进行实验(夹持仪器略)。

请回答下列问题:
(2)实验操作的先后顺序是a→_________→c(填操作编号)。
a.检查装置的气密性后加入药品
b.熄灭酒精灯,冷却
c.在“气体入口”处干燥HCl
d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:
①若杂质是CuCl2,则产生的原因是________________。
②若杂质是CuO,则产生的原因是_________________。
【解析】本题以热分解CuCl2·2H2O制备CuCl为载体考查化学实验探究、化学实验方案的设计与评价,解答本题首先要根据题给资料明确实验的原理,厘清题给装置图中每一个装置的作用和相关反应,结合CuCl2·2H2O、CuCl易水解,CuCl易被氧化的性质知实验过程中要注意防止空气的干扰,确定装置的连接顺序;针对问题(5),要根据杂质的成分结合题给资料分析杂质产生的原因。
【答案】(2)c d b (5)①加热时间不足或温度偏低②通入HCl的量不足
(作者单位:安徽省灵璧中学)

