新型微孔射频系统对组织的消融效果和并发症研究
新型微孔射频系统对组织的消融效果和并发症研究
【作 者】宋宇文1,徐秀林1,蔡雅萌2
1 上海理工大学,上海市,200093 2 上海微创电生理医疗科技股份有限公司,上海市,201318
目的 通过体外消融系统对新型微孔灌注消融导管的安全性和有效性研究,为临床实践提供参考依据。方法 在相同的射频系统条件下同步研究两种导管在心脏组织消融深度、组织温度和血栓形成方面的情况。结果 功率设置25 W时,两组消融深度比较无显著差异,均无Pop(组织内蒸汽爆裂)发生,无血栓形成;功率设置大于40 W时,两组发生Pop较多,并伴有血栓形成。结论 在高功率消融参数下进行心脏射频消融手术,术者应密切关注其并发症和血栓形成情况。
消融导管;体外试验;盐水灌注
0 引言
射频(RF)消融术是治疗心律失常的选择之一。该技术的目的是创造可预测心肌病变大小的创伤,同时最大限度地减少并发症的发生[1]。病变的大小取决于输送到组织的能量,但同时受限于局部血栓形成。
射频消融时电极-组织界面温度过高可能会形成血栓。开放式盐水灌注导管可主动冷却电极与组织界面温度,从而降低血栓形成风险,同时,允许在低血流区域(血流的被动冷却效果较差)使用更高的能量输出。在使用普通盐水灌注导管时,至少存在两个限制因素:一是对于消融范围较大或消融时间较长的病患,有接受相对大量的盐水用量的风险;二是由于普通盐水导管灌注孔数目较少,并只在头电极的近底部排列,无法有效冷却整个头电极,从而无法保证在任何电极-组织接触方式下的电极-组织界面都能得到充分灌注冷却。以上要求也许能通过让消融导管的头端电极布满灌注微孔来实现,因此,如果整个电极存在更多更小的灌注微孔,那么灌注过程中在整个头电极表面形成均匀的水膜,血栓形成的风险将减小,而所要求的灌注盐水量也将降低[2-6]。然而微孔电极消融的参数需要更精确的设置,否则会引起更高概率的并发症,因此,研究微孔消融导管对组织有效消融深度和并发症的影响,具有一定的临床指导意义。
1 资料与方法
1.1 微孔射频消融系统
本试验是基于一种冷盐水灌注消融导管系统进行操作的,该系统包括冷盐水灌注消融导管、耦联到该导管提供射频脉冲能量的射频仪、连接到该导管以设定的流量、累计流量和流量——时序中的至少一种来传送冷盐水的灌注泵,采用低温的冷盐水在消融时进行灌注,能够更加有效地对消融电极进行冲刷,更好地降低电极表面的温度,能够施加足够的消融能量,从而更有效地加深消融深度,消融系统装置如图1所示。
1.2 体外消融模型
体外消融模型是一种模拟体外射频消融装置及使用方法的装置,包括灌注泵、生理盐水、射频消融导管、模拟心脏装置、血液蠕动装置、射频仪、压力控制装置。其中压力控制装置控制射频消融导管的移动及压力值控制,通过射频仪对射频消融导管进行射频能量输入,使射频消融导管在模拟心脏装置中的心脏组织上进行消融。模拟心脏装置配有血液蠕动泵进行血液模拟循环。射频消融导管配有生理盐水及灌注泵进行盐水灌注。该模型弥补了现有技术尚无模拟体外射频消融装置及方法的空缺,通过调节,可以模拟不同压力及灌注流量状态,可用于不同状态消融效果的研究。体外消融模型装置如图2所示。
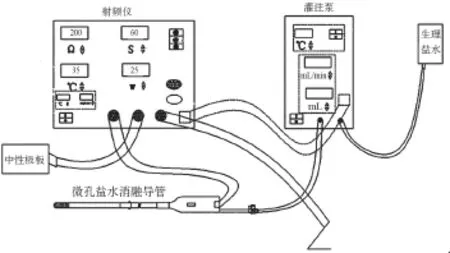
图1 冷盐水灌注消融系统装置示意图Fig.1 The schematic diagram for cool saline irrigated ablating system

图2 体外消融模型装置示意图Fig.2 The schematic diagram for in vitro ablating appliance model
1.3 研究方法
研究方法及步骤:①取新鲜猪心脏(宰杀4 h之内取用)的心室部位均匀切割成尺寸为长×宽×厚=(55±10) mm×(40±10) mm×(10±3) mm的实验样品,总数量为70±10块;②实验样品使用前10 min均匀浸泡于(37±1) ℃的生理盐水中,保持组织温度恒定;③采用高灵敏度拉伸机作为压力控制装置来控制导管的稳定贴靠力,实验过程中保证贴靠力在(20±2) g;④使用蠕动泵,设置蠕动频率为0.2 mL/ s来模拟血液冲刷;⑤使用恒温水浴槽,设置水浴槽温度为40℃,内部心脏模拟器内采用透明的小玻璃容器,并实时监测心脏模拟器内血液的实际温度,使其维持在(37~38) ℃。所有的导管的冷却灌注都使用1 000 U/L温度23 ℃的生理盐水(如图3所示);⑥将两种新型微孔设计盐水灌注消融导管分为A、B两组,其中A组为SC导管,B组为SF导管,分别记录分析;⑦两组装置参数设置均一致,功率为25 W时, 消融时间均为(30~60) s,流速为8 mL/min,功率为40 W和50 W时,流速为15 mL/min;⑧放电同时使用与导管内温度感应器一致的热电偶监测消融灶3 mm和7 mm深度的组织温度;⑨整个实验过程中使用肝素抗凝来保证血液活化凝血时间(ACT)>300 mL/min。

图3 体外消融实验过程Fig.3 The process of ablation in vitro
2 观察指标
①根据文献报道和前期实验研究得知,消融灶并非规整的球体,而是可以近似认定为某个特定形状[7-8]。通过测量消融灶大小评估导管的消融效果。②评估两种导管Pop(组织内蒸汽爆裂)发生情况。③在一定参数下,观察电极的血栓形成情况,给出血栓出现的临界消融参数。
3 统计学处理

图4 消融灶体积计算方法Fig. 4 Calculation method of ablation lesion volume
4 结果
共有来源于5头猪的70±10块符合要求的组织被进行消融试验研究,由于两组试验均采用相同的系统模型操作,因此除导管外,其他基线无差异,A组为FireMagic SC导管(以下简称SC导管),B组为ThermoCool SF NAV导管(以下简称SF导管),具体条件如表1所示。
4.1 组织消融深度、Pop发生情况及血栓形成情况
25 W、(30~60)s、8 mL/min放电参数下比较两种导管消融后的组织损伤程度,结果如表2所示。分别对组织损伤表面、最大直径和深度进行对比分析,A组织损伤最大深度为(5.5±0.5) mm,B组为(5.7±0.6) mm,P值为0.128 9,两者的消融深度无显著差异。安全性方面两组均没有出现Pop和血栓,说明在该消融参数下,能够达到阻隔内皮点传导神经(>3 mm;<7 mm),并且不会使心脏内壁局部温度过高出现Pop导致心脏穿孔的风险,血栓形成数据也显示该参数下是安全的。
40 W、8 mL/min参数下,由于长时间放电(60 s)会导致大面积的Pop发生,因此放电时间尽可能设置为30 s。A组织损伤最大深度为(7.1±0.7) mm,B组为(7.2±0.3) mm,P值为0.433 5,尽管两组的消融深度无显著差异,但是由于心脏内壁传导神经主要分布在(3~7) mm之间,因此,该参数下对组织损伤过大,建议临床使用时应尽量减少放电时间。安全性方面,Pop发生情况,A组为28%,B组为39%,说明容易导致心脏穿孔的风险。同时血栓出现情况,A组为17%,B组为25%。因此尽管该参数下进行体外消融能使部分组织达到预期效果,但是由于Pop和血栓发生概率较大,故临床上不推荐术者使用。采用50 W消融时,A组Pop发生概率为75%,血栓比例为50%,B组Pop发生概率为92%,血栓比例为50%,临床上并发症明显,不推荐术者使用。
研究结果显示两种导管消融灶大小无显著差异,表明SF导管和SC导管具有相同的消融有效性。极限消融参数下,Pop发生比例与血栓形成情况也极为相似,说明微孔盐水灌注导管在临床应用时应密切关注并发症的出现,并及时采取有效的处理措施。

表1 射频消融系统基线及参数设置Tab.1 base line and parameter setting for RF ablating system

表2 组织消融深度及并发症情况Tab.2 Tissue ablation depth and complications status
5 讨论
5.1 有效性及安全性
微孔灌注射频消融导管主要治疗房颤病症,其消融术式为环肺静脉隔离,需要在左右肺静脉口环形消融,每圈多达20~40个消融点,因此既要保证消融深度,又要尽可能减少相关心脏穿孔、心包填塞等并发症。本试验在25 W、(30~60) s、8 mL/min的消融参数下对组织消融,两组消融灶大小及形态无显著性差异,且无相关并发症情况发生,说明该参数下进行微孔导管消融,其有效性和安全性均可接受。
安全性数据上,不同功率下的Pop发生的时间,两种导管的表现基本一致。在40 W下Pop出现的时间区间总体在(40~60) s,而50 W下的Pop发生时间基本在(25~15) s区间内,由于大功率下,盐水流量也随之增大,使得导管与组织间会迅速形成高温,局部可达到90 ℃因而出现Pop,但是大功率下及时消融时间很短,组织没出现Pop,由于组织未能有效灼烧,其消融灶面积虽然很大,但是深度很浅,未能达到阻隔内壁电传导神经的目的。温度曲线上,在消融前期的温度上升速率两组基本一致,至20 s附近时出现Pop情况较多,组织内部渗入生理盐水导致组织温度下降,Pop发生后的组织消融温度出现差异,可能是由于Pop程度与组织结构有关,Pop造成的组织缺损大小难以控制导致了消融组织温度变化的差异。采用微孔导管进行心脏消融时,不推荐大功率参数,术者若采用大于35 W的功率放电时,应充分考虑心脏穿孔风险。
血栓发生情况,不同功率下的血栓发生情况差异很大,主要血栓部位在电极上下边缘部位,其中很大原因是由于大功率下Pop发生较多,电极边缘区域无法形成有效的盐水冲刷,局部温度较高,使得组织粘连在区域。同样术者手术时也会出现相类似的条状血栓, 因此房颤手术前对患者全身抗凝并不能完全杜绝卒中的风险,控制手术过程中血栓形成也不容忽视。
5.2 本研究特点及局限性
本研究主要能对组织切块体外消融,在外界条件可控的条件下,肉眼可见组织损伤的程度,对Pop并发症和血栓形成情况进行量化分析,给予术者一定的临床指导,在保证有效性的前提下,尽量减少安全风险。但是体外消融模型与人体环境还是有很大差异,尽管采用新鲜猪血加抗凝剂来模拟血液环境,但是随着时间延长,血栓形成更难,抗凝效果更明显。因此术者采用该参数消融时可适当调整消融时间。
[1] Morady F. Radio-frequency ablation as treatment for cardiac arrhythmias[J]. N Engl J Med, 1999, 340(7): 534-544.
[2] Demazumder D, Mirotznik M S, Schwartzman D. Comparison of irrigated electrode designs for radiofrequency ablation of myocardium[J]. J Interv Card Electrophysiol,2001, 5(4): 391-400.
[3] Demazumder D, Mirotznik M S, Schwartzman D. Biophysics of radiofrequency ablation using an irrigated electrode[J]. J Interv Card Electrophysiol, 2001, 5(4): 377-389.
[4] Dorwarth U, Fiek M, Remp T, et al. Radiofrequency catheter ablation: Different cooled and noncooled electrode systems induce specific lesion geometries and adverse effects profiles[J]. Pacing Clin Electrophysiol, 2003, 26(7): 1438-1445.
[5] Yokoyama K, Nakagawa H, Wittkampf F H, et al. Comparison of electrode cooling between internal and open rrigation in radiofrequency ablation lesion depth and incidence of thrombus and steam pop[J]. Circulation, 2006, 113(1): 11-19.
[6] Everett TH 4th, Lee K W, Wilson E E, et al. Safety profiles and lesion size of different radiofrequency ablation technologies: Acomparison of large tip, open and closed irrigation catheters[J]. J Cardiovasc Electrophysiol, 2009, 20(3): 325-335.
[7] Guerra J M, Torge E, Raga S, et al. Effects of open-irrigated radiofrequency ablation catheter design on lesion formation and complications: in vitro comparison of 6 different devices[J]. J Cardiovasc Electrophys, 2013, 24(10): 1157-1162.
[8] Javier Moreno. Morphological and thermodynamic comparison of the lesions created: by 4 open-irrigated catheters in experimental models[J]. J Cardiovasc Electrophys, 2014, 25(12): 1391-1399.
Study of New Micropore RF system on Lesion Formation and Complications
【 Writers 】SONG Yuwen1, XU Xiulin1, CAI Yameng2
1 University of Shanghai for Science and Technology, Shanghai, 200093 2 Shanghai Microport EP MedTech Co., Ltd, Shanghai, 201318
ablation catheter, in vitro, saline-irrigation
R541.7
A
10.3969/j.issn.1671-7104.2017.04.020
1671-7104(2017)03-0306-03
2016-11-30
宋宇文,E-mail: ywsong@microport.com
【 Abstract 】Objective To study the safety and effectiveness of a new type of micropore ablation catheter in vitro ablation system, and to provide reference for clinical practice. Methods To evaluate two kinds of catheter in cardiac tissue ablation depth, tissue temperature and thrombosis situation by the same RF system. Results The power set 25 W, There was no significant difference in ablation depth between the two groups, and no Pop and thrombosis occurred. When the power is more than 40 W, two groups occurred more Pop and thrombosis. Conclusion When using high power for Cardiac RF ablation, doctors should pay more attention to complications and thrombosis.

