胶质细胞源性神经营养因子对股骨头缺血坏死的保护作用
喻钧伦 唐曦 肖文 黄雨 罗天友* 吴少平*
1.重庆医科大学附属第一医院放射科,重庆 400016 2.成都医学院第一附属医院放射科,四川 成都 610500
激素性股骨头坏死属于股骨头缺血性坏死(avascular necrosis of the femoral head, ANFH)的一种,其发生机制涉及多种因素,既往认为激素在体内长期蓄积造成血液粘稠度增加,血脂增高,脂肪栓塞,造成骨的微细血管阻塞,以及骨质合成减少,钙质吸收障碍,发生骨质疏松及微细骨折,最后导致股骨头缺血坏死[1,4]。随着激素在临床中的广泛使用,激素性股骨头坏死的发病率也越来越高,是严重危害人类健康的慢性病[3]。
激素性股骨头坏死早期股骨头坏死区域少,变形小,治疗效果较好[3,4],目前包括物理、药物治疗及外科手术等多种治疗技术[4,6],在激素性股骨头坏死的早期治疗有积极效应,但远期效果并不理想。因此,寻找积极有效的干预措施,防治早期股骨头缺血坏死的发生及发展是国内外关注的焦点。
正常股骨头内存在肽能神经元,股骨头坏死后感觉神经损伤,调节骨内微循环的神经肽分泌减少,可导致破骨与成骨活动失衡,破骨细胞作用增强,骨细胞死亡,骨矿物质含量降低,从而使骨形成减弱,造成骨质疏松、骨小梁细微骨折等严重后果,故股骨头神经内分泌与骨内微循环相关研究渐受重视[7,8]。
1993年Lin[9,12]提出从大鼠神经胶质细胞系B49的培养液提纯并命名——胶质细胞源性神经营养因子,属于转化生长因子β超家族成员之一。GDNF在体内分布广泛,对神经系统的发育、生长、损伤及修复过程中都具有重要神经营养作用[9,12]。GDNF应用于股骨头坏死动物模型的研究目前尚无报道,故我们假设,股骨头坏死发生后,GDNF可否通过对受损的神经进行营养、修复,改变其内部微循环系统,从而达到调节骨质形成、稳定骨小梁的目的。
综上,本实验利用GDNF干预早期激素性股骨头坏死兔模型,探讨GDNF对激素性股骨头坏死的保护作用,并为激素性股骨头坏死的治疗提供新思路。
1 材料与方法
1.1 材料
SPF级新西兰大白兔购于成都达硕生物科技有限公司;GDNF购于美国RICKY公司;SOMATOM Definition AS+64排螺旋CT出自德国SIEMENS公司,显微CT出自广州中科恺盛医疗科技有限公司,组织切片机出自美国Thermo Scientific公司,正置显微镜出自德国Lecia公司。
1.2 方法
1.2.1 建立动物模型:SPF级新西兰大白兔,雄性,10月龄,单笼饲养,自由饮水,标准颗粒饲料喂养。经成都医学院第一附属医院动物伦理学委员会批准,按动物实验3R原则给予人道关怀。适应性喂养1周后,采用激素联合脂多糖改良技术建立激素性股骨头坏死兔模型[13]。建模第1、2周,随机选取1只处死,取股骨头组织作病理学观察,验证是否发生坏死。
骨坏死诊断标准为:骨小梁内见弥漫性骨细胞空陷窝或核皱缩,伴有周围骨髓细胞坏死[14]。
1.2.2 药物干预:建模完成后,采用数字表法随机分组并标记,分为实验组(n=12)、对照组(n=12)。实验组给予髋周肌肉注射GDNF(8.0 μg/只),对照组相同部位注射等体积生理盐水,干预1周。分别于第5、10、15、20 天两组各随机选取3只,依次进行以下指标的观察。
1.2.3 螺旋CT扫描:采用10%水合氯醛腹腔注射麻醉(4.0 mL/kg)新西兰大白兔,行64排螺旋CT扫描,俯卧位,选用成人胸骨序列,0.6 mm骨重建算法扫描双髋关节,由两名医师共同阅片,观察兔股骨头形态及骨质密度等影像学表现。
1.2.4 显微CT扫描:采用空气栓塞法处死新西兰大白兔,解剖出股骨头,行显微CT扫描,冠状位,管电压60 kvp,功率40 W,电流0.67 mA。CT阈值切割取225~700 HU的全骨组织[15],感兴趣区选择骨皮质下与骺板之间,半径为1.0~1.5 mm的圆形区域。观察骨小梁的形态、分布,骨皮质厚度,并测定骨矿物质密度(bone mineral density, BMD)、组织矿物质密度(tissue mineral density, TMD)、骨体积分数(bone volume/total volume, BV/TV)值。
1.2.5 H&E染色:骨组织标本经4.0%多聚甲醛固定48小时,酸性脱钙液脱钙36小时。冠状位取材,梯度乙醇脱水,浸蜡,包埋,作4.0 μm切片,H&E染色后正置显微镜下观察股骨头内骨小梁、骨细胞形态及坏死情况,并计算骨细胞空陷窝百分率。
1.3 统计分析
2 结果
2.1 SANFH兔模型构建
为了后续实验的开展,采用激素联合脂多糖改良技术建立激素性股骨头坏死兔模型,在建模第1、2周分别选取兔股骨头,切片后H&E染色观察发现:第2周股骨头软骨下骨小梁变细、稀疏,不连续;骨细胞沿骨小梁成串分布,细胞核不均一,形态变扁,数目减少,空骨细胞呈空泡状,散在分布,脂肪细胞增多(图1)。以上结果符合股骨头坏死病理学改变,说明早期激素性股骨头坏死兔模型构建成功。
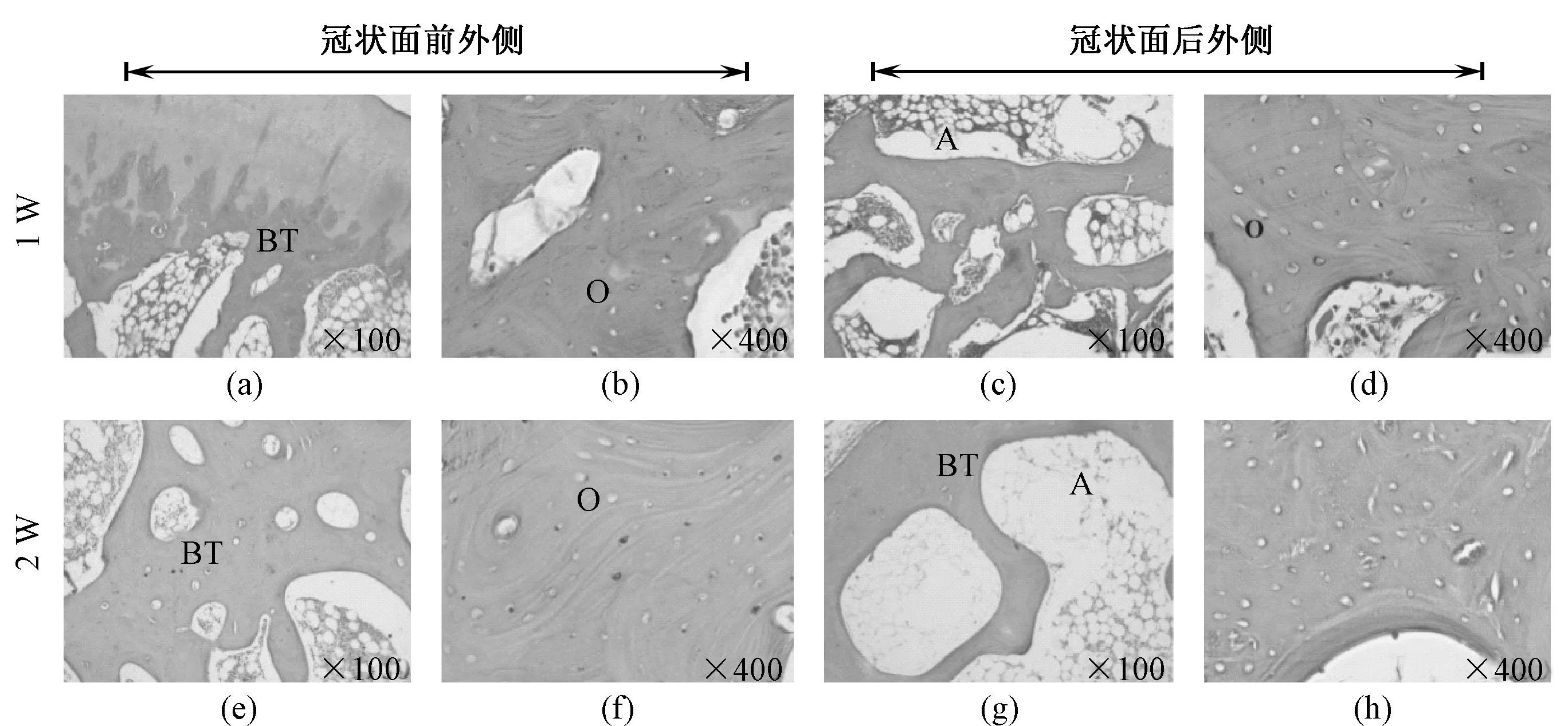
图1 SANFH兔模型构建成功[13]Fig.1 SANFH rabbit model has been successfully constructed[13](a) (b) (c) (d) H&E staining after 1 week of modeling; (e) (f) (g) (h) H&E staining after 2 weeks of modeling; (a) (b) (e) (f) Anterolateral area of femoral head (coronal); (c) (d) (g) (h) Posterolateral area of femoral head (coronal) (BT, bone trabecula; O, osteoblast; A, adipocyte)
2.2 GDNF可使骨密度增加
为了观察GDNF对激素性股骨头坏死兔骨质密度的影响,在给药后第5、10、15、20天分别对实验组、对照组进行双髋关节螺旋CT扫描,观察发现:两组股骨头形态保持完整,关节面较光滑,骨皮质厚度相当;与对照组相比,第15、20 天实验组骨松质呈磨玻璃样影,骨质密度增高,尤以第20天明显;对照组股骨头骨质密度欠均匀,骨质密度减低,以第10天骨质密度最低(图2)。以上结果表明,GDNF可保持股骨头形态完整,增加骨松质密度。
2.3 GDNF可促进骨小梁的形成
为进一步观察GDNF对激素性股骨头坏死兔骨内部结构的影响,在给药后第5、10、15、20 天分别取实验组、对照组行显微CT扫描,观察发现:实验组与对照组第5、10天骨小梁分布稀疏,间距增宽,部分断裂,骨密度较低;实验组第15、20天骨小梁逐渐丰富、密集,间距变窄,骨皮质厚度增加,骨质密度增高;与对照组比较,实验组股骨头内骨小梁数量更多,骨皮质更厚,骨质密度更高(图3)。以上结果表明,GDNF可促进股骨头内部骨小梁的修复,骨皮质的形成。
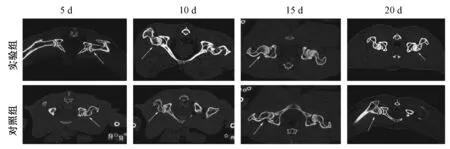
图2 GDNF可增加骨密度Fig.2 GDNF increased the bone density of the femoral headBone density of SANFH rabbits detected by CT images at 5, 10, 15 and 20 days post treatment. (arrows, femoral head)
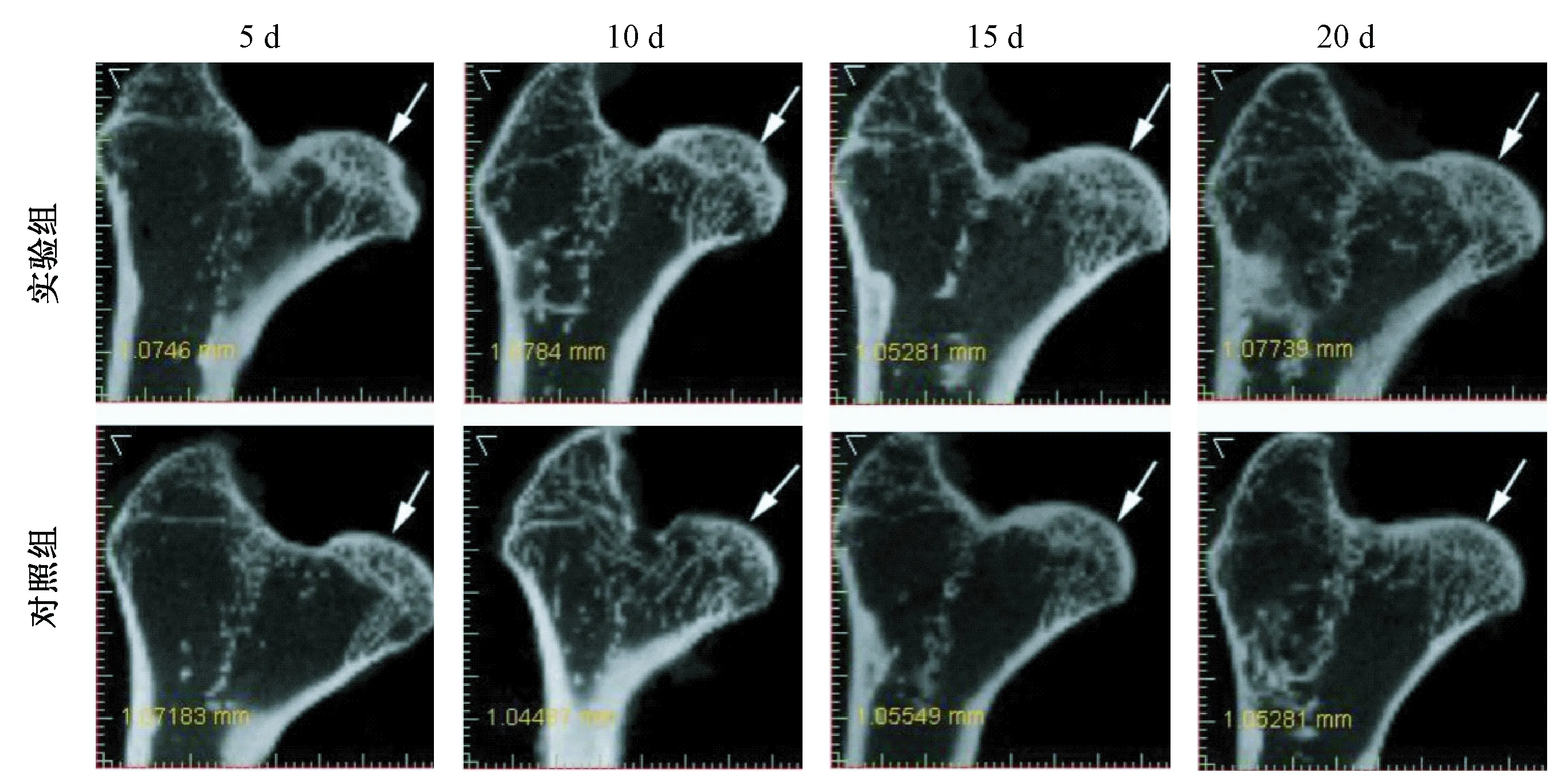
图3 GDNF可促进骨小梁的形成Fig.3 GDNF promoted trabeculae formationThe trabeculae of SANFH rabbits detected by Micro-CT images at 5, 10, 15 and 20 days post treatment. (arrows, femoral head)
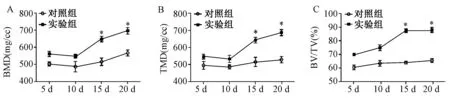
图4 BMD、TMD和BV/TV值的变化Fig.4 The variation of BMD, TMD and BV/TVBony masses detected by Micro-CT scanning analysis. *P < 0.05 compared with the control group
2.4 GDNF可影响骨相关参数的改变
为进一步验证GDNF对激素性股骨头坏死的影响,分析显微CT相关参数显示:实验组、对照组的股骨头BMD、TMD变化趋势近乎一致,除第10天数值较低外,基本上呈上升趋势;随着观察时间延长,实验组BV/TV值逐步增高,而对照组BV/TV值总体趋势变化不明显;与对照组比较,实验组在第15、20天BMD、TMD、BV/TV值均明显高于对照组(P<0.05)(图4)。以上结果表明,GDNF可增高股骨头内部骨质密度,保持骨小梁完整性。
2.5 GDNF可抑制骨细胞的病理学检测结果
病理学研究GDNF对激素性股骨头坏死的影响。在给药后第5、10、15、20 天分别取实验组、对照组行兔股骨头切片、H&E染色,观察发现:实验组股骨头内骨小梁分布较稀疏,骨细胞分布广泛,随观察时间延长,骨细胞核着色增多,脂肪细胞分布减少;对照组骨小梁形态不完整,部分断裂,分布稀疏,随时间延长,骨细胞空陷窝和脂肪细胞逐渐增多,骨细胞和造血细胞逐渐减少;两组比较,实验组第15、20天骨细胞空陷窝百分率显著低于对照组(P<0.05)(图5、表1)。以上结果表明,GDNF可通过抑制骨细胞坏死,保持骨小梁完整,对早期激素性股骨头坏死有潜在的保护作用。
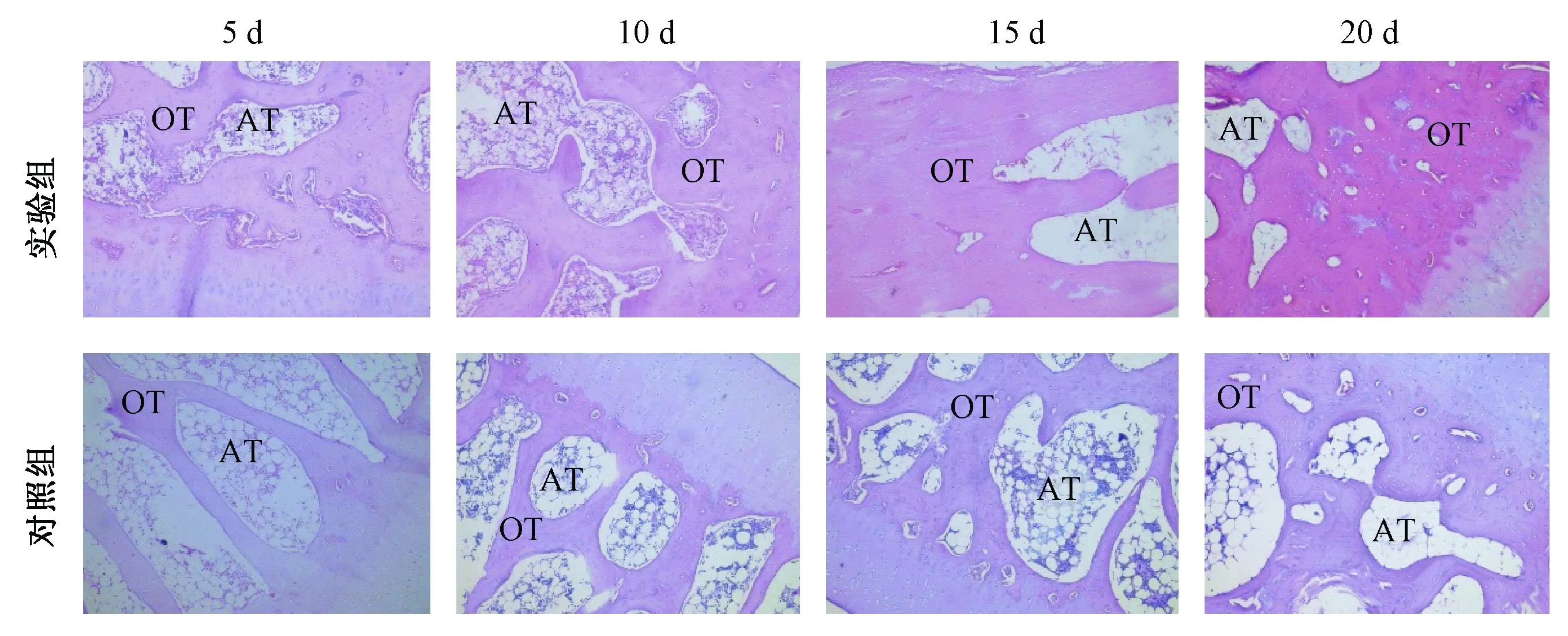
图5 GDNF抑制骨细胞坏死(×100)Fig.5 GDNF inhibits bone cell necrosis (×100)Histologic results of femoral head detected by H&E staining (×100). (OT, osseous tissue; AT, adipose tissue)

组别5 d10 d15 d20 d实验组26.3±7.925.3±3.513.3±3.2*10.6±2.4*对照组29.7±7.426.0±2.871.0±7.578.6±5.3
与对照组比较,实验组第15,20天股骨头骨细胞空陷窝率有统计学意义(*P<0.05)
Compared with the control group, the percentage of empty bone lacunae of femoral head in the experimental group was significantly lower at 15 and 20 days.(*P<0.05)
3 讨论
糖皮质激素导致的股骨头坏死是非创伤性股骨头缺血坏死最重要的发病机制之一,长期或短期过量使用糖皮质激素常作为独立的高危因素[16,17],它可导致股骨头局部血运障碍,引起骨细胞缺血、缺氧和坏死,进一步发生骨小梁断裂及股骨头塌陷。在股骨头坏死发展过程中,股骨头变形塌陷,药物治疗效果很难令人满意,髋关节成形手术治疗成了必然选择[18]。因此,在股骨头坏死早期针对性的有效干预,诱导骨再生,保护骨细胞,有望成为防治股骨头缺血坏死的有效治疗手段[19]。据此,本实验通过建立激素性股骨头坏死动物模型,探索GDNF对兔早期激素性股骨头坏死的影响。
GDNF属于TGF-β超家族成员,可被神经末梢摄取,逆向运输致胞体,在神经系统的发育、生长、损伤和修复中都具有重要的神经营养作用[10,20]。研究报道,GDNF在中枢神经系统可特异性作用于多巴胺能神经元,在脑缺血、缺氧中对神经元进行保护。因此,GDNF在中枢神经系统多巴胺能神经元损伤所致的帕金森病研究较多[9,21]。另有学者提出GDNF对周围神经系统均有营养和保护作用, 可促使神经元再生、减少细胞凋亡及促进存活作用[9,12]。
本实验结果显示,GDNF对早期股骨头坏死具有潜在保护作用。一方面,GDNF可保持股骨头形态完整,增大股骨头骨质密度。在股骨头CT检测结果中,两组股骨头形态完整,实验组股骨头内松质骨密度较对照组增高。由于螺旋CT分辨率不及显微CT高,在兔股骨头内细微结构显示效果欠佳,我们进一步通过显微CT检测,观察GDNF对激素性股骨头坏死兔骨内部结构的影响。结果发现,实验组股骨头内骨小梁数量更多,骨皮质更厚,骨质密度更高,结果表明GDNF可促进股骨头内部骨小梁的修复,骨皮质的形成,表现为骨矿物质密度的增加。
同时有研究证实,激素性股骨头坏死可对骨代谢诸多环节产生影响,如成骨细胞分化、骨细胞凋亡,以及脂质代谢、钙代谢、微循环紊乱。对照组骨小梁分布稀疏,间距增宽,部分断裂,可能原因是破骨细胞作用增强,骨小梁发生微细骨折,表现在骨小梁数目和厚度的减少[22,23]。GDNF可能通过营养骨内神经,抑制破骨细胞作用,增强成骨细胞功能,对股骨头内骨小梁进行修复、重建,促进了骨质形成。
另一方面,GDNF可抑制骨细胞坏死,保持骨小梁完整。病理学结果进一步证实,对照组股骨头内骨细胞空陷窝数均高于实验组,骨小梁形态不规则,断裂,脂肪细胞变大、增多,造血细胞减少,坏死发生明显严重,实验组股骨头内骨小梁形态完整,骨细胞分布广泛,脂肪细胞较少。该结果表明注射GDNF对兔股骨头缺血坏死早期促进了骨质修复,保持了骨小梁的完整性,阻断了骨细胞坏死的进一步发展。本实验结果显示,GDNF可能通过营养股骨头内损伤的神经,进而增强成骨细胞功能,调节骨内微循环平衡,从而促进骨质修复,调节骨的形成,保持骨小梁完整,是否对早期股骨头坏死具有潜在的保护作用还需要进一步研究。
虽然本研究取得了一定成果,但仍存在诸多缺陷。接下来,本研究将继续加大样本量,通过CT、核磁共振、骨活检等体内实验以及Western blot、免疫组化、钙盐沉积等体外实验,进一步探讨GDNF干预激素性股骨头坏死早期病程的研究。

