星形胶质细胞与GnRH神经元共培养可通过谷氨酸受体介导促进GnRH神经元分泌
陈 勇
星形胶质细胞与GnRH神经元共培养可通过谷氨酸受体介导促进GnRH神经元分泌
陈 勇
目的 探讨下丘脑促性腺激素释放激素(GnRH)神经元与星形胶质细胞共培养对GnRH神经元的影响及其可能的相关机制。 方法 利用Transwell共培养系统,将GnRH神经元细胞株GT1-7与原代星形胶质细胞共培养10 d。免疫组织化学法检测GnRH神经元中谷氨酸受体(GluR)的分布,蛋白免疫印迹法检测GluR在GnRH神经元中的表达,并分别通过高效液相色谱法和酶联免疫吸附法检测培养上清中的谷氨酸(Glu)和GnRH的浓度变化。 结果 共培养组的GnRH神经元发生mGluR5和GluR1/2/3/4从胞质到胞核的移位,在胞核中的表达较单纯GT1-7培养组显著增加(P<0.05),且Western-blot检测与免疫荧光检测结果一致。HPLC和ELISA检测结果表明,与单纯GT1-7培养组比较,共培养组上清中的Glu浓度显著减少,而GnRH的分泌则明显增加(P<0.05)。 结论 GnRH神经元与星形胶质细胞共培养可通过改变GluR(代谢型或离子型)在细胞内的定位与表达,从而增加GnRH的分泌。
神经元; 促性腺激素释放激素; 神经胶质; 星形细胞; 共同培养技术; 受体,谷氨酸
下丘脑促性腺激素释放激素(gonadotropin-releasing hormone, GnRH)神经元是生殖内分泌调控的中枢,在性别分化、性腺发育以及生殖过程中起重要调节作用,是性生理和性行为的重要介导者。GnRH神经元的分泌受各种内外因素的影响,但其分泌调控机制迄今尚未完全明确。星形胶质细胞的功能长期以来被认为仅限于为神经元提供支持、保护和营养。近年来,星形胶质细胞的作用越来越受到人们重视,相关研究也取得了很大进展。星形胶质细胞通过调节GnRH神经元的活性和分泌来影响生殖生育已成为研究热点,但其机制并未完全阐明。本研究利用GnRH神经元细胞株即GT1-7与星形胶质细胞共培养,旨在探讨星形胶质细胞如何影响GnRH神经元的分泌活动,并对可能机制做初步分析。
1 材料与方法
1.1 材料 细胞及动物:GT1-7细胞株(上海交通大学医学院附属瑞金医院内分泌研究所李小英教授赠送);C57BL/6J小鼠清洁级[上海斯莱克实验动物有限责任公司,许可证号:SCXK(沪)2007-0005]。试剂:DMEM培养基、胎牛血清(美国Invitrogen公司);RIPA和PMSF(上海申能博采生物科技有限公司);BCA Protein Assay Kit(美国Pierce公司);ECL试剂盒和PVDF膜(英国Amersham Biosciences公司);mGluR5(N-14)抗体、GluR1/2/3/4(H-180)抗体及辣根过氧化物酶(HRP)标记的山羊抗兔IgG抗体(美国Santa Cruz公司);Lamin B1抗体(武汉博士德生物工程有限公司);辣根过氧化物酶标记驴抗山羊IgG抗体(江苏碧云天生物技术公司);GnRH检测试剂盒(Cat no:S-1217,美国半岛实验室)。
1.2 方法
1.2.1 GT1-7的传代培养 GT1-7细胞常规复苏,加入培养液(含4.5 g/L葡萄糖的DMEM+10%胎牛血清+100 IU/mL青霉素+100 μg/mL链霉素),于37 ℃、体积分数为0.05的CO2培养箱中培养,每2 d换液1次,长满80%时按1∶3传代培养。
1.2.2 小鼠原代星形胶质细胞培养 参照文献[1]:新生1~3 d的C57BL/6J小鼠,75%酒精喷洒消毒,置无菌培养皿,断头,取全脑,解剖显微镜下去除小脑、脑干和嗅球,分离大脑皮层,去除脑膜及血管膜。将大脑皮层移入一干净离心管,加入含有20 U/mL木瓜蛋白酶的盐溶液(pH=7.2)4 mL,37 ℃水浴消化20 min,每5 min晃动1次[盐溶液配方:NaCl 137,KCl 5.3,MgCl21,葡萄糖25,HEPES 10,CaCl23(单位:mmol/L),以及0.5 mmol/L EDTA和0.2 mg/mL L-半胱氨酸]。吸弃盐溶液,用含10% FBS的培养基(DMEM培养基+10% FBS+10 U/mL青霉素+10 U/mL链霉素)洗2遍终止消化反应。加入2~3 mL培养基吹打(约4~5次),使组织分散。静置,待较大组织块沉淀后,吸取上清,收集于干净离心管。重复前两步,直至组织块消失。将收集到的细胞计数,若细胞数量较多,则稀释后计数,采用台盼蓝染色(1∶1)。根据实际情况将细胞稀释到合适浓度(1×105~5×105mL-1)接种。72 h后换液,之后3~4 d换液1次,胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP)染色鉴定细胞阳性率超过90%。
1.2.3 GT1-7与原代星形胶质细胞共培养 利用Transwell系统(美国Corning公司),先将GT1-7常规消化,每孔1 mL细胞悬液接种至6孔板中,后每孔加上Transwell板,在Transwell板上接种1.5 mL原代星形胶细胞悬液,上下孔间的细胞并不直接接触但可通过半透膜进行物质交流,每2 d半量换液1次,共培养10 d,取细胞上清液测GnRH和谷氨酸(glutamate,Glu)水平,对GT1-7细胞则抽取核蛋白(进行免疫荧光检测的GT1-7细胞需接种至高压灭菌过的盖片上),同时设单纯GT1-7培养组为对照组。
1.2.4 培养液上清中GnRH浓度的检测 共培养10 d时,先将培养液更换为含0.2% BSA的无血清高糖DMEM培养液孵育16 h,而后将培养液更换为Locke’s Mediums[NaCl 154,KCl 5.6,CaCl22.2,MgCl21,NaHCO36,葡萄糖10,HEPES 2(单位:mmol/L),bacitracin 20 μmol/L]孵育1 h,收集上清,-80 ℃冻存,ELISA方法测定GnRH水平,按GnRH检测试剂盒说明书操作。具体如下:先配制EIA缓冲液和标准品,而后在96孔板中每孔加入50 μL标准品或样品,再加入25 μL抗血清,空白孔加75 μL EIA缓冲液,常温孵育1 h,每孔加入BT-示踪剂25 μL,常温孵育2 h,每孔用300 μL EIA缓冲液洗涤5遍,每孔加入100 μL抗生物素化蛋白链菌素的HRP,常温孵育1 h,用EIA缓冲液洗涤5遍,每孔加100 μL底物TMB,常温放置40 min,可见形成蓝色产物,每孔加入100 μL 2 mol/L的HCl终止反应,立即用全波长酶标仪测OD450 nm。对照标准曲线换算出样品的GnRH浓度。
1.2.5 培养液上清中胞外Glu浓度的检测 方法同1.2.4,培养液更换为含0.2% BSA的无血清DMEM培养液后8 h,收集培养液中的上清各10 μL进行Glu的检测,胞外Glu含量使用高效液相色谱仪(1525,美国Waters公司)进行检测。过程如下:收取10 μL待测样品,加入50 μL OPA标记氨基酸,使用一定量0.05 mol/L的NaOH稳定氨基酸的OPA衍生物,并将样品稀释20倍,然后放置于4 ℃的自动进样器(2707,美国Waters公司)。使用Breeze软件设置进样体积为10 μL。使用C18色谱柱将样品中的Glu分离,流动相A由25 mmol/L醋酸钠、0.4% 1,4-二恶烷及4.3% 2-异丙醇组成,用醋酸调节pH至5.9;流动相B由97%甲醇、1.5% 1,4-二恶烷及1.5% 2-异丙醇组成。激发光波长338 nm,发射光由450 nm荧光检测器(2475,美国Waters公司)。同时检测标准品(5 μmol/L Glu),换算出样品的Glu浓度[1]。
1.2.6 免疫组织化学检测GT1-7细胞中谷氨酸受体(glutamate receptor,GluR)的定位与表达 各孔吸弃培养基,用0.01 mol/L PBS洗3遍,4%多聚甲醛(每孔0.5 mL)固定10 min,PBS洗3次,每次10 min。封闭液(0.1% PBST+5%驴血清)室温封闭1 h,各孔加入一抗(mGluR5 1∶50稀释,GluR1/2/3/4 1∶50稀释,用封闭液配制)200 μL,4 ℃孵育过夜。PBST洗涤6次,每次10 min,各孔加入相应的二抗(驴抗羊488、驴抗兔488,PBS稀释1∶1 500)200 μL,室温孵育1 h,PBST洗涤6次,每次10 min;DAPI复染5 min(PBS稀释1∶4 000),吸弃DAPI,用5 mL注射器针头挑起盖片,用眼科镊夹取边缘并倒放至多聚赖氨酸包被的载玻片上,用指甲油封边,于暗盒中避光保存,共聚焦显微镜观察实验结果。
1.2.7 蛋白免疫印迹(Western-blot)检测GT1-7细胞核中GluR的表达变化
1.2.7.1 提取核蛋白 采用核蛋白提取试剂盒(货号P0028,江苏碧云天生物技术公司),具体如下:GT1-7细胞用PBS洗1遍,用细胞刮子刮下细胞,并用移液器吹打下细胞。离心收集细胞,吸尽上清,留下细胞沉淀备用。每20 μL细胞沉淀加入200 μL添加了PMSF的细胞质蛋白抽提试剂A,最高速剧烈Vortex 5 s,把细胞沉淀完全悬浮并分散开,冰浴10~15 min;加入细胞质蛋白抽提试剂B 10 μL,最高速剧烈Vortex 5 s,冰浴1 s;最高速剧烈Vortex 5 s,4 ℃ 15 000 g离心5 min。立即吸取上清至一预冷的塑料管中,即为抽提得到的细胞质蛋白。对于沉淀,完全吸尽残余的上清,加入50 μL添加了PMSF的细胞核蛋白抽提试剂,最高速剧烈Vortex 30 s,把细胞沉淀完全悬浮并分散开,冰浴,每隔2 min再高速剧烈Vortex 30 s,共30 min。4 ℃ 15 000 r/min离心10 min,立即吸取上清至一预冷的塑料EP管中,即为抽提得到的细胞核蛋白,-80 ℃冻存。
1.2.7.2 GT1-7细胞核中GluR的表达 采用蛋白浓度检测试剂盒(美国Pierce公司),BCA方法测定GT1-7细胞的核蛋白浓度。根据测定的核蛋白浓度以及上样蛋白量20 μg计算上样的体积。采用8%分离胶,电泳分离目的蛋白(mGluR5和GluR1/2/3/4)及核蛋白内参(Lamin B1),而后采用Bio-rad转膜系统电泳转移到PVDF膜上。PVDF膜首先用封闭液(含有0.05% Tween 20和5%脱脂奶粉的TBS缓冲液)于室温孵育1.5 h,而后用不同一抗(GluR1/2/3/4 1∶250,mGluR5 1∶200,Lamin B1 1∶200)4 ℃孵育过夜,用TBST洗涤3次后,膜用交联有HRP的相应二抗(山羊抗兔二抗 1∶2 000,驴抗山羊二抗1∶1 000)室温孵育2 h。TBST洗膜3次,条带用ECL发光法进行显色,在暗盒中曝光至胶片(日本柯达公司)上,扫描后通过Quantity one软件进行定量分析。
2 结 果
2.1 原代星形胶质细胞GFAP染色鉴定结果 经GFAP免疫荧光染色,原代星形胶质细胞胞质呈红色(箭头所示),阳性率约为92%(图1)。
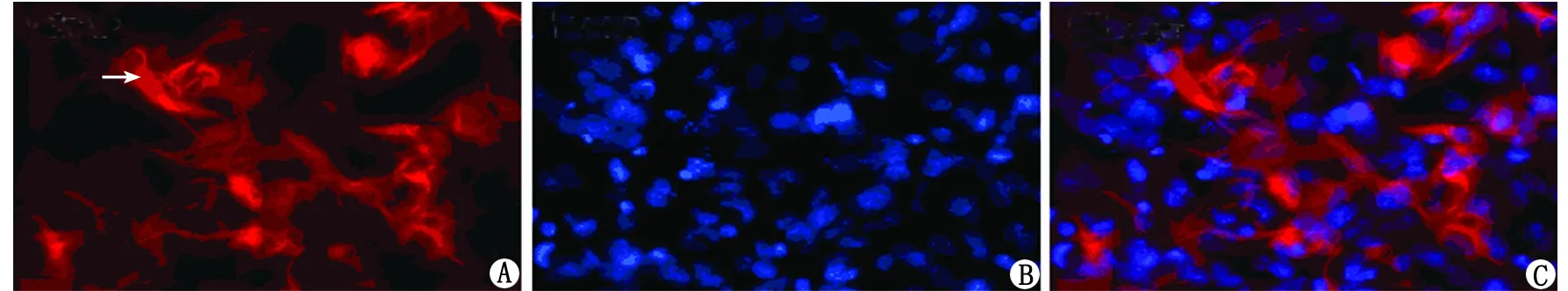
A:GFAP; B:DAPI; C:Merge.图1 原代星形胶质细胞的GFAP染色鉴定结果Fig 1 The GFAP staining of primary astrocyte tested by immunofluorescence
2.2 上清中GnRH及Glu的测定结果 ELISA检测结果显示,与单纯GT1-7培养组比较,GT1-7与星形胶质细胞共培养组GnRH的分泌显著增加(P<0.05,图2A)。HPLC检测结果显示,与单纯GT1-7培养组比较,共培养组上清中的GluR水平分泌显著减少(P<0.05,图2B)。

A:GnRH水平;B:Glu水平. Glu:谷氨酸. 与单纯GT1-7培养组比较,☆:P<0.05.图2 上清中的GnRH及Glu水平Fig 2 The secretion level of GnRH and the glutamate concention in supernatant
2.3 免疫组织化学检测结果 GT1-7与星形胶质细胞共培养组GT1-7细胞中的mGluR5和GluR1/2/3/4(即绿色荧光位置,箭头所示)出现从胞质到胞核的移位(图3)。
2.4 Western-blot检测结果 与单纯GT1-7培养组比较,GT1-7与星形胶质细胞共培养组GT1-7细胞即GnRH神经元胞核中mGluR5和GluR1/2/3/4的表达均显著增加(图4~5)。
3 讨 论
人类生殖活动受下丘脑-垂体-性腺轴的调控,GnRH是由下丘脑弓状核的GnRH神经元合成、分泌,并贮存于正中隆起[2],以脉冲式分泌的方式进入垂体门脉系统或经脑脊液进入血液。GnRH能促进垂体前叶促性腺激素细胞分泌卵泡刺激素和黄体生成素,再通过血液循环调节外周靶性腺性激素的产生和配子发生,从而调节生殖活动[3]。GnRH神经元的分泌受各种内外因素的影响,如Glu能促进GnRH的分泌,γ-氨基丁酸对GnRH分泌有抑制作用,GPR54对GnRH神经元有直接的刺激作用[4-7]。近年来研究发现,星形胶质细胞在调节GnRH神经元的活性和分泌过程中的作用也至关重要[8]。如星形胶质细胞分泌的转化生长因子-β1和前列腺素E2,作用于GnRH神经元并影响其功能,也可借助黏附分子与GnRH神经元结合,通过旁分泌影响GnRH神经元功能,此外,也可通过结构重塑影响GnRH神经元的活性和分泌[9-13]。

图3 免疫组织化学法检测mGluR5及GluR1/2/3/4在GT1-7细胞中的定位和表达Fig 3 The location and expression of mGluR5 and GluR1/2/3/4 in GT1-7 tested by immunofluorescence

A:mGluR5的表达;B:GluR1/2/3/4的表达.图4 Western-blot分析GT1-7细胞胞核中的mGluR5和GluR1/2/3/4的表达Fig 4 The expression of mGluR5 and GluR1/2/3/4 in the nucleus of GT1-7 detected by Western-blot
本研究结果显示,星形胶质细胞与GnRH神经元共培养时,上清中的Glu显著减少,GnRH分泌增多,且GnRH神经元胞内的mGluR5和GluR1/2/3/4被激活,出现从胞质向胞核的移位。Western-blot也证实,二者共培养时,上述GluR在GnRH神经元胞核内的表达增加。GluR分为2类:一类为离子型受体,包括N-甲基-D-天冬氨酸受体、海人藻酸受体和α-氨基-3羟基-5甲基-4异恶唑受体(该受体家族包括4个结构极为相似的亚基GluR1/2/3/4,它们与离子通道偶联,形成受体通道复合物,介导快信号传递);另一类属于代谢型受体(mGluR),通过G-蛋白偶联,调节细胞内产生第二信使,从而导致代谢改变,包括8个亚型(mGluR1~8)。这些受体被激活后产生较缓慢的生理反应。本研究显示,二者共培养10 d时,GnRH神经元内2类GluR均发生定位与表达的变化,说明GluR介导的急慢性效应均参与星形胶质细胞促GnRH分泌的作用。原因可能有2个:(1)星形胶质细胞可能通过活化GnRH神经元胞内mGluR5和GluR1/2/3/4,促进Glu的利用,而适宜浓度的Glu可促进GnRH的分泌,即直接增强Glu的促分泌效应;(2)Glu是中枢神经系统的兴奋性氨基酸,但过高浓度的Glu却有神经毒性,可引起神经元的损伤或死亡[14]。二者共培养时,星形胶质细胞通过摄取一定量的Glu[15-16],本实验中表现为共培养时上清中的Glu水平明显下降,解除了过高浓度的Glu对神经元造成的毒性作用,即恢复了GnRH神经元对Glu作用的敏感性,实现促进GnRH分泌的效应。但是该效应是由何因素(如星形胶质细胞产生的何种细胞因子)促发,且在GnRH神经元细胞内该效应通过下游何信号通路发挥作用,有待进一步深入研究。

A:mGluR5的表达;B:GluR1/2/3/4的表达. 与单纯GT1-7培养组比较,☆:P<0.05.图5 GT1-7细胞胞核中的mGluR5和GluR1/2/3/4的表达变化Fig 5 The histogram of expression of mGluR5 and GluR1/2/3/4 in the nucleus of GT1-7
总之,GnRH神经元与星形胶质细胞共培养,能改变GnRH神经元2类GluR在胞内的定位与表达,且增加GnRH的分泌。该机制可能是通过GnRH神经元GluR的移位等变化,增强兴奋性神经递质Glu对GnRH神经元的促分泌作用,或星形胶质细胞消耗多余Glu后,GnRH神经元的生理功能得到恢复。该研究结果可对星形胶质细胞调控GnRH神经元分泌的理论提供补充,并为GnRH神经元分泌调节提供一种新的调控靶点和方式,进而为生育调节提供一个新的途径和思路。
[1] Yao P S, Kang D Z, Lin R Y,etal. Glutamate/glutamine metabolism coupling between astrocytes and glioma cells: neuroprotection and inhibition of glioma growth[J].BiochemBiophysResCommun, 2014,450(1):295-299.
[2] Terasawa E, Kurian J R, Guerriero K A,etal. Recent discoveries on the control of gonadotrophin-releasing hormone neurones in nonhuman primates[J].JNeuroendocrinol, 2010,7(22):630-638.
[3] Su S, Sun X, Zhou X,etal. Effects of gonadotrophin- releasing hormone immunization on the reproductive axis and thymulin[J].JEndocrinol, 2015,21(4):282-292.
[4] Iremonger K J, Constantin S, Liu X,etal. Glutamate regulation of GnRH neuron excitability[J].BrainResearch, 2010,1364(1):35-43.
[5] Watanabe M, Fukuda A, Nabekura J. The role of GABA in the regulation of GnRH neu-rons[J].FrontNeurosci, 2014,8(1):1-9.
[6] Pineda R, Aguilar E, Pinilla L,etal. Physiological roles of the kisspeptin/GPR54 system in the neuroendocrine control of reproduction[J].ProgBrainRes, 2010,181:55-77.
[7] Hameed S, Jayasena C N, Dhillo W S. Kisspeptin and fertility[J].JEndocrinol, 2011,208(2):97-105.
[8] Ojeda S R, Lomniczi A, Sandau U . Contribution of glial-neuronal interactions to the neuroendocrine control of female puberty[J].EurJNeurosci, 2010,32(12):2003-2010.
[9] Eroglu C. The role of astrocyte-secreted matricellular proteins in central nervous system development and function[J].JCellCommumSignal, 2009,3(3):167-176.
[10] Clasadonte J, Poulain P, Hanchate N K,etal. Prostaglandin E2release from astrocytes triggers gonadotropin-releasing hormone (GnRH) neuron firing via EP2 receptor activation[J].ProcNatlAcadSciUSA, 2011,38(108):16104-16109.
[11] Sandau U S, Mungenast A E, McCarthy J,etal. The synaptic cell adhesion molecule, SynCAM1, mediates astrocyte-to-astrocyte and astrocyte-to-GnRH neuron adhesiveness in the mouse hypothalamus[J].Endocrinology, 2011,6(152):2353-2363.
[12] Sandau U S, Mungenast A E, Alderman Z,etal. SynCAM1, a synaptic adhesion molecule, is expressed in astrocytes and contributes to erbB4 receptor-mediated control of female sexual development[J].Endocrinology, 2011,152(6):2364-2376.
[13] Kumar S, Parkash J, Kataria H,etal. Enzymatic removal of polysialic acid from ne-ural cell adhesion molecule interrupts gonadotropin releasing homone(GnRH) neuron-glial remodeling[J].MolCellEndocrinol, 2012,348(1):95-103.
[14] Castillo C A, León D A, IBallesterosYáez,etal. Glutamate differently modulates meta-botropic glutamate receptors in neuronal and glial cells[J].NeurochemicalResearch, 2010,35(7):1050-1063.
[15] Hanson E, Danbolt N C, Dulla C G. Astrocyte membrane properties are altered in a rat m-odel of developmental cortical malformation but single-cell astrocytic glutamate uptake is robust[J].NeurobiolDis, 2016,89:(1)157-168.
[16] Piao C, Ralay Ranaivo H, Rusie A,etal. Thrombin decreases expression of the glutamat-e transporter GLAST and inhibits glutamate uptake in primary cortical astrocytes via the Rho kinase pathway[J].ExpNeurol, 2015,273(1):288-300.
(编辑:何佳凤)
The Secretion of GnRH Neuron can be Enhanced by the Coculture with AstrocyteinvitroVia the Change in GluR
CHEN Yong
Department of Anatomy and Histology & Embryology, School of Basic Medical Sciences,Fujian Medical University, Fuzhou 350122, China
Objective To explore the effect of coculture GnRH neuron (GT1-7) with astrocyte on the function of GnRH neuron and the mechanism associated with it. Methods GnRH neurons were cocultured with primary astrocyte for 10 days in the Transwell system. The distribution of GluR in GnRH neuron were detected by immunofluorescence. The expression of GluR in GnRH neuron were tested by Western-blot. The concentration of Glu and GnRH were measured through HPLC and ELISA respectively. Results It was observed that transfer of mGluR5 and GluR1/2/3/4 into nucleus form cytoplasm took place in the coculture group. The expression of mGluR5 and GluR1/2/3/4 in the nucleus were increased. The results of Western-blot coincided with the results of IF. The concentration of Glu in supernatant decreased but the secretion of GnRH increased in the coculture group. Conclusion The coculture of GnRH neuron with astrocyte can benefit the secretion of GnRH via the change of GluR. The distribution and expression of GluR in the GnRH neuron can be changed if GnRH neuron were cocultured with astrocyte.
neurons; gonadotropin-releasing hormone; neuroglia; astrocytes; coculture techniques; receptors, glutamate
2017-01-11
福建省自然科学基金面上项目(2014J01123)
福建医科大学 基础医学院人体解剖学与组织胚胎学系,福州 350122
陈 勇,男,副教授,理学博士. Email: fjmucy@163.com
R322.8; R347.512; R977.1
A
1672-4194(2017)02-0097-06

