锌离子在无抽搐电休克联合抗抑郁剂治疗抑郁症中的作用
周衍芳,张 静,曹延筠,卞清涛*
(1.北京回龙观医院,北京 100096;2.山东省济宁市精神病防治院,山东 济宁 272051*通信作者:卞清涛,E-mail:qingtaobian@163.com)
论著·临床
锌离子在无抽搐电休克联合抗抑郁剂治疗抑郁症中的作用
周衍芳1,张 静2,曹延筠1,卞清涛1*
(1.北京回龙观医院,北京 100096;2.山东省济宁市精神病防治院,山东 济宁 272051
*通信作者:卞清涛,E-mail:qingtaobian@163.com)
目的 探讨锌离子(Zn2+)在无抽搐电休克(MECT)联合非选择性五羟色胺再摄取抑制剂(SSRIs)治疗抑郁症中的浓度变化及与抑郁症状缓解的相关性。方法 选取2015年8月-12月在北京回龙观医院住院治疗的符合《精神疾病诊断与统计手册(第4版)》(DSM-4)诊断标准的中、重度抑郁症患者21例(脱落2例),采用重复测量设计实验,对入组患者进行MECT联合SSRIs抗抑郁药物治疗,每位患者在治疗前、治疗3次、治疗6次后进行心率、血压、脉搏、呼吸等一般生命体征评估、汉密尔顿抑郁量表24项版(HAMD-24)评定并抽取外周血5 mL。采用生化法检测Zn2+浓度。结果 ①不同时间点Zn2+浓度的GLM分析结果显示,Zn2+浓度呈上升趋势,但差异无统计学意义(P=0.131)。②MECT治疗3次后Zn2+浓度变化差值与HAMD-24及各因子评分无相关性(P>0.05)。③治疗6次后Zn2+浓度与HAMD-24睡眠障碍因子评分变化差值有相关性(r=-0.529,P=0.020)。④MECT治疗3次后和治疗6次后总有效率分别为89.47%、100%,临床痊愈率分别为42.11%、68.42%。结论 MECT联合SSRIs抗抑郁剂治疗抑郁症可能不是通过离子型受体发挥作用,患者血清Zn2+浓度变化与睡眠改善相关,提示抑郁症患者血清Zn2+浓度的变化可以反映睡眠质量的改善情况。
抑郁症;无抽搐电休克治疗;锌离子
抑郁症(Depressive Disorders)是一种常见的精神障碍,主要表现为心境低落、兴趣减退和/或精力不济。据世界卫生组织(World Health Organization,WHO)统计,全球约有3.5亿人饱受抑郁症的困扰[1]。17个国家的精神卫生中心调查发现,大约每20人中就有1个人患有抑郁症[2],但其发病机制尚未明确。有研究发现啮齿动物缺锌能导致抑郁症并影响其症状,以实验方法让动物缺锌会诱发类似抑郁的症状[3]。最近一项Meta分析表明,抑郁症患者存在病理性血清锌离子(Zn2+)浓度降低,抗抑郁治疗时加入锌可以更迅速地改善抑郁症状[4]。基于生物化学和行为的数据表明Zn2+抗抑郁的机制可能是通过离子型受体如谷氨酸N-甲基-D-天冬氨酸(N-methyl D-aspartate,NMDA)受体的拮抗作用[5]。无抽搐电休克治疗(Modified electroconvulsive therapy,MECT)能快速改善抑郁症状,比药物起效快,治疗抑郁症有效率高达60%~90%[6],其快速起效的机制尚在研究中。本文从离子型受体角度着手,通过比较抑郁症患者接受MECT联合SSRIs抗抑郁剂治疗前后的症状改善、Zn2+浓度变化及其相互关系,探讨MECT快速治疗抑郁症的机制及Zn2+在MECT治疗抑郁症中的作用。
1 对象与方法
1.1 对象
选择2015年8月-12月在北京回龙观医院住院治疗的中重度抑郁症患者。入组标准:①由2名主治及以上职称的医师依据《精神障碍诊断与统计手册(第4版)》(Diagnostic and Statistical Manual of Mental Disorders, fourth edition, DSM-IV)确诊为中、重度抑郁症;②年龄18~60岁,性别不限;③能配合完成汉密尔顿抑郁量表24项版(Hamilton Depression Scale-24 item,HAMD-24)评定;④入组前服用抗抑郁药仅限于五羟色胺再摄取抑制剂(selective serotonin reuptake inhibitors,SSRIs)类;⑤受试者或家属知情,并签署知情同意书。排除标准:①对MECT治疗所用药物过敏者;②脑器质性疾病,如脑占位性病变、颅内压增高、新近颅内出血等;③严重心血管疾病,如难以控制的高血压、冠心病、心肌病、动脉瘤等;④有严重呼吸系统疾病、严重肝肾功能异常者;⑤孕妇;⑥有其他精神疾病者(精神分裂症、分离-转换障碍等)。符合入组标准且不符合排除标准共21例。本研究获得北京回龙观医院伦理委员会批准。
1.2 实验方法
1.2.1 实验设计
本实验采用重复测量设计方法,重复测量不同时间点Zn2+浓度,探讨Zn2+与HAMD-24总评分及各因子评分的关系。
1.2.2 干预方法
对入组患者进行MECT和SSRIs抗抑郁药联合治疗,观察疗程为2周。MECT每周3次,隔天1次,每次进行MECT治疗前评估患者心率血压、脉搏、呼吸等生命体征(多参数监护仪,深圳迈瑞生物医疗电子股份有限公司生产),以保证治疗的安全性。
1.2.3 生化指标检测方法
于患者首次MECT治疗前、治疗3次后和6次后的当天,由MECT室护士抽取患者空腹外周静脉血5 mL,置于EDTA抗凝真空采血管中,每份样本在收集后的6小时内进行血浆分离。采用TD6M型低速台式离心机(湖南凯达科学仪器有限公司生产)离心半径8 cm,3 500 r/min离心10 min,并完成分装,置于-20℃低温冷冻储存箱保存备用。采用生化法(锌离子生化检测试剂盒,批号20160201,日本日立公司产全自动生化分析仪,型号7180)检测Zn2+浓度。
1.2.4 评估方法
由2名经过一致性培训的主治以上职称临床医生对入组患者进行相关量表评定。实验前收集患者一般人口学资料和疾病情况,包括年龄、性别、民族、婚姻状况、受教育程度、工作情况、利手评价、生命体征评估、抑郁症病程、躯体疾病(包括冠心病、高血压、糖尿病、免疫性疾病、脑器质性疾病等)、是否伴精神病性症状等。于首次MECT治疗前、治疗第3次和第6次(治疗后24小时)分别进行HAMD-24[7]评定。HAMD-24包括7个因子:焦虑躯体化因子、体重因子、日夜变化因子、迟缓因子、睡眠障碍因子、认识障碍因子和绝望感因子。按照Davis JM的划分,HAMD-24总评分>35分,可能为严重抑郁;20分<总评分≤35分,可能是轻度或中度抑郁;8分<总评分≤20分,可能有抑郁症;总评分≤8分,没有抑郁症状。以HAMD-24评分减分率评定临床疗效。减分率≥75%为显效,50%≤减分率<75%为有效,25%≤减分率<50%为起效,减分率<25%为无效。其中显效、有效、起效人数之和为总有效人数,用于评定总有效率。以HAMD-24评分≤8分评定临床痊愈。
1.3 统计方法

2 结 果
2.1 基线期一般资料
研究期间共脱落2例,其中1例因家属要求出院,1例查出肺结核需要院外治疗。共19例完成研究,其中男性4例,女性15例;均为汉族;已婚12例,未婚4例,离异3例;受教育年限8年及以下6例,8年以上者13例;均为右利手。
2.2 Zn2+浓度的一般线性模型(GLM)分析
MECT治疗前和治疗第3次、第6次后患者血清Zn2+浓度分别为70.9032 umol/L、71.5774 umol/L、75.0684 umol/L,对Zn2+浓度采用一般线性模型重复测量设计资料的方差分析,Mauchly球形检验统计量P=0.886>0.05,接受球形假设。组内比较显示,不同治疗时点的Zn2+浓度变化差异无统计学意义(P=0.131>0.05)。见表1。不同治疗时点Zn2+浓度变化趋势见图1。

表1 Zn2+浓度的GLM分析
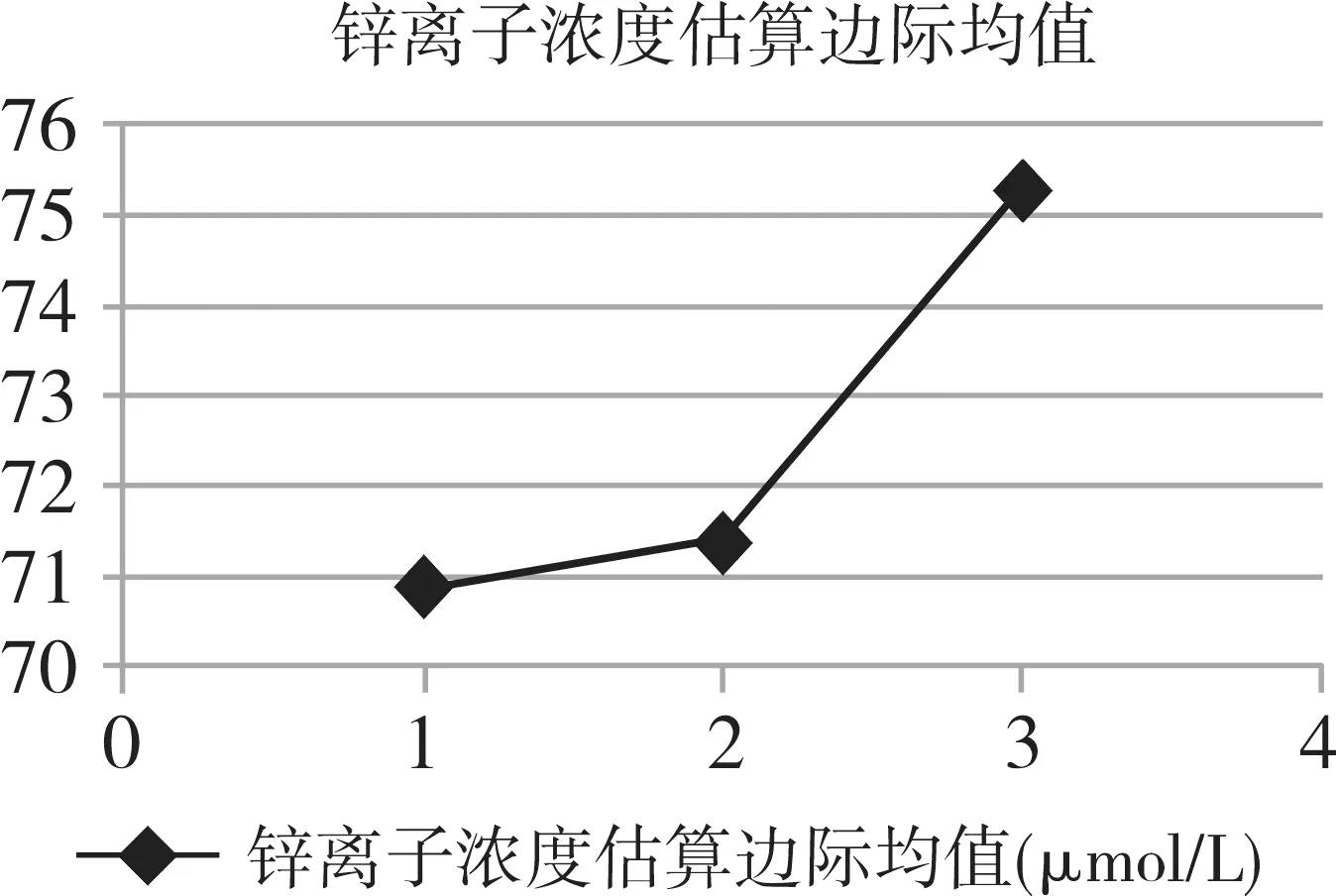
图1 Zn2+浓度不同时间点趋势变化图
2.3 相关分析
患者年龄、基线期HAMD-24总评分、焦虑/躯体化因子、认知障碍因子评分均为正态分布,见表2。采用Pearson相关分析方法,Zn2+与年龄(r=0.076,P=0.758)、HAMD-24总评分(r=-0.013,P=0.957)、焦虑/躯体化(r=0.262,P=0.278)、认知障碍(r=-0.174,P=0.477)评分均无相关性。
患者性别、受教育年限、基线期体重因子、日夜变化因子、迟缓因子、睡眠障碍因子、绝望感因子评分均为非正态分布,见表2,采用Spearman相关分析,Zn2+与性别(r=0.189,P=0.439)、受教育年限(r=-0.041,P=0.868)、体重(r=-0.228,P=0.349)、日夜变化(r=-0.094,P=0.703)、迟缓(r=0.309,P=0.198)、睡眠障碍(r=-0.222,P=0.362)、绝望感(r=-0.080,P=0.745)均无相关性。
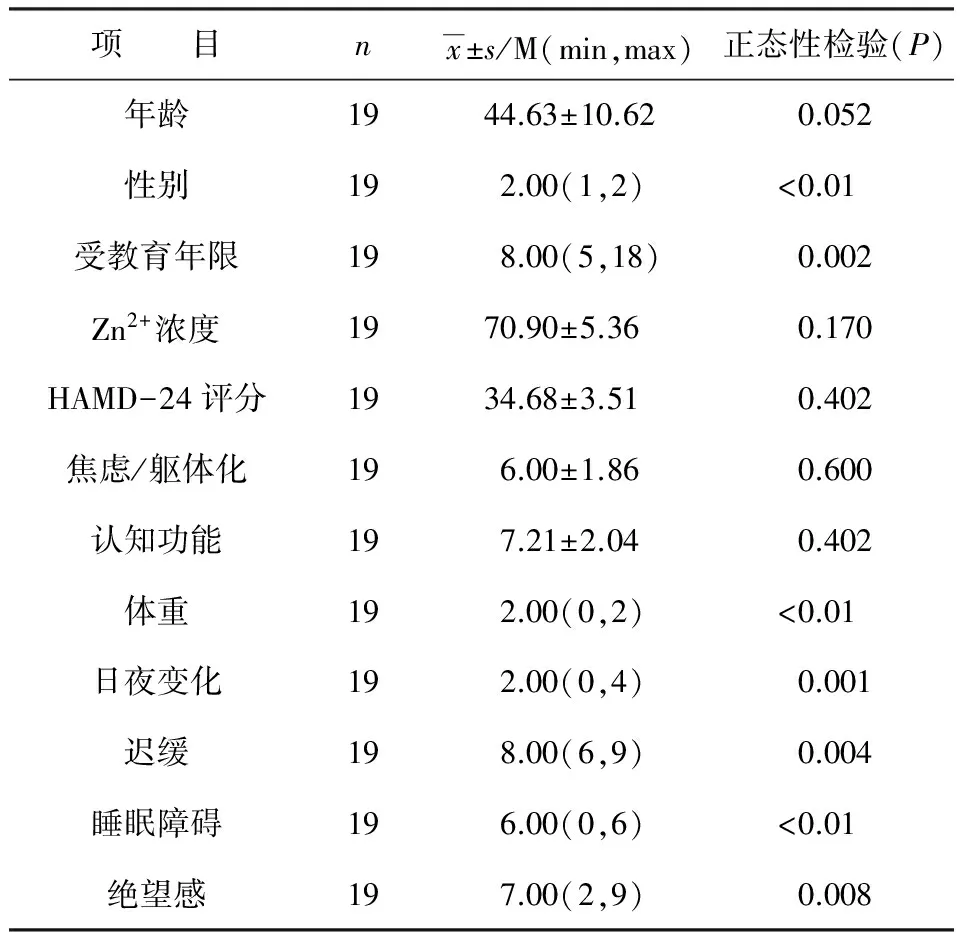
表2 正态性检验
注:HAMD-24,汉密尔顿抑郁量表24项版
2.4 治疗后Zn2+变化差值及与HAMD-24各因子评分变化差值相关分析
对治疗3次和6次后患者的Zn2+浓度进行Shapiro-Wilk(n=19)正态性检验,结果显示治疗3次后Zn2+(Δ2-1)及6次后Zn2+(Δ3-1)均为非正态分布(P<0.05),见表3。故其与其他各项变化差值的相关性采用Spearman相关分析方法,结果显示:①治疗3次后Zn2+浓度变化差值(Δ2-1)与HAMD-24总评分及其各因子评分变化差值均无相关性(P均>0.05)。②治疗6次后Zn2+浓度变化差值(Δ3-1)与HAMD-24中睡眠障碍因子评分差值呈负相关(r=-0.529,P=0.02),与其他因子评分及HAMD-24总评分均无相关性。见表4。
2.5 MECT治疗后疗效比较
MECT治疗3次后和治疗6次后总有效率分别为89.47%、100%,临床痊愈率分别为42.11%、68.42%。见表5。

表3 治疗3次及6次后Zn2+变化差值正态性检验(n=19)
注:Δ2-1,MECT治疗3次后Zn2+浓度变化差值;Δ3-1,MECT治疗6次后Zn2+浓度变化差值
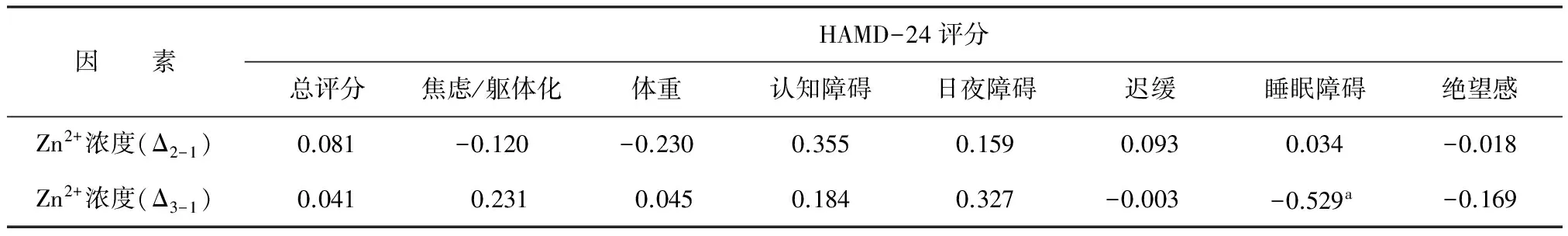
表4 MECT治疗3次及6次后各差值相关性分析(r)
注:HAMD-24,汉密尔顿抑郁量表24项版;aP<0.05;Δ2-1,MECT治疗3次后Zn2+浓度变化差值;Δ3-1,MECT治疗6次后Zn2+浓度变化差值
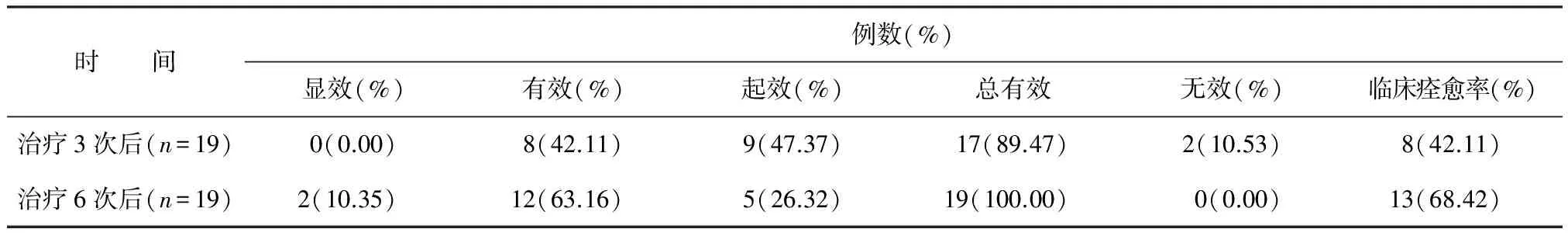
表5 MECT治疗后疗效比较
3 讨 论
本研究结果显示MECT联合SSRIs抗抑郁剂能快速缓解抑郁症状,SSRIs常规治疗基础上增加MECT治疗2周(每周3次,隔天一次),在治疗3次和6次后,总有效率分别为89.47%、100%,临床缓解率分别为42.11%、68.42%,这和国内外认为MECT能快速改善抑郁症状的研究结果一致[8-10]。
有研究认为MECT快速治疗抑郁症的机制与其改变了中枢谷氨酸NMDA受体信号传导有关,重复的电休克刺激能减少NMDA受体相关信号转导基因的表达,下调NMDA受体数量,从而达到抗抑郁的作用[11]。NMDA受体是谷氨酸受体的一种离子型受体复合物,含有一些特殊的结合位点用以信号传导,NMDA受体主要含有NR1和NR2亚基,其中NR2A亚基在成年人中枢神经系统分布广泛,其N端含有Zn2+的高亲和结合位点[12-13],海马、前额叶皮质、杏仁核和嗅球等脑区的Zn2+能神经元兴奋时能释放其中的谷氨酸和Zn2+,参与情绪调节[14-17]。动物实验表明[18],小鼠低锌饮食能增强早期杏仁核ZIF268基因的表达,这种改变在服用SSRIs后能变得正常。Swardfager等[4]的Meta分析表明,抑郁症患者存在病理性Zn2+浓度低下。初步临床实验认为,抗抑郁治疗时加入锌可以更迅速或更有效地改善抑郁症状[19]。以上证据表明缺锌可能参与抑郁症的发病基础。基于生物化学和行为的数据表明Zn2+抗抑郁的可能机制是通过离子型受体如谷氨酸NMDA受体的拮抗作用[5]。锌对NMDA受体的抑制依赖于NMDA受体亚基的结合,对NR2A亚基有比NR2B亚基更高的亲和性[20],Zn2+在MECT治疗抑郁症中的作用可能是Zn2+本身可以结合NMDA受体的某些作用位点,从而拮抗NMDA受体的活性,以达到抗抑郁的效果。但本研究结果显示,经过6次MECT治疗后患者血清Zn2+浓度呈上升趋势,但与基线期比较差异无统计学意义(P=0.131),且Zn2+浓度与HAMD-24总评分及各因子评分均无明显相关性,故Zn2+在MECT治疗抑郁症中可能不是通过离子型受体发挥作用。该结果也可能与本研究纳入病例数较少、患者服用药物及饮食有关,导致实验结果不能很好地解释抑郁患者血清Zn2+浓度与症状之间的关系。
本研究结果显示,经过MECT治疗6次后Zn2+浓度变化与睡眠障碍因子评分存在相关性,提示MECT治疗抑郁症时睡眠质量的改善与Zn2+浓度变化相关。有研究报道,膳食锌和血清Zn2+的浓度与睡眠时间及睡眠质量关系密切[21],正常成年人锌摄入减少、血清Zn2+降低与睡眠时间减少呈正相关[22]。锌是人体重要的微量元素,在中枢神经系统Zn2+对NMDA受体有抑制作用,参与介导情绪、认知、感知疼痛及睡眠[15,23],Zn2+在MECT治疗抑郁症中改善睡眠的机制可能是大脑在MECT作用下局部发生了神经生物化学变化,Zn2+可能与离子型受体如NMDA受体复合体结合,导致NMDA受体的配体结合位点发生改变,使其产生了适应性的改变, 这些改变可能降低了NMDA受体的功能活性,从而改善睡眠质量。
本研究存在一定的局限性。首先,本研究样本量较小,结果显示Zn2+浓度变化与抑郁症状改善没有显著性差异可能与统计功效有关。其次,未考虑药物治疗对患者症状改善的影响。最后,由于医学伦理,本研究未能收集正常对照组进行MECT干预。今后的研究将扩大样本量,将神经生化和MECT相结合,系统探讨Zn2+在MECT治疗抑郁症中的变化及其与睡眠的关系。
[1] 季建林. 中国抑郁障碍防治指南修订与抑郁障碍的规范治疗[J]. 中华行为医学与脑科学杂志, 2015, 24(4): 292-293.
[2] Andrews G, Cuijpers P, Craske MG, et al. Computer therapy for the anxiety and depressive disorders is effective, acceptable and practical health care: a meta-analysis[J]. PLoS One, 2010, 5(10): e13196.
[4] Swardfager W, Herrmann N, Mazereeuw G, et al. Zinc in depression: a meta-analysis[J]. Biol Psychiatry, 2013, 74(12): 872-878.
[5] Rosa AO, Lin J, Calixto JB, et al. Involvement of NMDA receptors and L-arginine-nitric oxide pathway in the antidepressant-like effects of zinc in mice[J]. Behav Brain Res, 2003, 144(1-2): 87-93.
[6] Pagnin D, de Queiroz V, Pini S, et al. Efficacy of ECT in depression: a meta-analytic review[J]. J ECT, 2004, 20(1): 13-20.
[7] Hamilton M. A rating scale for depression[J]. J Neurol Neurosurg Psychiatry, 1960, 23: 56-62.
[8] Jin XL, Xu WQ, Le YJ, et al. Long-term effectiveness of Modified Electroconvulsive Therapy compared with repetitive Transcranial Magnetic Stimulation for the treatment of recurrent major depressive disorder[J]. J Nerv Ment Dis, 2016, 204(6): 479-482.
[9] 刘文娟. 无抽搐电休克治疗抑郁症的疗效观察[J]. 临床合理用药杂志, 2016, 9(3A): 18-19.
[10] Lin CH, Chen MC, Yang WC, et al. Early improvement predicts outcome of major depressive patients treated with electroconvulsive therapy[J]. Eur Neuropsychopharmacol, 2016, 26(2): 225-233.
[11] Park HG, Yu HS, Park S, et al. Repeated treatment with electroconvulsive seizures induces HDAC2 expression and down-regulation of NMDA receptor-related genes through histone deacetylation in the rat frontal cortex[J]. Int J Neuropsychopharmacol, 2014, 17(9): 1487-1500.
[12] Niciu MJ, Ionescu DF, Richards EM, et al. Glutamate and its receptors in the pathophysiology and treatment of major depressive disorder[J]. J Neural Transm (Vienna), 2014, 121(8): 907-924.
[13] Nozaki C, Vergnano AM, Filliol D, et al. Zinc alleviates pain through high-affinity binding to the NMDA receptor NR2A subunit[J]. Nat Neurosci, 2011, 14(8): 1017-1022.
[14] Frederickson CJ. Neurobiology of zinc and zinc-containing neurons[J]. Int Rev Neurobiol, 1989, 31: 145-238.
[15] Frederickson CJ, Suh SW, Silva D, et al. Importance of zinc in the central nervous system: the zinc-containing neuron[J]. J Nutr, 2000, 130(5S Suppl): 1471S-1483S.
[16] Paoletti P, Vergnano AM, Barbour B, et al. Zinc at glutamatergic synapses[J]. Neuroscience, 2009, 158(1): 126-136.
[17] Colvin RA, Fontaine CP, Laskowski M, et al. Zn2+transporters and Zn2+homeostasis in neurons[J]. Eur J Pharmacol, 2003, 479(1-3): 171-185.
[18] Whittle N, Lubec G, Singewald N. Zinc deficiency induces enhanced depression-like behaviour and altered limbic activation reversed by antidepressant treatment in mice[J]. Amino Acids, 2009, 36(1): 147-158.
[19] Gold PW. The organization of the stress system and its dysregulation in depressive illness[J]. Mol Psychiatry, 2015, 20(1): 32-47.
[20] Swardfager W, Herrmann N, McIntyre RS, et al. Potential roles of zinc in the pathophysiology and treatment of major depressive disorder[J]. Neurosci Biobehav Rev, 2013, 37(5): 911-929.
[21] Ji X, Liu J. Associations between blood zinc concentrations and sleep quality in childhood: acohort study[J]. Nutrients, 2015,13(7): 5684-5696.
[22] Grandner MA, Jackson N, Gerstner JR, et al. Dietary nutrients associated with short and long sleep duration. Data from a nationally representative sample[J]. Appetite,2013, 64: 71-80.
[23] Campbell IG, Gustafson LM, Feinberg I. The competitive NMDA receptor antagonist CPPene stimulates NREM sleep and eating in rats[J]. Neuropsychopharmacology, 2002, 26(3): 348-357.
(本文编辑:陈 霞)
Effects of zinc ion on treatment of depression with modified electroconvulsive therapy
ZhouYanfang1,ZhangJing2,CaoYanjun1,BianQingtao1*
(1.BeijingHuilongguanHospital,Beijing100096,China;2.TheMentalHospitalofJi'ning,Ji'ning272051,China*Correspondingauthor:BianQingtao,E-mail:qingtaobian@163.com)
Objective To investigate the concentration change of zinc ion(Zn2+) in patients treated with modified electroconvulsive therapy (MECT) combined with non-selective serotonin reuptake inhibitors (SSRIs) and the correlation with remission of depressive symptoms. Methods 21 patients with moderate to severe depression who met the Diagnostic and Statistical Manual of Mental Disorders, fourth edition(DSM-IV) in Beijing Huilongguan Hospital,were recruited from August to December 2015 (with 2 cases drop out). MECT combined with SSRIs antidepressant drugs were used for the treatment of depression, each patient was conducted general assessment of vital signs, Hamilton Depression Scale-24 item (HAMD-24) and extracted of venous blood 5 mL before treatment, the 3rdand 6thtimes after treatment.The Zn2+concentration was measured by biochemical method.Results ①The level of Zn2+concentration was gradually increasing at different treatment points but there was no significant difference in GLM analysis(P=0.131). ②There was no correlation between the change of Zn2+concentration with the score of HAMD-24 (P>0.05) after three times of MECT treatment.③The change of Zn2+was related to sleep disturbance factor after six times of MECT treatment (r=-0.529,P=0.020). ④The total effective rate was 89.47% and the clinical cure rate was 42.11% after three times of MECT treatment while the total effective rate was 100% and the clinical cure rate was 68.42% after six times of MECT treatment.Conclusion MECT combined with SSRIs antidepressant drugs treatment may not contribute to the treatment of depression by ionic receptor. The change of serum Zn2+concentration in patients is related to sleep improvement, which suggested that the change of serum Zn2+concentration in patients with depression could reflect the improvement of sleep.
Depressive disorder; Modified electroconvulsive therapy; Zinc ion
R947.4
A
10.11886/j.issn.1007-3256.2017.01.011
2016-12-02)

