滇橄榄树不同组织原花色素质量浓度及抗氧化性能研究
张伦,杨申明,徐成东,王飞,胡小安*
(1.楚雄师范学院化学与生命科学学院,云南楚雄675000;2.南京林业大学化学工程学院,南京210037)
滇橄榄树不同组织原花色素质量浓度及抗氧化性能研究
张伦1,杨申明1,徐成东1,王飞2,胡小安1*
(1.楚雄师范学院化学与生命科学学院,云南楚雄675000;2.南京林业大学化学工程学院,南京210037)
原花色素是最有效的自由基清除剂之一,具有非常强的清除自由基和抗氧化的能力。以云南地区滇橄榄树为原料,采用超声波提取法,对其树皮、树芯、树枝、树叶的原花色素质量浓度进行了研究,并对树枝原花色素的提取条件进行优化。其次,对树皮原花色素抗氧化能力及与维生素C(vitamin C, VC)的抗氧化协同作用进行了比较。结果表明:树枝的原花色素质量浓度最高,其次是树皮、树叶、芯材。同时,树枝中原花色素提取的最佳条件为:以质量分数为60%的乙醇为提取剂,料液比1∶7,提取温度60℃,提取时间30 min,在此条件下原花色素的提取率能达到3.85%。滇橄榄树皮提取物具有很强的抗氧化性,清除DPPH自由基的能力最佳,原花色素质量浓度为10 μg/mL时,自由基清除率高达88.55%,且抗氧化有效成分主要集中在乙酸乙酯层,水层仍然含有部分抗氧化成分。原花色素和VC以质量比为3∶1,1∶1,1∶3进行复配后的自由基最高清除率分别为88.84%,91.27%,91.05%,协同作用强弱顺序为1∶1>1∶3>3∶1。
滇橄榄;不同组织;原花色素;抗氧化性
滇橄榄(PhyllanthusemblicaLinn.)又名云南余甘子,是大戟科落叶灌木的果实,主要生长在热带和亚热带地区[1]。云南省是全国野生滇橄榄分布最广、产量最高的省份之一[2]。在工业生产中,滇橄榄树皮仅作为生产上等的栲胶原料,而树皮含有多种药食和保健的有机活性物质[3-4],如果胶、胡萝卜素、核黄素、生物碱、有机酸和单宁等[5]。滇橄榄的根、叶、树皮皆可入药[1],若只作为工业栲胶原料开发利用价值很低而且单一,造成很大的资源浪费。原花色素(proanthocyanidins)是植物体内形成的,普遍存在于植物的根、茎、叶、花、果实中,它能在热酸处理下生成花色素的物质,是一种很好的氧自由基清除剂和脂质过氧化抑制剂。原花色素具有清除自由基抗氧化的功能[6-7],这是由于原花色素分子结构单元芳香环有多个邻、间位活性酚羟基,易于释放H·给各类自由基,并终止自由基链式反应,从而防止氧化,起到预防衰老、治疗和预防心血管疾病及美白防晒等方面的作用[8-9]。
目前,国内外提取原花色素方法有多种,如用脱氧去离子、有机溶剂、超临界流体、微波[10]等方法。超声提取技术是近年对植物有效成分提取分离中的一种提取手段,因提取时间短、效率高而广泛应用[11]。本研究以橄榄树皮为材料,采用超声波辅助乙醇回流浸提法进行滇橄榄树不同部位原花色素的提取。通过单因素和正交试验筛选出最佳因素,通过方差与极差分析得到原花色素的最佳提取工艺条件,对比滇橄榄树皮不同部位原花色素质量浓度,以期为原花色素的下一步开发利用提供依据,同时对云南地区滇橄榄资源和促进山区经济发展具有重要的意义。
1 材料与方法
1.1 材料与仪器
在大理南涧随机选取4~5年生植株,采摘时间为8月,采摘量各为5 kg的橄榄树皮、树干、树枝、叶。原料在50~60℃的恒温箱中烘干,粉碎,过筛(0.25~0.60 mm),备用;无水乙醇、浓硫酸、香草醛、DPPH溶液、维生素C(vitamin C, VC)均为分析纯。
实验所用仪器有电子分析天平、DFY-500摇摆式高速中药粉碎机、KB5200型超声波清洗器(超声功率200 W,频率40 kHz)、HH-S2恒温水浴锅、SHZ-A循环水式真空泵、Alpha-1502紫外可见分光光度计(上海谱元仪器有限公司制造)。
1.2 原花色素提取与纯化
树皮、树干、树枝分别剥离自然晾干,在50~60℃的恒温箱中烘干粉碎过0.25 mm筛得粉末,在60℃下,以60%乙醇提取(超声波辅助提取)30 min,然后进行抽滤,滤液烘干至质量恒定(50℃)并称质量(分析天平),取样按标准曲线配成溶液测吸光度。
将粗提物用5%乙醇配成溶液,用3倍体积的乙酸乙酯萃取→将酯层和水层过AB-8大孔吸附树脂→用不同质量分数乙醇(20%,30%,40%,50%及无水乙醇)洗脱→洗脱液蒸干成粉末→测定抗氧化性。
1.3 原花色素质量浓度及抗氧化性的测定
原花色素测定:以香草醛-硫酸法[12]测定原花色素的质量浓度。空白为1 mL甲醇+5 mL 3%香草醛-甲醇溶液+5 mL硫酸-甲醇溶液;样品为1 mL样品甲醇溶液+5 mL 3%香草醛-甲醇溶液+5 mL硫酸-甲醇溶液,避光反应30 min,测定500 nm处吸收值。根据标准曲线,计算原花色素的质量浓度。
根据质量浓度分别计算出滇橄榄树皮中原花色素的提取率。原花色素提取率公式:
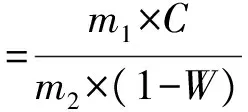
式中:m1为提取物总质量,mg;m2为树皮质量,mg;C为提取物中原花色素质量浓度,mg/mL;W为树皮含水率,%。
原花色素抗氧化性测定:清除二苯基苦基肼自由基(DPPH·, 2,2-diphenyl-1-picryl-hydrazyl)法[13]。
2 结果与分析
2.1 吸光度标准曲线
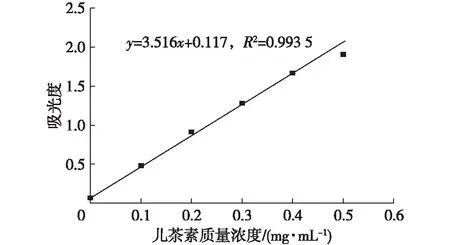
图1 儿茶素质量浓度与吸光度关系的标准曲线Fig. 1 Standard curve of absorbance vsconcentration of catechin
以儿茶素为标样,配置1 mg/mL的儿茶素/甲醇标准溶液;配成不同浓度;准确配置3%的香草醛-甲醇溶液与30%的硫酸-甲醇溶液;在反应体系0.5 mL标样+2.5 mL 3%香草醛+2.5 mL 30%硫酸;温度为30℃下避光反应30 min,后测其在500 nm处的紫外吸收值,空白样为0.5 mL的甲醇。根据方法所绘出的标准曲线见图1。
根据儿茶素/甲醇标样测出吸光度后做出的标准曲线表达式是y=3.516x+0.117,R2=0.993 5。测出原花色素样液的吸光度后,可根据标准曲线方程及提取率公式计算出原花色素的提取率,最后根据提取率确定最佳提取条件。
2.2 滇橄榄树不同部位原花色素质量浓度的差异
滇橄榄树不同部位原花色素含量见图2。
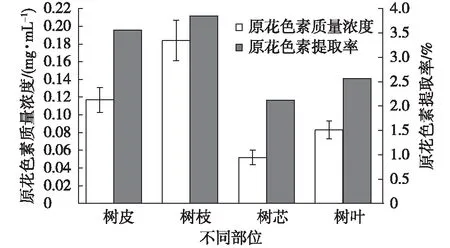
图2 滇橄榄树不同部位原花色素质量浓度及提取率Fig. 2 Content and extraction yield of proanthocyanidins at different parts from Phyllanthus emblica
由图2可知,滇橄榄树不同部位原花色素质量浓度顺序:树枝>树皮>树叶>树干。原花色素提取率顺序也同样为:树枝>树皮>树叶>树芯。原花色素的分布及聚合度依植物种类和组织部位而异,在许多植物的非种子组织中是以可溶而无色的混合物存在,而木本植物中的原花色素主要存在于树皮及枝叶中[14]。本研究中的树枝为无法再分离出树芯的小树枝,因此,滇橄榄树原花色素主要集中在树皮中,且树枝部位的树皮原花色素质量浓度要高于树芯位置的树皮。
2.3 不同提取条件对原花色素提取率的影响
研究了乙醇浓度、提取时间、提取温度、料液比等对原花色素提取率的影响。以0.25 mm树枝原料,料液比为1∶10,在70℃下超声波辅助提取30 min,研究了不同浓度乙醇对原花色素提取率的影响;以0.25 mm树枝原料,乙醇质量分数为60%,料液比为1∶6,提取温度为60℃,研究了不同提取时间对原花色素提取率的影响;以0.25 mm树枝原料,乙醇质量分数为60%,料液比为1∶6,超声波辅助提取30 min,研究了不同提取温度对原花色素提取率的影响;以0.25 mm树枝原料,以质量分数为60%的乙醇为提取剂,提取温度为40℃,超声波辅助提取时间为30 min,研究了不同料液比对原花色素提取率的影响,结果见图3。
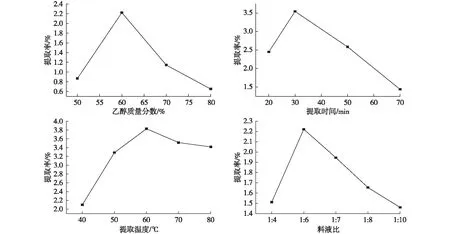
图3 不同因素对滇橄榄树枝原花色素提取率的影响Fig. 3 Effects of different factors on the extraction yield of proanthocyanidins from Phyllanthus emblica branch
由图3可以看出,乙醇质量分数对树枝中原花色素有直接影响。在料液比、提取温度、提取时间、粒度目数一定的前提下,原花色素的提取率随乙醇质量分数的增大呈现先增大后减小的趋势,当乙醇质量分数为60%时,原花色素的提取率最大,提取率为2.220%。随着乙醇质量分数的进一步提高,提取率逐步减少。这是由于随着乙醇质量分数的增加,一些醇溶性的杂质、亲脂性强的成分溶出量增加,这些成分与原花色素竞争同乙醇-水分子结合从而导致提取率下降,所以选择60%为最佳乙醇质量分数。对于提取时间,提取30 min时原花色素的提取率最大,并随着提取时间的增加,提取率逐渐减少。这是由于提取时间过长,原花色素在溶液中长时间受热可使酚结构被破坏。因此选择30 min为最佳提取时间,其提取率为3.545%。对于提取温度,温度的增加能使分子运动速率加快,渗透、扩散、溶解速率加快,但是过高的温度会导致原花色素的结构被氧化破坏。滇橄榄树枝原花色素的提取率随提取温度的影响先增大后减小,温度为60℃时,原花色素的提取率最高,到达3.828%。料液比对提取率也有很大影响,溶剂量增加提取率增加,但过多的溶剂会造成浪费,其次醇溶性杂质增加而影响提取率。本研究树枝中原花色素的提取率随料液比的影响先增大后减小。当料液比为1∶6时,原花色素的提取率最高,达到2.221%。与黑荆树皮、毛杨梅树皮、马尾松树皮等其他木本植物相比,滇橄榄树各部位中的原花色素较少。
2.4 原花色素提取工艺条件的优化
在单因素试验的基础上,以原花色素提取率为指标,采用L9(34)正交试验方法对原花色素提取工艺条件进一步优化。正交试验因素水平见表1。

表1 因素水平
通过正交试验方差分析可看出(表2),提取温度、乙醇质量分数、料液比3个因素对原花色素提取率的影响为料液比>提取温度>乙醇质量分数,得出最佳工艺条件组合为A2B2C3,即:提取温度为60℃,乙醇浓度为60%,料液比1∶7,提取时间为30 min时提取率最高达到3.85%±0.001%,且同条件下的4个平行样中,不存在显著性差异。

表2 正交试验对滇橄榄树枝原花色素提取率的影响
2.5 初级分离产物抗氧化活性的比较
滇橄榄树皮中提取出的原花色素具有很强的自由基清除能力。近年来人们对数十种植物的二聚体、三聚体、四聚体等低聚和高聚体原花色素进行了研究,发现原花色素有效成分主要集中在单体或低聚物部分[15-16]。而经过乙酸乙酯、树脂等萃取过的原花色素经研究主要含有低聚原花色素[17]。因此本研究将粉碎粒度为0.25 mm的滇橄榄树皮粉末,采用最佳工艺条件提取出的原花色素以乙酸乙酯进行萃取。由于植物有机溶剂粗提物杂质多,需要进一步去除杂质而进行分离与纯化。具体的分离与纯化方法随着植物有效成分的不同而不同。本研究将经过乙酸乙酯萃取得到的原花色素采用AB-8大孔吸附树脂进行分离。探讨未上柱前的原花色素乙酸乙酯层、乙酸乙酯层萃取后进行上柱,被树脂吸附后的流出液、VC以及乙酸乙酯萃取时的水层进行抗氧化比较分析,结果见图4。
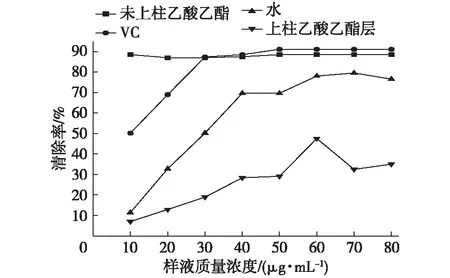
图4 原花色素不同分离产物的DPPH清除率Fig. 4 DPPH scavenging rates of proanthocyanidins with different extraction agents
从图4中可以看出,水层中的原花色素质量浓度达到70 μg/mL时都不如酯层10 μg/mL时抗氧化效果好。说明滇橄榄树皮提取物中抗氧化有效成分主集中在酯层,水层仍然含有部分原花色素。这是由于酯层中主要为原花色素低聚物,而水层中主要为高聚物[18]。其次,上样后流出液清除DPPH自由基的能力显著降低,说明质量浓度(或清除作用)较小,其抗氧化效果甚至不如水层,有效成分已经被树脂吸附。再次,当原花色素质量浓度为10 μg/mL时,未上柱的乙酸乙酯层就已经与VC质量浓度为50 μg/mL时的效果相当,说明滇橄榄树皮中原花色素具有很强清除DPPH自由基的能力。但是随着原花色素质量浓度的增加其清除效果却未继续增加,说明原花色素质量浓度与清除效果并不成线性关系。未上柱的乙酸乙酯层原花色素清除DPPH自由基能力的质量浓度为10 μg/mL,清除率已达到最大为88.55%。对滇橄榄树皮提取物初级分离产物的抗氧化活性比较,为后续有效成分的分离提纯提供参考。
2.6 不同浓度乙醇洗脱(乙酸乙酯层)产物与未上柱酯层抗氧化活性的比较
由于不同浓度乙醇洗脱产物具有不同的原花色素结构。为了确定抗氧化活性最强的原花色素洗脱产物,将原花色素乙酸乙酯层样品过AB-8大孔吸附树脂柱,然后用一定乙醇浓度进行解吸,分别收集洗脱液并测定其洗脱液中抗氧化性,结果见图5。
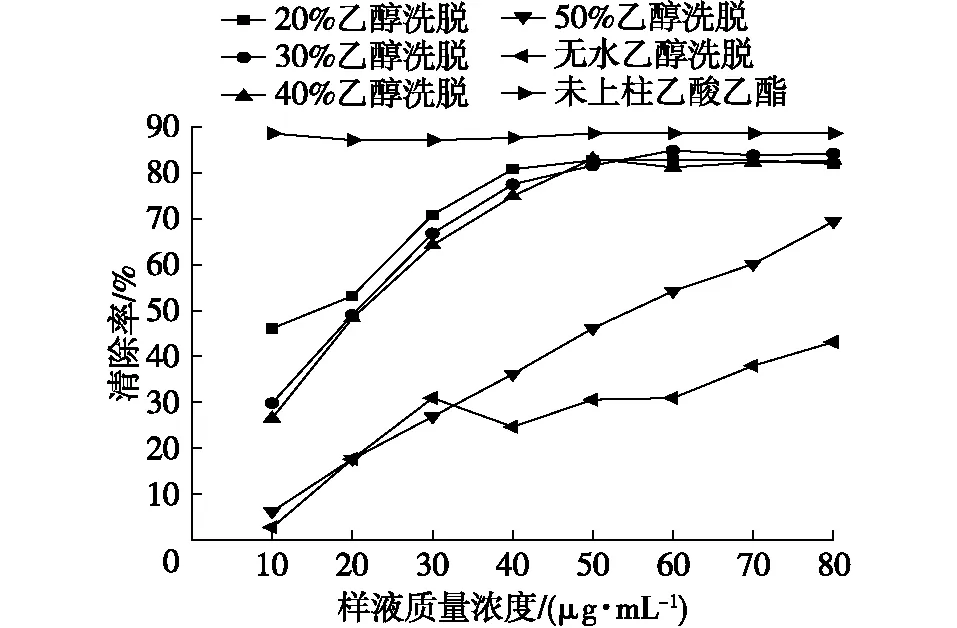
图5 原花色素不同浓度洗脱产物对DPPH的清除率Fig. 5 DPPH scavenging rates of proanthocyanidins eluted with different concentrations
从图5可以看出,用20%,30%,40%,50%及无水乙醇洗脱产物后,抗氧化有效成分主要集中在20%,30%,40%洗脱成分上。50%乙醇洗脱液清除率较低,这是因为不同的乙醇洗脱成分原花色素结构不同,此结果为后续洗脱成分结构的检测与抗氧化性机理研究奠定基础。而经过洗脱后的成分抗氧化性能并不如未洗脱的乙酸乙酯层抗氧化性好。因此推测不同结构的原花色素抗氧化时具有一定协同作用。由于原花色素与VC单独作用的抗氧化效果都很好,所以将未进行洗脱分离的乙酸乙酯层与VC以适量浓度进行复配,比较其抗氧化活性。
2.7 VC与未上柱的乙酸乙酯层原花色素复配下抗氧化活性的比较
将VC与未上柱的乙酸乙酯层原花色素按照一定比例进行复配,考察其复配后的抗氧化效果、复配的剂量以及最佳的复配比例,结果见表3。
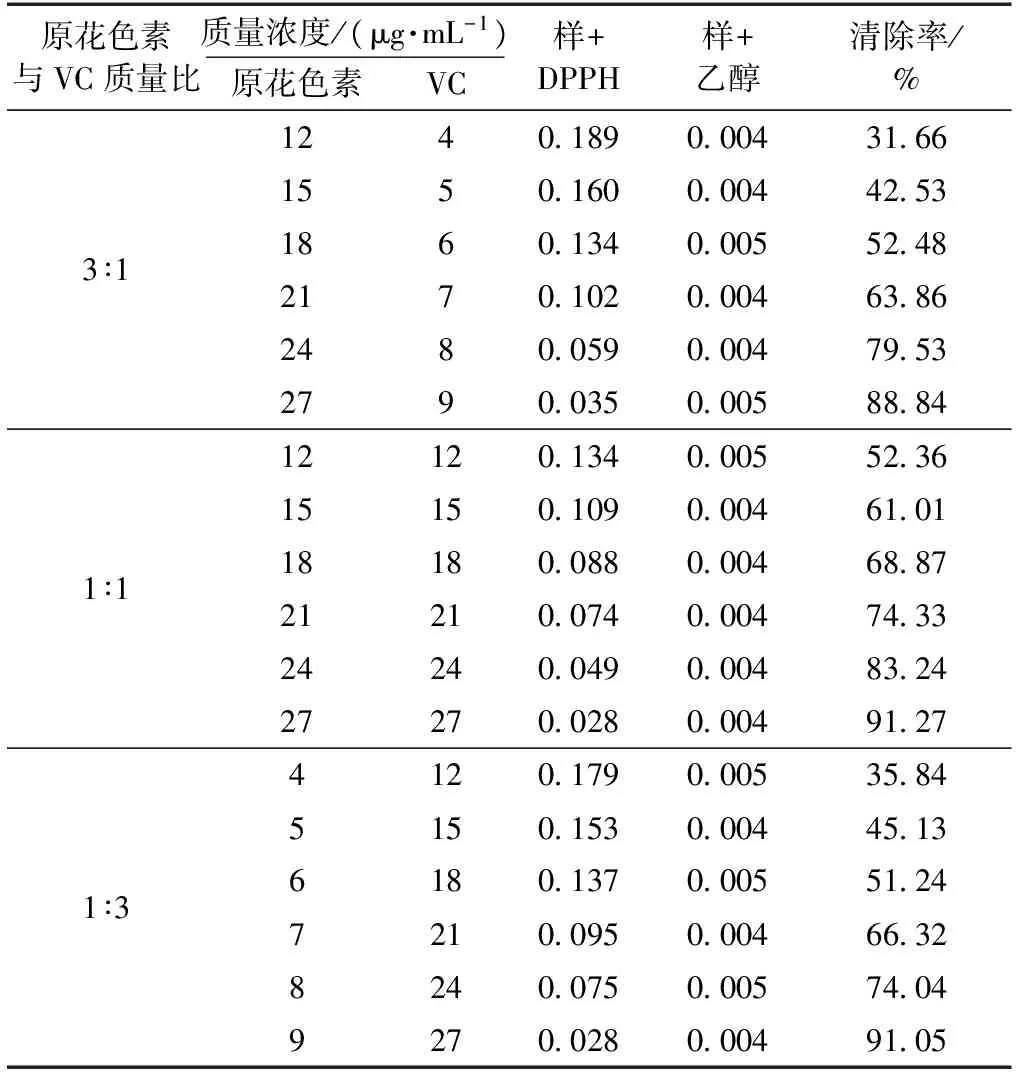
表3 VC与未上柱的乙酸乙酯层原花色素复配下对DPPH的清除率
从表1可以看出,滇橄榄树皮原花色素与VC复配后有协同抗氧化作用,不同比例复配的协同抗氧化效果不同。当在一定剂量的原花色素中按3∶1比例少量加入VC时,清除作用效果不明显,说明VC的添加对原花色素影响不大。而在原花色素与VC按质量比1∶3比例复配时,清除作用效果较3∶1时明显,无原花色素添加时,VC需50 μg/mL才能达到90%以上清除率,而当添加原花色素9 μg/mL后,则VC只需27 μg/mL即可使清除率达到90%以上。当原花色素与VC按质量比1∶1比例复配时,清除效果显著提高。说明滇橄榄树皮原花色素与VC复配后有很好的协同抗氧化效果,尤其1∶1配比的协同作用较好。滇橄榄树皮原花色素与VC复配组中协同作用的强弱顺序为1∶1>1∶3>3∶1。
3 结 论
研究结果表明,滇橄榄树不同部位原花色素质量浓度有所不同,树枝的原花色素质量浓度最高,依次是树枝>树皮>树叶>树芯。另外,不同部位原花色素提取率依次为:树枝>树皮>树叶>树芯。其中滇橄榄树枝原花色素最佳提取条件为:采用超声波提取法,60℃;乙醇质量分数为60%;料液比1∶7,提取时间为30 min时提取率最高达到3.85%。其次经过乙酸乙酯层萃取的原花色素质量浓度为10 μg/mL的清除DPPH能力与VC质量浓度为50 μg/mL时的效果相当,清除率最高为88.55%,说明了滇橄榄树皮提取物具有很强的抗氧化性,且抗氧化有效成分主要集中在乙酸乙酯层,水层仍然含有部分原花色素,酯层抗氧化性要优于水层。将粗提物用AB-8树脂进行分离,流出液进行抗氧化性测定,其抗氧化效果低于水层,说明有效成分已经被树脂吸附,AB-8树脂分离纯化效果较好。用20%,30%,40%,50%及无水乙醇洗脱产物后,抗氧化有效成分主要集中在20%,30%,40%洗脱成分上。而单独洗脱成分的抗氧化性能并不如未洗脱的乙酸乙酯层的好,因此推测不同结构的原花色素抗氧化时具有一定协同作用。将未进行洗脱分离的乙酸乙酯层原花色素与VC以适量浓度进行复配。结果表明滇橄榄树皮原花色素与VC复配后有协同抗氧化作用,不同比例复配的协同抗氧化效果不同,原花色素与VC以1∶1配比的协同作用较好。原花色素和VC以质量比为3∶1,1∶1,1∶3进行复配后对DPPH的最高清除率分别为88.84%,91.27%,91.05%,协同作用强弱顺序为1∶1>1∶3>3∶1。本研究明确了滇橄榄树不同组织原花色素质量浓度,探讨其树皮抗氧化机制,研究不同分离产物,以及与VC之间协同的氧化作用,对滇橄榄树的开发和利用具有重要意义。
[ 1 ]中国科学院中国植物志编辑委员会. 中国植物志[M]. 北京:科学出版社,2004.
[ 2 ]吴睿, 谷勇. 云南野生余甘子单株选优的协方差分析[J]. 林业调查规划, 2002, 27(3):4-8. WU R, GU Y. Covariance analysis of individual selection ofPhyllanthusemblicaof Yunnan[J]. Forest Inventory and Planning, 2002, 27(3):4-8.
[ 3 ]杨顺楷, 杨亚力, 杨维力. 余甘子资源植物的研究与开发进展[J]. 应用与环境生物学报, 2008, 14(6):846-854. YANG S J, YANG Y L, YANG W L. Advances in research and development ofPhyllanthusemblicaL[J]. Chinese Journal of Applied & Environmental Biology, 2008, 14(6):846-854.
[ 4 ]王舒. 药食兼用余甘子研究的新进展[J]. 山东化工, 2015, 44(10):30-31. WANG S. Research advances onPhyllanthusemblicaboth as diet and medicine[J]. Shandong Chemical Industry, 2015, 44(10):30-31.
[ 5 ]李秀丽, 叶峰, 俞腾飞. 余甘子的药理研究进展[J]. 时珍国医国药, 2006, 17(2):266-267. LI X L, YE F, YU T F. Research advancement on pharmacological effects ofPhyllanthusemblica[J]. Lishizhen Medicine and Materia Medica Research, 2006, 17(2):266-267.
[ 6 ]OU K, GU L. Absorption and metabolism of proanthocyanidins[J]. Journal of Functional Foods, 2014, 7:43-53.
[ 7 ]孙达旺.植物单宁化学[M].北京:中国林业出版社, 1992.
[ 8 ]KRUGER M J, DAVIES N, MYBURGH K H, et al. Proanthocyanidins, anthocyanins and cardiovascular diseases[J]. Food Research International, 2014, 59:41-52.
[ 9 ]刘功骏, 周蒙, 叶凤霞, 等. 黑荆树皮原花色素的提取及美白防晒效果试验[J]. 林业工程学报, 2016, 1(3):42-47. LIU G J, ZHOU M, YE F X, et al. Study on the whitening and sunscreen effects of proanthocyanidins fromAcaciamearnsiibark [J]. Journal of Forestry Engineering, 2016,1(3):42-47.
[10]孙皓, 张伟. 葡萄籽中原花色素的微波提取工艺研究[J]. 广州化工, 2012, 40(11):121-123. SUN H, ZHANG W. Microwave-assisted extraction of procyanidin from grape seed [J]. Guangzhou Chemical Industry, 2012, 40(11):121-123.
[11]李田田, 王飞. 超声波辅助提取黑荆树皮原花色素工艺优化[J]. 林产化学与工业, 2012, 32(5):56-62. LI T T, WANG F. Investigation on ultrasonic-assisted extraction of proanthocyanidins from black wattle bark[J]. Chemistry and Industry of Forest Products, 2012, 32(5):56-62.
[12]鲍俊竹, 陈月坤, 徐桂花. 测定葡萄籽提取物中原花青素含量的方法[J]. 农业科学研究, 2005, 26(1):43-45. BAO J Z, CHEN Y K, XU G H. Primary study on the determination methods of proanthocyanidin content of grape seed extract[J]. Journal of Agricultural Sciences, 2005, 26(1):43-45.
[13]赵智捷, 熊嘉, 王飞. 黑荆树皮原花色素的精制、降解及清除DPPH自由基活性的研究[J]. 林产化学与工业, 2013, 33(4):83-88. ZHAO Z J, XIONG J, WANG F. Purification, degradation and scavenging activities on DPPH free radical of proanthocyanidins from black wattle bark[J]. Chemistry and Industry of Forest Products, 2013, 33(4):83-88.
[14]石碧, 杜晓. 植物原花色素研究利用进展与发展趋势[J]. 四川大学学报(工程科学版), 2006, 38(5):16-24. SHI B, DU X. The progress on research and utilization of plant proanthocyanidins[J]. Journal of Sichuan University (Engineering Science Edition), 2006, 38(5):16-24. [15]GESCHER K, HENSEL A, HAFEZI W, et al. Oligomeric proanthocyanidins fromRumexacetosaL. inhibit the attachment of herpes simplex virus type-1[J]. Antiviral Research, 2011, 89(1):9-18.
[16]ZHANG H J, FANG W D, XIAO W F, et al. Protective role of oligomeric proanthocyanidin complex against hazardous nodularin-induced oxidative toxicity inCarassiusauratuslymphocytes[J]. Journal of Hazardous Materials, 2014, 274:247-257.
[17]吕丽爽. 葡萄籽中低聚原花青素提取工艺初探[J]. 食品工业科技, 2002, 23(1):17-19.
[18]张峻, 吉伟之, 陈晓云, 等. 吸附层析法制备低聚原花青素[J]. 天然产物研究与开发, 2002, 14(4):31-33. ZHANG J, JI W Z, CHEN X Y, et al. Preparation of oligomeric proanthocyanidins by adsorption chromatography[J]. Natural Product Research and Development, 2002, 14(4):31-33.
Research on the mass concentration and antioxidation ofproanthocyanidins in different tissues fromPhyllanthusemblicaLinn.
ZHANG Lun1, YANG Shenming1, XU Chengdong1, WANG Fei2, HU Xiaoan1*
(1.CollegeofChemistryandLifeScience,ChuxiongNormalUniversity,Chuxiong675000,Yunnan,China; 2.NanjingForestryUniversity,Nanjing210037,China)
Proanthocyanidins are one of the most effective free radical scavenger, which have strong capability of scavenging free radical and antioxidation. Taking thePhyllanthusemblicaLinn. tree in Yunan Provnice as the raw material, the content of proanthocyanidins in barks, tree cores, branches and leaves were determined by ultrasonic extraction technology. In the same time, the extraction conditions were optimized. In additon, antioxidant activities and VC(vitamin C) synergistic effect of proanthocyanidins fromPh.emblicaLinn. barks were compared. The results showed that the content of proanthocyanidins is the highest in the branch; followed by the barks, the leaves, and the tree core. The optimum extraction conditions of proanthocyanidins from the branch were as follows: with 60% ethanol as the extracting agent, solid-liquid ratio of 1∶7, temperature of 60℃ and time for 30 min. Under this best condition, the extraction rate could reach 3.85%. The extraction has strong antioxidant activity fromPh.emblicabarks. Scavenging DPPH ability of free radical was the best when proanthocyanidin concentration was 10 μg/mL, the highest scavenging rate was 88.55%. Antioxidant active ingredients were mainly concentrated in the ethyl acetate layer and the aqueous layer also contains part of the antioxidants. The scavenging rates were 88.84%, 91.27% and 91.05%,respectively, when the complex concentrations of proanthocyanidins and VC was 3∶1, 1∶1 and 1∶3, respectively, and the effects of synergy showed the result of 1∶1>1∶3>3∶1.
PhyllanthusemblicaLinn.; different tissues; proanthocyanidins; antioxidation
2016-08-20
2017-01-19
云南省应用基础研究青年项目(2014FD052);楚雄师范学院学术骨干资助项目(13XJGG03)。
张伦,女,讲师,研究方向为天然产物化学。通信作者:胡小安,男,副教授。E-mail:huxiaoan@cxtc.edu.cn
TQ041
A
2096-1359(2017)04-0057-06

