猪流行性腹泻病毒N基因重组真核质粒构建及其表达
李好磊,李叶珍,赵 顾,崔腾飞,徐前明,魏建忠,李 郁,孙 裴
(安徽农业大学 动物科技学院,安徽 合肥 230036)
猪流行性腹泻病毒N基因重组真核质粒构建及其表达
李好磊,李叶珍,赵 顾,崔腾飞,徐前明,魏建忠,李 郁,孙 裴*
(安徽农业大学 动物科技学院,安徽 合肥 230036)
为探明猪流行性腹泻病毒(porcine epidemic diarrhea virus, PEDV)N基因编码的蛋白对PEDV感染早期诊断的作用,根据PEDV CV777株N基因全序列设计一对特异性引物以扩增N基因,定向插入到pPM-C-His真核表达载体中构建重组表达质粒pPM-C-His-N,将重组质粒肌肉注射昆明系小鼠,以检测其在小鼠体内的表达水平;将pPM-C-His-N转染至Vero细胞,分别在基因水平和蛋白水平对N基因的表达进行检测,并采用间接免疫荧光试验(indirect immunofluorescence assay, IFA)检测N蛋白在细胞中的表达分布情况。结果表明,重组质粒在基因水平和蛋白水平均成功表达,免疫小鼠血清中抗体的效价为1∶51 200,Western-blot结果显示,免疫血清能与重组N蛋白发生特异性反应,说明实验成功构建了重组真核表达质粒pPM-C-His-N,且在Vero细胞内检测到了绿色荧光,为PEDV诊断方法的建立及致病机制的研究奠定基础。
PEDV;N蛋白;真核质粒;表达质粒
猪流行性腹泻(porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)引起的一种急性、热性、高度接触性肠道传染病,以引起猪的呕吐、腹泻、脱水等为主要临床症状,哺乳仔猪、断奶仔猪和育肥猪感染发病率100%,成年母猪约为15%,哺乳仔猪受害最严重,病死率平均50%[1-2]。该病于1971年首次在英国发现,20世纪80年代初在我国陆续发生,目前PED已成为全世界流行的疾病,给世界养猪业造成巨大损失[3-5]。PEDV属单股正链RNA病毒,包括4种结构蛋白,分别是S蛋白(纤突糖蛋白即糖激化纤突蛋白,spike protein)、M蛋白(膜糖蛋白即糖激化囊膜,membrane protein)、E蛋白(小膜蛋白,envelope protein)、N蛋白(核衣壳蛋白,nucleocapsid protein)。S蛋白在病毒感染机体后,可介导产生中和抗体;M蛋白和E蛋白在病毒粒子的组装和出芽过程中起到重要作用,其中M蛋白能介导机体产生α干扰素,可作为PEDV基因工程苗的候选基因;N蛋白在PEDV结构蛋白中所占比例最大,猪在感染病毒早期,体内就能产生抗N蛋白的高水平抗体,由于猪群感染PEDV之后血清中产生的抗N蛋白抗体没有抗S蛋白抗体持久[6],因此可将N蛋白作为检测病毒早期感染的标志蛋白;同时由于冠状病毒N蛋白基因保守型强,不易发生变异[7],所以利用N蛋白建立PEDV分子生物诊断技术具有良好的发展前景。
本研究利用在国内较为常见的PEDV CV777株的N基因全序列设计一对特异性引物,构建真核重组质粒pPM-C-His-N,转染Vero细胞,利用间接免疫荧光试验检测其在细胞中的表达;然后将重组质粒进行动物体免疫试验,采集血清用间接ELISA法评估其效价,并用Western-blot检验其反应原性,以期为PEDV特异性早期诊断技术的建立及后续利用N蛋白研究致病机制提供数据支持与理论基础。
1 材料与方法
1.1 材料
1.1.1 细胞和质粒
Vero细胞与PEDV阳性病料由安徽农业大学动物传染病实验室保存;真核表达载体pPM-C-His由ABM公司合成。
1.1.2 主要试剂与实验动物
DMEM高糖培养基、四季青胎牛血清为Sigma公司产品;限制性核酸内切酶(NheⅠ、XhoⅠ)和T4DNA连接酶购自Invitrogen(上海)贸易有限公司;RNA提取试剂盒、反转录酶均购自天根生化科技(北京)有限公司;无内毒素质粒大提试剂盒、TransIntro EL Transfection Reagent转染试剂购自全式金生物科技(北京)有限公司;山羊抗鼠FITC-IgG以及山羊抗鼠HRP-IgG酶标二抗购自博士德(武汉)生物工程有限公司;雌性昆明系小鼠购自安徽医科大学实验动物中心。
1.2 方法
1.2.1 PEDV N基因的扩增
取PEDV阳性猪包含肠内容物的部分小肠加入少量研磨液充分研磨,-20 ℃反复冻融之后离心取上清,按照RNA提取试剂盒说明书步骤提取RNA,然后立即进行反转录,反转录之后的cDNA保存在-20 ℃,作为PCR扩增的模板。
利用软件对PEDV N基因序列全长(Accession No. DQ355221.1)进行分析,设计一对含NheI、XhoI酶切位点的特异性引物,上游5’-CTAGCTAGCATGGCTTCTGTCAGCTTTCAGG-3’(NheⅠ);下游5’-CCGCTCGAGCCTGTATCGAAGATCTCGTTG-3’(XhoⅠ),目的片段大小为1 326 bp,以25 μL反应体系进行PCR扩增。反应条件:94 ℃预变性5 min;94 ℃变性30 s、50.3 ℃退火30 s、72 ℃延伸45 s,30个循环;72 ℃延伸10 min。1.0%琼脂糖凝胶电泳检测PCR产物。
1.2.2 重组真核表达质粒pPM-C-His-N的构建
N基因PCR产物经DNA回收试剂盒回收纯化后,用NheⅠ和XhoⅠ双酶切,并与经相同内切酶酶切的pPM-C-His载体连接,获得重组pPM-C-His-N质粒,转化至感受态大肠埃希菌 DH5α,转化液涂布于含30 μg·mL-1卡那霉素(Kanamycin)的LB固体板,37 ℃培养过夜,选取卡那霉素阳性的克隆进行菌落 PCR,选取阳性克隆过夜摇菌,抽提重组质粒,分别对重组质粒进行双酶切鉴定和测序鉴定。
1.2.3 重组真核质粒在昆明系小鼠体内的表达
将构建好的重组真核质粒pPM-C-His-N在含Kana的LB液体培养基中大量扩增,按无内毒素质粒大提试剂盒说明书大量提取真核质粒,用核酸蛋白测定仪测定质粒的纯度与浓度,以100 μg每只肌肉注射体重相当的雌性昆明系小鼠[8]。
将45只雌性小鼠平均分成3组,每组15只,分别设置空载体pPM-C-His组、重组质粒pPM-C-His-N组、生理盐水对照组,每只小鼠肌肉注射0.5 mL,在初次免疫前使用眼球采血法采集阴性血清。一免后14 d采用同样方法制备待检血清,分别在一免过后14、21 d各加强免疫一次,采集血清,-20 ℃保存,分别测定各组三次免疫血清中的抗体效价。
1.2.4 抗体效价测定
采用间接ELISA法测定免疫血清中抗体效价。实验中设置重组N蛋白(rN)包被浓度为30 μg·mL-1、待检免疫血清从1∶25倍比稀释至1∶25×220、HRP标记的羊抗鼠IgG(二抗)的稀释度为1∶2 500,邻苯二胺(OPD)底物液避光显色后,测定D492nm值,以待检血清孔的D492nm值/阴性血清孔的D492nm值≥2.1判为阳性。
1.2.5 真核表达质粒在Vero细胞内的表达
RNA水平的检测:按TransIntro EL Transfection Reagent转染试剂说明书铺板,然后进行转染操作,同时设置阴性对照和空白对照。转染24 h之后利用细胞总RNA提取试剂盒说明书提取细胞总RNA,核酸蛋白测定仪测定总RNA的浓度与纯度,然后立即进行反转录合成cDNA,以cDNA为模板,PCR扩增目的基因,反应条件同1.2.2节检测重组质粒在基因水平的表达。
蛋白质水平的检测:按RNA水平检测中所述方法进行细胞转染,分别于转染后24、48、60 h收集细胞,按细胞中总蛋白提取试剂盒说明书分别提取各时间点细胞总蛋白,SDS-PAGE检测重组N蛋白在细胞内的表达情况。
1.2.6 间接免疫荧光(IFA)试验
用PBS将已转染48 h的单层Vero细胞洗2次,同时设置未转染的正常Vero细胞作为空白对照,-20 ℃预冷的甲醇室温固定10 min,PBS洗3次,每次5 min,吸干;加入倍比稀释的鼠抗PEDV抗体,以覆盖培养孔表面为宜,放入湿盒中37℃作用60 min,洗涤同上;再加入按1∶32、1∶48、1∶64倍稀释的FITC标记的羊抗鼠IgG,每孔30 μL,37 ℃作用60 min,洗涤同上;荧光倒置显微镜下观察,空白对照无荧光,而实验组出现绿色荧光者为阳性。
1.2.7 重组N蛋白的Western blot分析
重组N蛋白经12%的 SDS-PAGE分离后,转至聚偏二氟乙烯膜(PVDF),用5%脱脂奶粉4 ℃封闭过夜,PBST洗膜3次,加入1∶100稀释的纯化后的鼠抗N蛋白抗体,室温孵育1 h,PBST洗膜5次,每次10 min;加入1∶3 000稀释的HRP羊抗鼠IgG,室温孵育1 h,洗涤同上,用二氨基联苯胺(DAB)显色,分析重组N蛋白的反应原性。
2 结果与分析
2.1 PEDV-N基因片段的PCR扩增
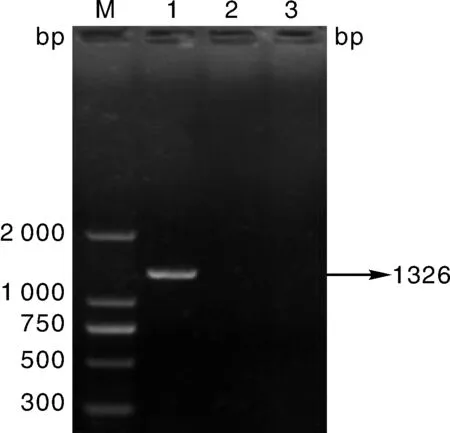
琼脂糖凝胶电泳结果显示在1 326 bp处有一条带,与预期片段大小相符,如图1所示。
2.2 重组真核质粒pPM-C-His-N的双酶切与测序鉴定

M, DL2000 DNA Marker; 1, 阴性对照; 2, PEDV N基因M, DL2000 DNA Marker; 1, Negative control; 2, N gene of PEDV图1 PEDV-N基因RT-PCR扩增结果Fig.1 PEDV-N gene amplified by RT-PCR
利用NheⅠ和XhoⅠ内切酶对重组质粒进行双酶切之后,1.0%琼脂糖凝胶电泳验证,环形的载体被切成线型,出现1 326 bp大小的目的条带,说明酶切成功,通过测序验证序列符合率100%,证明重组质粒构建成功,酶切结果如图2所示。
2.3 重组真核质粒在Vero细胞中的表达与检测
利用RT-PCR检测重组质粒在基因水平的表达结果如图3所示,实验组在1 326 bp处出现目的条带,而空载体组和阴性对照组均未出现目的条带,说明重组质粒在基因水平成功表达。转染后24、48及60 h时,SDS-PAGE结果显示在50 ku左右处均出现了目的蛋白条带,而空载体未出现,表明重组蛋白水平获得成功表达,如图4所示。
2.4 IFA试验结果
经过试验确定山羊抗鼠FITC-IgG在1∶48稀释时效果最佳,实验组细胞出现绿色荧光,而空载体组和阴性对照组细胞未出现绿色荧光,证明重组质粒在细胞中成功表达,如图5所示。
2.5 重组N蛋白抗体效价测定与Western blot分析
如表1所示,一免后14 d可从小鼠免疫血清中检测出抗体,随着免疫次数的增加,抗体水平不断提高,28 d时效价高达1∶51 200,说明该重组质粒有良好的免疫原性。Western-blot分析结果显示,重组N蛋白与鼠抗N蛋白抗体发生了特异性结合反应,在约50 ku处出现一条特异性条带,而作为对照的His标签蛋白不能与鼠抗N蛋白抗体发生结合反应(图6),说明重组N蛋白具有良好的反应原性。
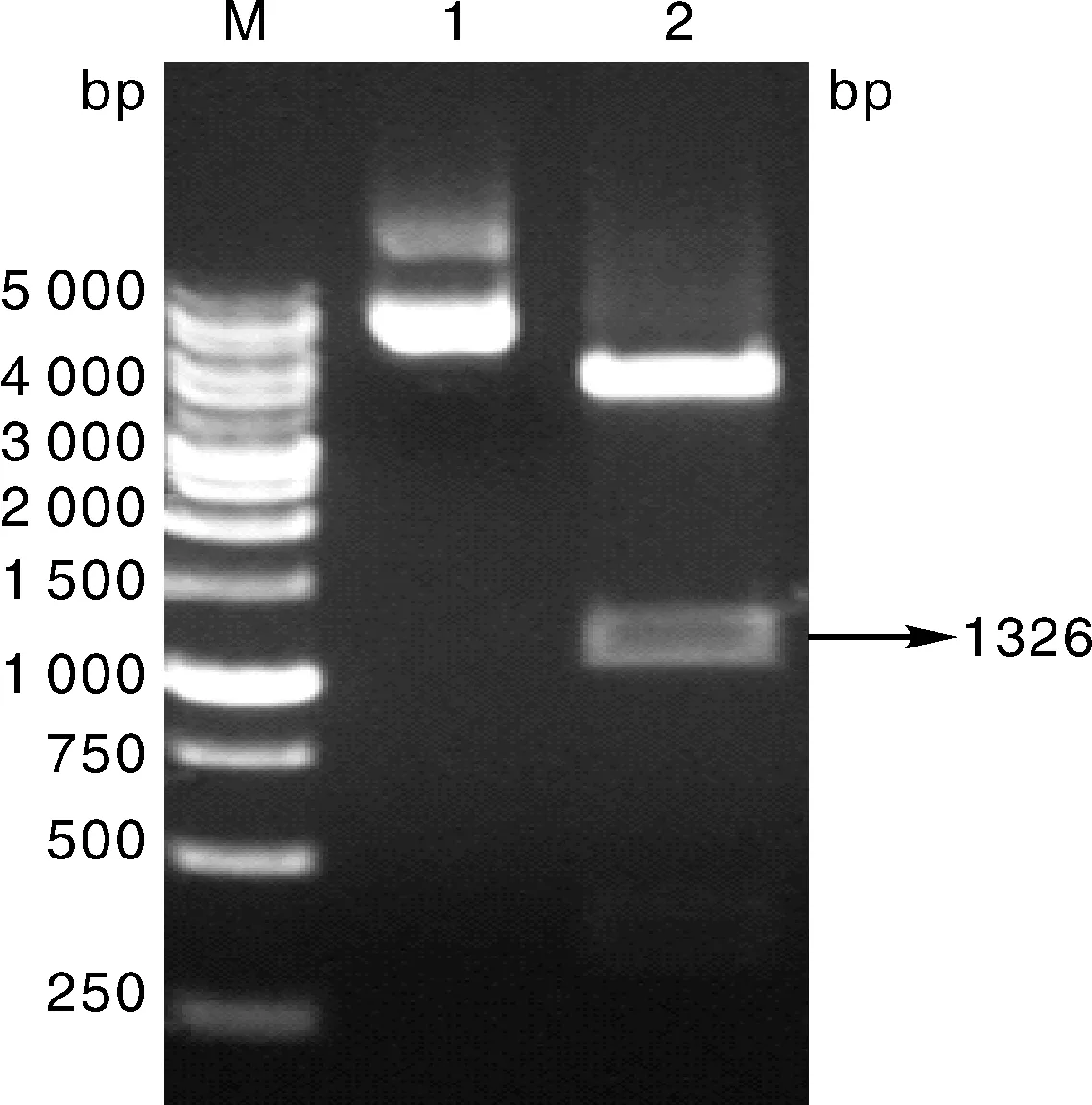
M, DL5000 DNA Marker; 1, pPM-C-His空载体; 2, pPM-C-His-N重组真核质粒M, DL5000 DNA Marker; 1, pPM-C-His empty vector; 2, pPM-C-His-N recombinant eukaryotic plasmids图2 重组真核质粒pPM-C-His-N双酶切结果Fig.2 Result of restriction enzyme of recombinant eukaryotic plasmids of pPM-C-His-N
M, DL2000 DNA Marker;1, 重组质粒转染Vero细胞组;2, 空载体转染Vero细胞组;3, 阴性对照组M, DL2000 DNA Marker; 1, Recombinant plasmid transfection Vero cell group;2, Empty vector transfection Vero cell group; 3, Negative control图3 重组真核质粒在Vero细胞中的基因表达结果Fig.3 Results of recombinant eukaryotic plasmid gene expression in Vero cells

M, 预染蛋白Marker;1, 24 h蛋白表达量;2, 48 h蛋白表达量;3, 60 h蛋白表达量;4, pPM-C-His空载体M, Pre dyed protein Marker; 1, 24 h protein expression; 2, 48 h protein expression; 3, 60 h protein expression; 4, pPM-C-His empty vector图4 不同时间重组N蛋白的表达Fig.4 Expression of recombinant N protein in different times

A, 转染重组质粒pPM-C-His-N的Vero细胞;B, 转染空载体pPM-C-His的Vero细胞; C, 阴性对照A1, Vero cells of transfection recombinant plasmid; B, Vero cells of transfection empty vector; C, Negative control图5 IFA检测重组N蛋白在Vero细胞中的表达(400×)Fig.5 IFA detecting recombinant N protein expression in Vero cell(400×)
表1 重组质粒免疫小鼠不同时间后血清中特异性抗体效价
Table 1 The specific antibody titer in mouse serum detected by ELISA after immunization

组别Group免疫后不同时间小鼠血清抗体效价Theantibodytiterafterimmunizationdifferenttimeinmouseserum一免后第14天14daysafterfirstimmunization二免后第7天7daysaftersecondimmunization三免后第7天7daysafterthirdimmunization重组质粒组Recombinantplasmidgroup1∶8001∶64001∶51200空质粒组Emptyplasmidgroup———生理盐水组Physiologicalsalinegroup———

M, 预染蛋白Marker;1, rN纯化蛋白;2, His标签蛋白M, Dye molecular weight protein standard; 1, rN purified protein; 2, His-tag protein图6 重组N蛋白的Western blot分析Fig.6 Recombinant N protein of Western blot analysis
3 讨论
猪流行性腹泻病毒(PEDV)属于套式病毒目冠状病毒科冠状病毒属,其基因组是具有感染性且不分节段的单股正链RNA,全长约28 kb,CV777为中国主要感染株型[9]。PEDV主要编码四种结构蛋白,对PEDV全基因序列分析发现其中的N基因编码的蛋白是由441个氨基酸组成的磷酸化核衣壳蛋白,是主要结构蛋白之一,在PEDV中所占比例最大,和病毒基因组RNA缠绕形成病毒核衣壳[10-12],N蛋白基因含有6~7个潜在磷酸化的位点,在低渗、pH 9.0的非离子溶剂中,溶解度最大,这种特性对于病毒增殖、感染宿主具有重要作用[13-14],主要体现在:1)能和病毒多聚酶以及细胞因子作用,改变宿主细胞的转录,还能和磷脂与细胞膜作用,促使病毒RNA的复制与病毒组装,从而促进病毒增殖;2)能参与细胞通信,并干扰宿主细胞周期,抑制干扰素产生,促进细胞凋亡。刘随新等[15]通过对N基因在细胞内定位规律的研究推测PEDV主要定植在细胞核仁中与细胞相互作用从而影响细胞周期,使机体持续感染;张博等[16]构建部分N基因的原核表达质粒,并在此基础上建立了间接ELISA用于检测PEDV病原,但由于是部分N基因片段,因此方法并不是很灵敏。刘苏君等[17]利用PEDV N基因原核表达的融合蛋白GST-N 为免疫原免疫BALB/c小鼠,通过杂交瘤细胞筛选,获得了3株稳定性好、特异性强的 Mab,为建立诊断方法提供物质材料。鉴于冠状病毒N蛋白基因保守性极强,且能引起机体的早期免疫,因此可作为PEDV感染早期诊断的目标蛋白。
N基因真核质粒构建的报道较少,而原核表达较多,同时由于真核表达较原核表达简单,在免疫动物时直接使用质粒肌肉注射制得抗体,省去了蛋白表达与纯化的过程,且在免疫动物时不必使用免疫佐剂,减少了佐剂对动物体的应激与伤害,提高了免疫效率[18-19]。本试验通过成功构建的真核表达质粒获得了抗原与抗体,试验证明得到的抗原抗体能够发生特异性反应;该真核载体为ABM公司改良载体,含有强CMV启动子,可以高效表达目的基因,且可以通过制得的抗原或者抗体对PEDV免疫抗体水平或者病原进行检测,为PEDV的诊断与防治以及致病机制的研究提供新思路。
[1] GE F F,YANG D Q,JU H B,et al. Epidemiological survey of porcine epidemic diarrhea virus in swine farms in Shanghai,China[J].ArchivesofVirology,2013,158 (11):2227-2231.
[2] 常铁城,陈建飞,冯力,等. 2014年部分地区猪流行性腹泻病毒流行病学调查[J]. 中国预防兽医学报,2016,38(4):335-338. CHANG T C,CHEN J F,FENG L,et al. Epidemiological survey of porcine epidemic diarrhea virus in 2014[J].ChineseJournalofPreventiveVeterinaryMedicine,2016,38(4):335-338. (in Chinese with English abstract)
[3] 张志,程小娜,樊雅婷,等. 猪流行性腹泻病毒流行毒株的致病性研究[J]. 黑龙江畜牧兽医,2016,289 (3):170-172. ZHANG Z,CHENG X N,FAN Y T,et al. The study of pathogenic of porcine epidemic diarrhea virus epidemic strain[J].HeilongjiangAnimalScienceandVeterinaryMedicine,2016,289 (3):170-172. (in Chinese with English abstract)
[4] MAURICE B P,PAOLO M. Porcine epidemic diarrhea: A retrospect from Europe and matters of debate[J].VirusResearch,2016, 226(3):1-6.
[5] LI R F,TIAN X Q,LIU Y,et al. Isolation and genetic analysis of a variant porcine epidemic diarrhea virus in China[J].PolishJournalofVeterinarySciences,2016,19(1):65-73.
[6] 赖婷婷,陈樨,张如梅. 猪流行性腹泻病毒基因组研究进展[J]. 动物医学进展,2015,36(6):119-121. LAI T T,CHEN X,ZHANG R M. Progress on genome on porcine epidemic diarrhea virus[J].ProgressinVeterinaryMedicine,2015,36(6):119-121. (in Chinese with English abstract)
[7] LI Z L, CHEN F,YUAN Y,et al. Sequence and phylogenetic analysis of nucleocapsid genes of porcine epidemic diarrhea virus (PEDV) strains in China[J].ArchivesofVirology,2013,158 (6):1267-1273.
[8] 邢明,刘晶,王辉,等. 新孢子虫GRA6表达、定位及对小鼠免疫效力的初步分析[J]. 畜牧兽医学报,2015,46(4):624-630. XING M,LIU J,WANG H,et al.NeosporacaninumGRA6 recombinant expression,localization and preliminary analysis on the mice immune effect[J].ActaVeterinariaetZootechnicaSinica,2015,46(4):624-630. (in Chinese with English abstract)
[9] CHEN F Z,KU X G,LI Z H,et al. Genetic characteristics of porcine epidemic diarrhea virus in Chinese mainland, revealing genetic markers of classical and variant virulent parental/attenuated strains[J].Gene,2016,588(1):95-102.
[10] THANIWAN C A,GUN T,THITIMA T,et al. Full-length genome analysis of two genetically distinct variants of porcine epidemic diarrhea virus in Thailand[J].InfectionGenetics&EvolutionJournalofMolecularEpidemiology&EvolutionaryGeneticsinInfectiousDiseases,2016,44(6):114-121.
[11] BAEK P S,CHOI H W,LEE S H,et al. Efficacy of an inactivated genotype 2b porcine epidemic diarrhea virus vaccine in neonatal piglets[J].VeterinaryImmunology&Immunopathology,2016,174(4):45-49.
[12] 顾超逸,孙裴,施雷. 安徽省猪流行性腹泻病毒的ORF3基因序列分析[J]. 西北农林科技大学学报,2015,43(2):1-6. GU C Y,SUN P,SHI L. Sequence analysis ofORF3 gene of porcine epidemic diarrhea virus in Anhui Province[J].JournalofNorthwestA&FUniversity,2015,43(2):1-6. (in Chinese with English abstract)
[13] DIEL D G,LAWSON S,OKDA F,et al. Porcine epidemic diarrhea virus: an overview of current virological and serological diagnostic methods[J].VirusResearch,2016,226(2):60-70.
[14] LIN C M,LINDA J S,DOUGLAS M,et al. Evolution,antigenicity and pathogenicity of global porcine epidemic diarrhea virus strains[J].VirusResearch,2016,226(2):20-39.
[15] 刘随新. 猪流行性腹泻病毒及其N蛋白核仁定位信号对细胞周期的影响[D]. 北京:中国农业科学院,2013. LIU S X. Affection on cell cycle by porcine epidemic diarrhea virus and its nucleoli localization signal peptides of nucleocapsid protein [D]. Beijing: Chinese Academy of Agricultural Sciences,2013. (in Chinese with English abstract)
[16] 张博. PEDV部分N基因的原核表达和间接ELISA方法的建立[D]. 天津:天津农学院,2016. ZHANG B. Prokaryotic expression on the fragment N gene of porcine epidemic diarrhea virus,the development of indirect ELISA [D]. Tianjin: Tianjin Agricultural University,2016. (in Chinese with English abstract)
[17] 刘苏君,段松焕,胡景炎,等. 抗猪流行性腹泻病毒 N 蛋白单克隆抗体的制备与鉴定[J]. 浙江农业学报,2015,27(6):950-954. LIU S J,DUAN S H,HU J Y,et al. Preparation and identification of monoclonal antibodies against the nucleocapsid protein of porcine epidemic diarrhea virus[J].ActaAgriculturaeZhejiangensis,2015,27(6):950-954. (in Chinese with English abstract)
[18] MASIH S,ARORA S K,VASISHTA R K. Efficacy ofLeishmaniadonovaniribosomal P1 gene as DNA vaccine in experimental visceral leishmaniasis[J].ExperimentalParasitology,2011,129(1):55-64.
[19] JASON S,MICHAEL P W,PADMANABHAN M,et al. Applying genomic and bioinformatic resources to human adenovirus genomes for use in vaccine development and for applications in vector development for gene delivery[J].Viruses,2017,15(1):e24-e25.
(责任编辑 张 韵)
Recombinant eukaryotic plasmid construction of porcine epidemic diarrhea virus of N gene and its expression
LI Haolei, LI Yezhen, ZHAO Gu, CUI Tengfei, XU Qianming, WEI Jianzhong, LI Yu, SUN Pei*
(CollegeofAnimalScienceandTechnology,AnhuiAgriculturalUniversity,Hefei230036,China)
In order to investigate the effect of porcine epidemic diarrhea virusNgenes encoding proteins in the PEDV infection early diagnosis, a pair of specific primers was designed to amplify N gene according to the full-length genome sequence of N gene of the PEDV CV777 strain in this experiment, then N gene was cloned into the eukaryotic expression vector pPM-C-His to construct a recombinant plasmid named pPM-C-His-N, the recombinant plasmid was extracted and the intramuscular injection for Kunming mice was carried out to detect the expression level in mice. At the same time, the plasmid was transfected into Vero cells, and PEDV N expression at gene level and protein level was detected, then N protein distribution in cells was detectedinvitroby indirect immunofluorescence assay (IFA). The results showed that the recombinant eukaryotic plasmid expressed successfully at gene level and protein level, the serum antibody titer in immunized mice was 1∶51 200. Western blot results showed that the immune serum can react with recombinant N protein particularity. The study constructed recombinant eukaryotic expression plasmid of pPM-C-His-Nsuccessfully, and detected green fluorescence in Vero cells, which laid the foundation for establishment of diagnostic method of PEDV and research for pathogenic mechanism.
PEDV; N protein; prokaryotic plasmid; expression plasmid
http://www.zjnyxb.cn
10.3969/j.issn.1004-1524.2017.07.07
2017-03-07
安徽省自然科学基金(1708085MC83);现代农业产业技术体系建设专项资金资助项目(CARS-36-生猪);安徽省生猪产业技术体系资金资助项目
李好磊(1990—),男,河南周口人,硕士,主要从事预防兽医学研究。E-mail: 964505723@qq.com
*通信作者,孙裴,E-mail: sunpei1979@126.com
S858.28
A
1004-1524(2017)07-1103-07
浙江农业学报ActaAgriculturaeZhejiangensis, 2017,29(7): 1103-1109
李好磊,李叶珍,赵顾,等. 猪流行性腹泻病毒N基因重组真核质粒构建及其表达[J].浙江农业学报,2017,29(7): 1103-1109.

