百事乐胶囊对慢性应激抑郁大鼠海马磷脂酰肌醇-3激酶信号通路相关因子的影响
孟盼,杜青,张秀丽,柳卓,向韵,刘林,王宇红,
1.湖南省中药粉体与创新药物省部共建国家重点实验室培育基地,湖南 长沙 410208;2.湖南中医药大学第一附属医院,湖南 长沙 410007
论著·实验研究
百事乐胶囊对慢性应激抑郁大鼠海马磷脂酰肌醇-3激酶信号通路相关因子的影响
孟盼1,杜青1,张秀丽1,柳卓1,向韵1,刘林2,王宇红1,2
1.湖南省中药粉体与创新药物省部共建国家重点实验室培育基地,湖南 长沙 410208;2.湖南中医药大学第一附属医院,湖南 长沙 410007
目的 观察百事乐胶囊对慢性轻度不可预见性应激(CUMS)大鼠海马磷脂酰肌醇-3 激酶(PI3K)信号通路关键因子表达的影响,探讨其抗抑郁的作用机制。方法 将 SD 大鼠随机分为空白组、模型组、氟西汀组和百事乐胶囊高、中、低剂量组,每组 10只。采用 CUMS 加孤养的方式建立抑郁模型,造模同时灌胃给药,连续 21 d。采用新奇摄食实验和 Open-field 实验评价行为学变化,ELISA 检测血清单胺神经递质,免疫荧光和 Western blot检测大鼠海马 PI3K、蛋白激酶 B(AKT)、血清糖皮质激素调节蛋白激酶 1(SGK1)表达。结果 与空白组比较,模型组大鼠摄食潜伏期显著延长,水平和垂直活动次数明显减少(P<0.01),血清单胺神经递质含量下降(P<0.01),海马 PI3K、AKT 表达显著降低且 SGK1 表达显著升高(P<0.05,P<0.01);与模型组比较,百事乐胶囊高、中剂量组大鼠摄食潜伏期显著缩短(P<0.05),水平和垂直活动次数显著增加(P<0.01),血清单胺神经递质含量显著升高(P<0.05,P<0.01),海马 PI3K、AKT 显著增加且 SGK1 表达显著降低(P<0.05,P<0.01)。结论 百事乐胶囊可通过缓解模型大鼠抑郁样行为,调控海马 PI3K 信号通路关键因子,发挥其抗抑郁的功效。
百事乐胶囊;抑郁症;海马;磷脂酰肌醇-3 激酶;蛋白激酶 B;血清糖皮质激素调节蛋白激酶 1;单胺神经递质;大鼠
抑郁症是一种以思维迟缓、意志活动减退和认知功能损伤等为主要特征的精神障碍性疾病,具有高患病率、复发率及自杀率,已成为威胁人类身心健康的杀手。抑郁症的发病机制复杂,涉及单胺递质系统功能和下丘脑-垂体-肾上腺轴功能紊乱等多种假说,但目前公认的假说都以海马作为其发病的靶部位。磷脂酰肌醇-3 激酶(phosphatidylinositol 3-kinase,PI3K)信号通路与抑郁症的发生和发展密切相关,其下游信号主要分为依赖于蛋白激酶 B(protein kinase B,AKT)的和非依赖于 AKT 的,可参与调节细胞的生长、发育、分化和存活。百事乐胶囊由贯叶连翘、姜黄、人参组成,是临床经验方。本课题组前期研究发现,其可有效降低海马神经元凋亡[1],促进海马神经再生[2],增加海马神经突触可塑性[3],但具体作用机制还未明了。基于此,本实验以 PI3K 信号通路关键因子为切入点,采用百事乐胶囊对慢性轻度不可预见性应激(CUMS)大鼠进行干预,深入探究其发挥抗抑郁功效的作用机制。
1 实验材料
1.1 动物
SPF 级雄性 SD 大鼠 60 只,鼠龄 8 周,体质量220~250 g,湖南斯莱科景达动物中心,动物许可证号 SCXK(湘)2015-0003。饲养于室温(24±1)℃、湿度(55±10)%环境,明暗交替 12 h/12 h,自由饮水摄食。
1.2 药物
百事乐胶囊,湖南省中医药研究院,批号20150414;氟西汀胶囊,礼来(苏州)制药有限公司,批号 0722A。
1.3 主要试剂与仪器
去甲肾上腺素(NE)、5-羟色胺(5-HT)ELISA试剂盒,R&D 公司;兔抗大鼠 PI3K、AKT、血清糖皮质激素调节蛋白激酶 1(SGK1),英国 Abcam 公司;FITC 荧光二抗,美国 Proteintech 公司;近红外荧光二抗 A lexa Fluor®700,美国 LI-COR Odyssey;即用型 SABC 液、正常山羊血清封闭液、RIPA 裂解液、BCA 蛋白定量试剂盒,北京中杉金桥生物技术有限公司,Protein Marker,美国 MBI Fermentas 公司。生物组织切片机(THERMO SCIENTIFIC),NC 膜(美国M illipore 公司),开野视频跟踪系统(Panlab),万分之一电子天平(日本岛津),超纯水仪(威立雅水务集团),正置荧光显微镜及图像分析系统(Cail Zeiss),近红外双色激光成像系统(美国 LI-COR Odyssey)。
2 实验方法
2.1 分组和给药
所有大鼠适应性饲养 3 d,按体质量随机分为空白组、模型组、氟西汀组(5.4 mg/kg)组和百事乐高、中、低剂量组(2.88、1.44、0.72 g/kg),每组 10 只。造模同时灌胃给药,给药体积 10 m L/kg,空白组和模型组给予等量纯净水。每日 1 次,连续 21 d。
2.2 造模
参照文献[2]方法,采用 CUMS 加孤笼饲养方法复制抑郁模型。空白组每笼饲养5只,不给予任何刺激;其余各组单笼饲养,每日随机给予不同刺激,共21 d,包括禁食 24 h、禁水 24 h、倾笼 45 ℃、夹尾1 m in、4 ℃冰浴 15 min、昼夜颠倒 24 h、噪音 5 min,每日随机安排1种,平均每种刺激使用3次。
2.3 行为学检测
2.3.1 Open-field 实验 第 22 日,各组大鼠进行行为学检测。大鼠从 80 cm×80 cm×40 cm、底面均分为 25 个方格的黑色敞箱的角落放入,适应 1 min 后,拍摄并记录各组大鼠 3 m in 内水平活动次数(四爪皆进入方可记 1次),垂直活动次数(两爪腾空放下记 1次),以水平和垂直活动次数作为评价其抑郁行为的指标。
2.3.2 新奇摄食实验 Open-field 实验结束后,各组大鼠禁食不禁水,第 23日放入微光环境通用隔音试验箱内,箱内中央放入事先称好的饲料,安静环境下使用动物行为采集监控系统观察并记录 6 m in,其中适应 2 min,记录后 4 m in 大鼠进入箱内首次开始接触并摄入饲料的时间(记为摄食潜伏期),以此作为实验动物在陌生环境下情绪变化的行为学评价指标。
2.4 ELISA 检测血清单胺神经递质含量
第 23日大鼠行为学测试结束后,大鼠腹腔注射10%水合氯醛(4 m L/kg)麻醉,腹主动脉取血,促凝管收集,3000 r/m in 离心 10 m in,血清放入 1.5 m L 离心管,-80 ℃保存,严格按照试剂盒说明书进行检测。
2.5 样本采集
行为学测试结束后,各组大鼠禁食不禁水 24 h,腹腔注射 10%水合氯醛(3 m L/kg)麻醉,仰位固定于手术台上,腹腔取血。每组取5只大鼠,快速剖开胸部使心脏暴露,用灌注穿刺针沿着心脏的纵轴方向经心尖部插入左心室至主动脉根部,立即快速灌入约4 ℃生理盐水 250 m L,待流出的液体澄清后慢速灌注 4%多聚甲醛溶液(4 ℃)至动物四肢僵硬后取出脑组织标本,固定于 4%多聚甲醛 24 h,75%、95%、100%梯度乙醇脱水,浸蜡,包埋,切片,备用。每组再取5只大鼠,采血后直接取全脑后分离双侧海马,液氮速冻,-80 ℃冰箱保存。
2.6 免疫荧光检测
切片常规脱蜡、冲洗,滴加封闭液,37 ℃孵育30 min,去除多余液体;分别加入 PI3K、AKT、SGK1的一抗(1∶1000 稀释),37 ℃温育 30 m in,4 ℃过夜。0.01 mol/L PBST 漂洗 5 m in×3 次;加 FITC 荧光标记的二抗,37 ℃湿盒避光孵育 30 m in。0.01 mol/L PBST 避光漂洗 5 min×3 次;甘油缓冲液封片,采用ZEISS 图像分析软件计算各组大鼠 PI3K、AKT、SGK1免疫阳性细胞数。
2.7 Western blot 检测
在冻存海马中加入组织裂解液,电动匀浆,离心,取上清液。BCA 试剂盒测定蛋白浓度。配制 15%浓缩胶与 10%分离胶,上样,电泳(浓缩胶 60 V、40 min,分离胶 80 V、90 min)至溴酚兰到达凝胶底部即可。采用半干式转膜法将凝胶中的蛋白分子转移到NC膜上,封闭 1 h,用 TBST 洗涤后加入相应的一抗,4 ℃孵育过夜。TBST 洗涤 3 次后加入近红外荧光二抗(1∶1000),孵育 0.5 h。采用近红外双色激光成像系统扫描,并进行数据分析。
3 统计学方法
采用 SPSS 17.0 统计软件进行分析,实验数据以—x±s表示,组间比较采用方差分析。P<0.05 表示差异有统计学意义。
4 结果
4.1 Open-f ield 实验结果
与空白组比较,模型组大鼠 3 m in 内水平和垂直活动次数均显著降低(P<0.01);与模型组比较,氟西汀组和百事乐高、中剂量组模型大鼠水平和垂直活动次数显著增加(P<0.05,P<0.01)。结果见表 1。
表 1 各组大鼠水平和垂直活动次数比较(±s,次)
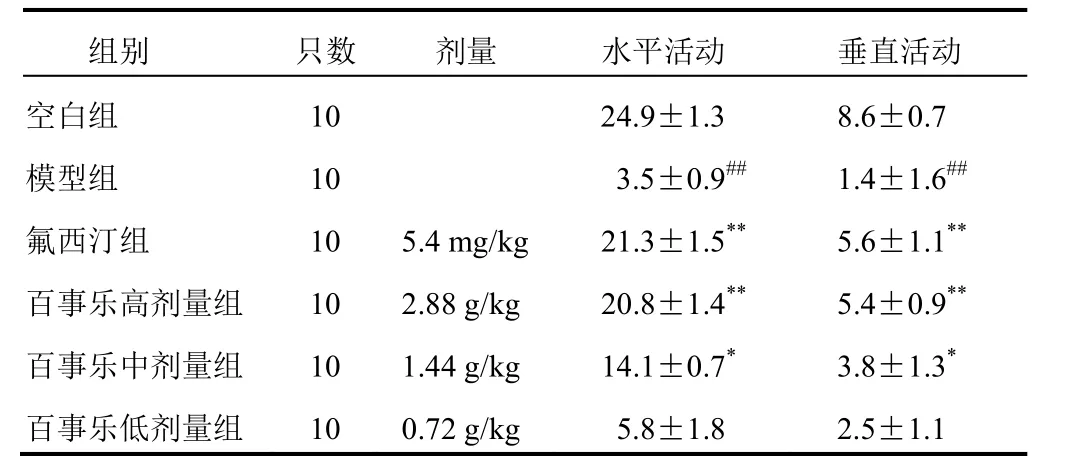
表 1 各组大鼠水平和垂直活动次数比较(±s,次)
注:与空白组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01(下同)
组别 只数 剂量 水平活动 垂直活动空白组 10 24.9±1.3 8.6±0.7模型组 10 3.5±0.9## 1.4±1.6##氟西汀组 10 5.4 mg/kg 21.3±1.5** 5.6±1.1**百事乐高剂量组 10 2.88 g/kg 20.8±1.4** 5.4±0.9**百事乐中剂量组 10 1.44 g/kg 14.1±0.7* 3.8±1.3*百事乐低剂量组 10 0.72 g/kg 5.8±1.8 2.5±1.1
4.2 新奇摄食实验结果
与空白组比较,模型组大鼠摄食潜伏期显著延长(P<0.01);与模型组比较,氟西汀组和百事乐高、中剂量组大鼠摄食潜伏期显著缩短(P<0.05,P<0.01)。结果见表 2。
表 2 各组大鼠摄食潜伏期比较(±s,s)

表 2 各组大鼠摄食潜伏期比较(±s,s)
组别 只数 剂量 摄食潜伏期空白组 10 9.7±1.6模型组 10 69.8±6.3##氟西汀组 10 5.4 mg/kg 19.8±4.8**百事乐高剂量组 10 2.88 g/kg 23.1±5.1**百事乐中剂量组 10 1.44 g/kg 36.6±7.7*百事乐低剂量组 10 0.72 g/kg 58.2±8.4
4.3 百事乐胶囊对模型大鼠单胺神经递质的影响
与空白组比较,模型组大鼠血清 5-HT 和 NE 含量显著降低(P<0.01);与模型组比较,氟西汀组和百事乐高、中剂量组大鼠血清 5-HT 和 NE 含量显著升高(P<0.05,P<0.01)。结果见表 3。
表 3 各组大鼠血清神经递质含量比较(±s,ng/g)
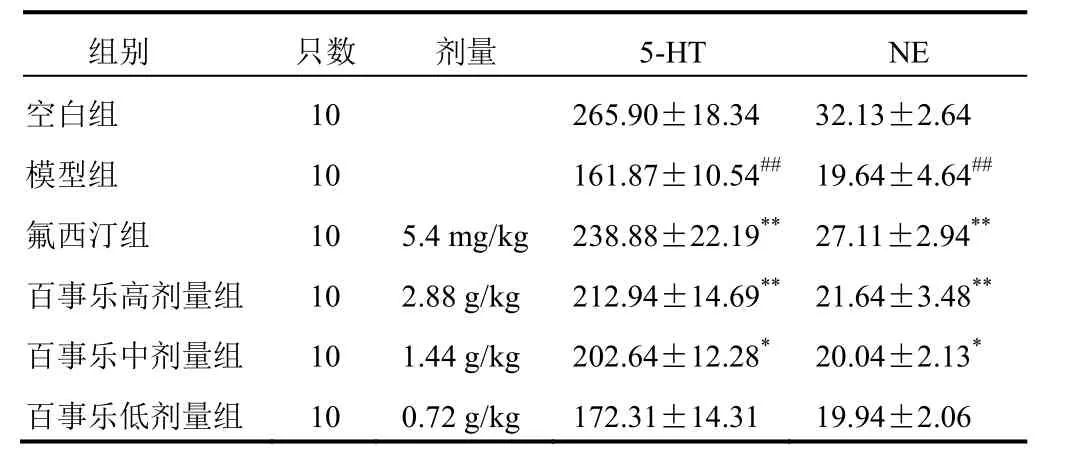
表 3 各组大鼠血清神经递质含量比较(±s,ng/g)
组别 只数 剂量 5-HT NE空白组 10 265.90±18.34 32.13±2.64模型组 10 161.87±10.54## 19.64±4.64##氟西汀组 10 5.4 mg/kg 238.88±22.19** 27.11±2.94**百事乐高剂量组 10 2.88 g/kg 212.94±14.69** 21.64±3.48**百事乐中剂量组 10 1.44 g/kg 202.64±12.28* 20.04±2.13*百事乐低剂量组 10 0.72 g/kg 172.31±14.31 19.94±2.06
4.4 免疫荧光检测结果
与空白组比较,模型组大鼠海马 CA3 区 PI3K、AKT 免疫阳性细胞数减少,SGK1免疫阳性细胞数增加(P<0.01);与模型组比较,氟西汀组和百事乐高剂量组大鼠海马 CA3 区 PI3K、AKT 免疫阳性细胞数增加(P<0.05,P<0.01),SGK1 免疫阳性细胞数减少(P<0.01),百事乐胶囊中剂量组 PI3K 免疫阳性细胞数增加(P<0.01),SGK1 免疫阳性细胞数减少(P<0.05)。结果见表 4、图 1~图 3。
表 4 各组大鼠海马 CA3 区 PI3K、AKT、SGK1 免疫阳性细胞数比较(±s)
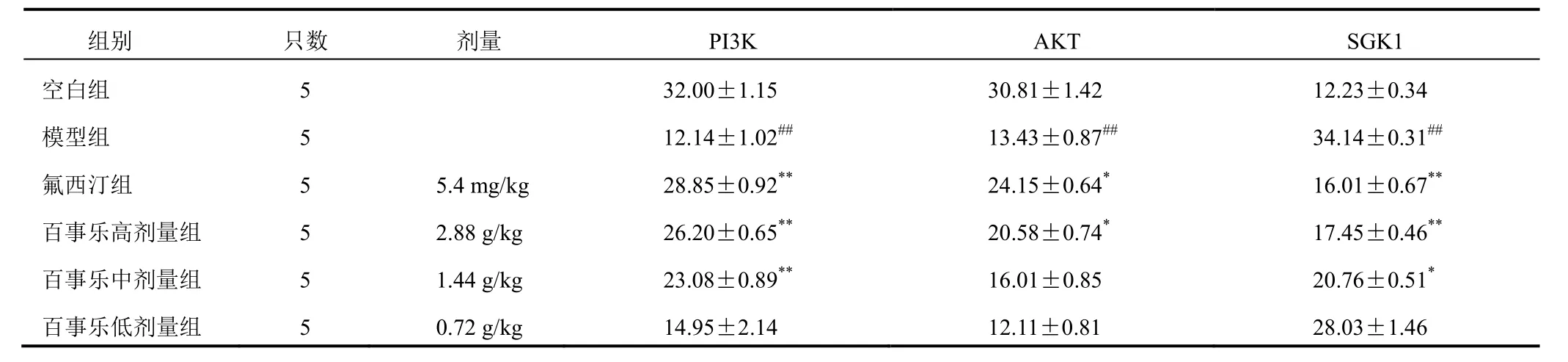
表 4 各组大鼠海马 CA3 区 PI3K、AKT、SGK1 免疫阳性细胞数比较(±s)
组别 只数 剂量 PI3K空白组 5 32.00±1.15模型组 5 12.14±1.02##氟西汀组 5 5.4 mg/kg 28.85±0.92**百事乐高剂量组 5 2.88 g/kg 26.20±0.65**百事乐中剂量组 5 1.44 g/kg 23.08±0.89**百事乐低剂量组 5 0.72 g/kg 14.95±2.14 AKT SGK1 30.81±1.42 12.23±0.34 13.43±0.87## 34.14±0.31##24.15±0.64* 16.01±0.67**20.58±0.74* 17.45±0.46**16.01±0.85 20.76±0.51*12.11±0.81 28.03±1.46

图 1 各组大鼠海马 CA3 区 PI3K 表达(免疫荧光染色,×40)

图 3 各组大鼠海马 CA3 区 SGK1 表达(免疫荧光染色,×40)
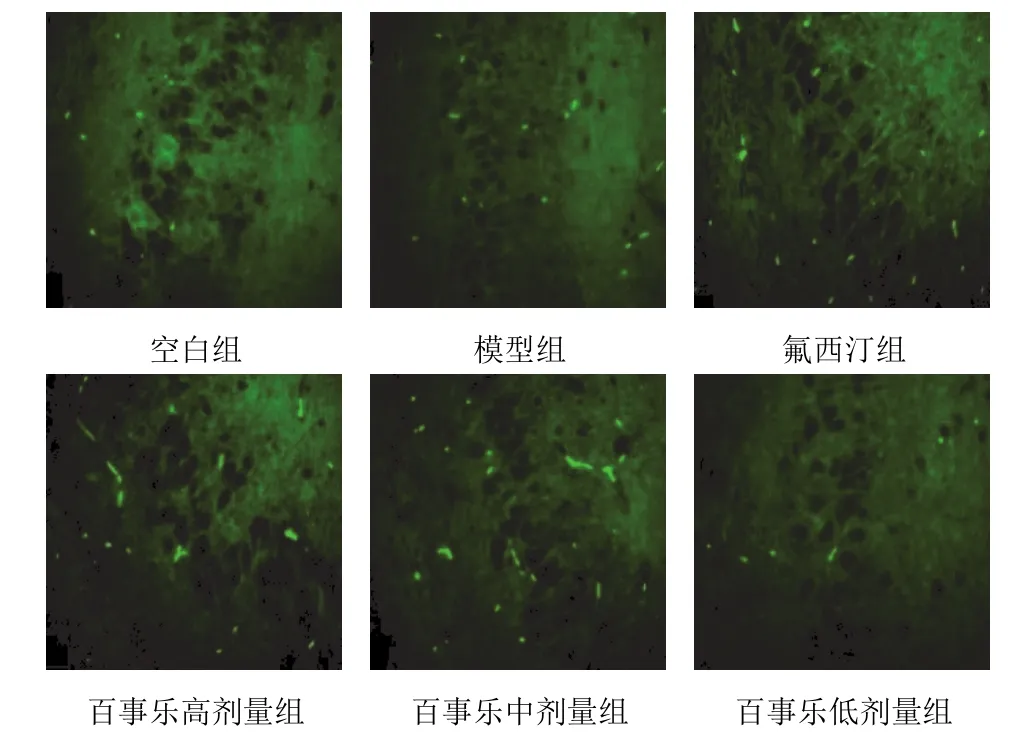
图 2 各组大鼠海马 CA3 区 AKT 表达(免疫荧光染色,×40)
4.5 Western blot 检测结果
模型组较空白组大鼠海马 PI3K、AKT 表达明显降低,SGK1 表达明显增加(P<0.01);与模型组比较,氟西汀组和百事乐高剂量组大鼠海马 PI3K、AKT表达明显增加,SGK1 表达显著降低(P<0.05,P<0.01),百事乐中剂量组大鼠海马 PI3K 表达明显增加、SGK1 表达明显降低(P<0.05)。结果见图 4、表 5。

图 4 各组大鼠海马 PI3K、AKT、SGK1 蛋白表达免疫印迹图
表 5 各组大鼠海马 CA3 区 PI3K、AKT、SGK1 蛋白表达比较(s)

表 5 各组大鼠海马 CA3 区 PI3K、AKT、SGK1 蛋白表达比较(s)
组别 只数 剂量 PI3K空白组 5 0.872±0.015模型组 5 0.214±0.012##氟西汀组 5 5.4 mg/kg 0.785±0.020**百事乐高剂量组 5 2.88 g/kg 0.762±0.015**百事乐中剂量组 5 1.44 g/kg 0.514±0.012*百事乐低剂量组 5 0.72 g/kg 0.395±0.014 AKT SGK1 0.781±0.009 0.823±0.034 0.253±0.017## 1.214±0.071##0.683±0.013* 0.901±0.061**0.546±0.006* 0.911±0.073**0.401±0.015 1.095±0.059*0.311±0.011 1.161±0.046
5 讨论
目前,根据抑郁症发病机制各种假说开发的治疗抑郁症药物大多存在起效延迟、复发率高和不良反应大等现象。中药立足于整体,可调节机体的多系统、多环节、多靶点,对复杂的神经精神疾病有独特疗效。
本实验采用目前国际公认的新奇摄食实验和旷场实验对抑郁症动物模型进行行为学评价,发现模型组大鼠摄食潜伏期明显延长,水平和垂直活动次数减少,且血液学检测中发现血清单胺神经递质显著降低。百事乐各剂量组可显著缩短模型大鼠摄食潜伏期,增加其自主活动和血清单胺神经递质含量,提示百事乐胶囊可有效改善抑郁样症状。
P13K 是一种胞内磷脂酰肌醇激酶,是生长因子受体家族信号转导过程中的重要成员,其下游依赖于AKT 的信号通路即指 AKT 是 P13K 下游信号的靶蛋白,可参与胞内物质代谢,调节细胞的生长和凋亡[4]。非依赖于 AKT 的信号通路即指 SGK1 是 PI3K 的下游靶蛋白,其是不同于 AKT 的另一种 PI3K 下游靶点,可被 PI3K 激活后参与细胞存活的调节[5-6]。
PI3K-AKT 信号通路是促进细胞生存和维持细胞正 常 功能的关 键 信息分子 链[7]。 在精 神疾患 中 ,PI3K-AKT 信号通路受抑制,可使中枢神经元和海马干细胞功能下降,从而导致精神疾病的产生[8]。SGK1是 PI3K 下游不同于 AKT 的一种快速诱导型蛋白激酶,结构与 AKT 高度相似。SGK1作为皮质醇对神经发生和糖皮质激素受体功能变化的“调解者”,可参与胞内转运、神经兴奋等生理过程[9]。SGK1 在慢性不可预测应激大鼠和慢性皮质酮诱导的抑郁样小鼠海马中的表达均显著增加[10-11]。本实验中,免疫荧光、Western blot结果发现,模型组大鼠海马 PI3K、AKT表达降低,SGK1 表达增加,而给予百事乐胶囊后,这些变化明显发生改变或逆转,尤以对 PI3K/SGK1信号的调节更为显著。
综上,百事乐胶囊发挥抗抑郁功效的机制主要通过调节海马 PI3K 及其下游 SGK1 信号而实现。下一步拟采用化学阻断技术,分别从在体动物和离体原代神经元细胞不同层面探讨其对SGK1信号的作用机制及起效靶点。
[1] 韩远山,王宇红,孟盼,等.百事乐胶囊对抑郁模型大鼠海马神经元显微结构及凋亡的影响[J].时珍国医国药,2015,26(1):44-47.
[2] 张秀丽,孟盼,王宇红,等.百事乐胶囊对 CUMS 大鼠海马 CA3、DG 区神元再生相关蛋白的影响[J].中国中医药信息杂志,2015,22(5):52-56.
[3] 王宇红,孟盼,蔡光先,等.百事乐胶囊对慢性应激抑郁模型大鼠行为学及海马突触素表达的影响[J].世界科学技术-中医药现代化,2013, 15(7):1562-1568.
[4] HANADA M, FENG J, HEMMINGS B A. Structure, regulation and function of PKB/AKT—a major therapeutic target[J]. Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics,2004,1697(1):3-16.
[5] JIANG B, WANG F, YANG S, et al. SKF83959 produces antidepressant ef fects in a chronic social defeat stress model of depression through BDNF-TrkB pathway[J]. International Journal of Neuropsychopharmacology,2015,18(6):1-13.
[6] 刘小美,潘志强,方肇勤,等.黄连-大黄-肉桂复方对肝癌细胞增殖及PTEN-PI3K-AKT/SGK1 信号通路的影响[J].上海中医药大学学报,2016, 30(1):50-54.
[7] SCHULZ R. A new paradigm:cross talk of protein kinases during reper fusion saves li fe[J]. American Journal of Physiology-Heart and Circulatory Physiology,2005,288(1):H1-H2.
[8] EMAMIAN E S, HALL D, BIRNBAUM M J, et al. Convergent evidence for impaired AKT1-GSK3β signal ing in schizophrenia[J]. Nature Genetics,2004,36(2):131-137.
[9] LANG F, ARTUNC F V. The physiological impact of the serum and glucocorticoid-inducible kinase SGK1[J]. Curr Opin Nephrol Hypertens,2009,18:439-448.
[10] ANACKER C, CATTANEO A, MUSAELYAN K, et al. Role for the kinase SGK1 in stress, depression, and glucocor ticoid ef fects on hippocampal neurogenesis[J]. Proc Nat l Acad Sci,2013,110(21):8708-8713.
[11] ZHANG K, PAN X, WANG F, et al. Baical in promotes hippocampal neurogenesis via SGK1 and FKBP5 mediated glucocorticoid receptor phosphorylation in aneuroendocrine mouse model of anxiety/ depression[J]. Sci Rep,2016:30951-30958.
Effects of Baishile Capsules on Hippocampal PI3K Signaling Pathway in Chronic Mild Unpredictable Stress Rats
MENG Pan1, DU Qing1, ZHANG Xiu-li1, LIU Zhuo1, XIANG Yun1, LIU Lin2, WANG Yu-hong1,2(1. Training Bases of Hunan Key Laboratory of Chinese Materia Medica Powder and Innovative Drugs Established by Provincial and Ministry, Changsha 410208, China; 2. First Hospital of Hunan University of Chinese Medicine, Changsha 410007, China)
Objective To observe the effects of Baishile Capsules on the hippocampal PI3K signaling pathway in chronic mild unpredictable stress (CUMS) rats; To discuss its mechanism of action for anti-depression. Methods SD rats were random ly divided into 6 groups, control group, model group, fluoxetine group, Baishile Capsules high-, medium- and low-dose groups, With 10 rats in each group. The cums depression model was established, and gavage for medication was conducted at the same time for 21 days in a row. The behavioral changes of rats in each group were detected by the novel feeding experiment and Open-field experiment; monoam ine neurotransmitter in serum were detected by ELISA; the expressions of PI3K, AKT and SGK1 in rat hippocampus were detected by immunofluorescence and Western blot test. Results Compared With the control group, feeding latency of rats in modelgroup was significantly prolonged (P<0.01), horizontal and vertical activities were significantly reduced (P<0.01); the content of serum monoamine neurotransmitter decreased (P<0.01); the expressions of PI3K and AKT in hippocampus decreased, while the expression of SGK1 increased (P<0.01, P<0.05). Compared With the model group, Baishile Capsule high- and medium-dose groups can significantly shorten the incubation period of feeding rats (P<0.05), and increase the number of horizontal and vertical activities (P<0.01); the 5-HT and NE levels in serum were significantly elevated (P<0.05, P<0.01); the expressions of PI3K, AKT in hippocampal increased; the expression of SGK1 decreased (P<0.05, P<0.01). Conclusion Baishile Capsules can alleviate the depression like behavior in rat models, and regulate key factors of hippocampal PI3K signaling pathway, so as to exert antidepressant effects.
Baishile Capsules; depression; hippocampus; PI3K; AKT; SGK1; rats
10.3969/j.issn.1005-5304.2017.08.010
R285.5
A
1005-5304(2017)08-0041-05
2017-01-06)
(
2017-01-22;编辑:华强)
国家自然科学基金青年基金(81403387);湖南省教育厅一般项目(14C0862);中医内科学省部共建教育部重点实验室开放基金(ZYNK201503);湖南中医药大学校级青年基金(99820001-147)
王宇红,E-mail:wyh107@126.com

