肠内营养辅助治疗对食管癌患者术后吻合口瘘的预防及对免疫能力、愈合进程及营养恢复的影响
靳智勇 任海燕 梁俊国
(内蒙古医科大学附属医院胸外科,呼和浩特010050)
肠内营养辅助治疗对食管癌患者术后吻合口瘘的预防及对免疫能力、愈合进程及营养恢复的影响
靳智勇 任海燕①梁俊国
(内蒙古医科大学附属医院胸外科,呼和浩特010050)
目的:探讨肠内营养辅助治疗对食管癌患者术后吻合口瘘的预防效果及对患者免疫功能、愈合进程及营养恢复的影响。方法:回顾性分析90例行手术治疗的食管癌患者临床资料,根据其术后营养辅助治疗方式分为A(n=34)、B(n=30)、C(n=26)三组。A组接受免疫增强型肠内营养(瑞能)辅助治疗方案,B组采用常规肠内营养(能全力)辅助治疗方案,两组均于术后第1天、第2天及第3~7天给予全量的25%、50%和100%后,逐日减少剂量直至过渡到正常饮食;C组接受肠外营养辅助治疗方案,术后第1天起静脉输注葡萄糖、维生素、氨基酸等混合液,以125.52 kJ/kg计算,应用8~10 d后逐渐过渡至正常饮食。观察对比三组受试者术后吻合口瘘、肺部感染、切口感染发生率及创口愈合时间、总住院时间、首次排气时间差异,记录其术前及术后第1、8天时免疫指标[T淋巴细胞及其亚群(CD3+、CD4+、CD8+)]、炎症因子[C反应蛋白(CRP)、IL-6]、营养指标[血清总蛋白(TP)、清蛋白(ALB)]变化情况。结果:①三组术后吻合口瘘及肺部感染发生率对比差异有统计学意义(P<0.05),且C组发生率显著高于其他两组(P<0.05)。②三组创口愈合时间、总住院时间及首次排气时间对比均有统计学意义(P<0.05),且C组均长于其他两组(P<0.05)。③术后第1天,三组患者CD3+、CD4+、CD4+/CD8+等免疫指标水平及TP、ALB等营养指标水平均较术前显著降低,CD8+水平及CRP、IL-6等炎症因子水平则较术前显著提升(P<0.05),但组间对比无统计学意义(P>0.05)。术后第8天,三组各营养指标仍明显低于术前,但A、B组显著高于C组(P<0.05);各炎症因子指标仍显著高于术前(P<0.05),但A、B组显著低于C组(P<0.05)。三组中A组术后第8天各免疫指标与术前比较无统计学意义(P>0.05),其余两组患者CD3+、CD4+、CD4+/CD8+水平均较术前降低,CD8+水平则明显提升(P<0.05)。结论:食管癌患者术后予以肠内营养辅助治疗方案,能有效改善其预后质量,对缩短愈合进程、提升机体免疫功能、改善营养状态等具有积极影响。
肠内营养辅助治疗;食管癌;吻合口瘘;预防;免疫能力;愈合进程;营养恢复
食管癌是一种常见的消化道恶性肿瘤,早期症状具有一定隐匿性,仅部分患者吞咽粗硬食物时出现不适感,一旦进展至中晚期后,大部分患者表现为进行性咽下困难症状[1],对其正常饮水、进食等均存在不良影响。随着相关研究的深入,越来越多学者发现在食管癌患者术前或术后予以营养辅助治疗,能在短期内调节机体营养状态,以提升机体耐受力和免疫力[2],利于改善手术治疗效果,帮助患者获得理想的预后质量。当前临床常用的营养辅助治疗方案可大致分为肠内和肠外两种。近年来,随着临床经验的积累和相关认知的加深,肠内营养在消化道肿瘤中的应用范围逐渐扩大[3],以其为基础衍生而出的多种新型肠内营养治疗方案也备受关注。免疫增强型肠内营养在常规肠内营养的基础上提升精氨酸、谷氨酰胺等特殊营养成分比例,试图以此进一步提升机体免疫力,促进术后创口愈合,为患者达到良好的预后效果创造条件。本研究为探究不同营养辅助治疗方案对食管癌患者术后免疫功能、营养状态及愈合进程的影响差异,回顾性分析90例行手术治疗的食管癌患者临床资料,旨在寻求更切实可行且疗效确切的营养辅助治疗方案,以提升食管癌患者存活质量,现报告如下。
1 资料与方法
1.1 资料 回顾性分析2013年2月至2014年4月入我院行外科手术治疗的90例食管癌患者临床资料。纳入标准:①经病理检查确诊且符合《消化道肿瘤诊断与治疗》中食管癌相关诊断标准及相关外科手术治疗适应症的患者[4];②符合中国抗癌协会肿瘤营养与支持治疗专业委员会2015年拟定的《中国肿瘤营养治疗指南(2015)》中营养辅助治疗适应证的患者[5];③临床资料完整的患者;④术前了解并自愿签署知情同意书的患者;⑤经我院伦理委员会批准的患者。排除标准:①相关治疗禁忌证的患者;②合并严重脏器功能障碍、器质性病变、自身免疫性疾病、凝血功能障碍或其他原发性恶性肿瘤的患者;③合并精神疾病或意识障碍的患者;④中途更换术式、更改营养辅助治疗方案、转院、死亡或随访期失联的患者;⑤未成年或年龄超过80岁的患者;⑥治疗依从性不足的患者;⑦术前或术后接受化疗、放疗者;⑧术前存在营养不良[体质量指数(BMI)≤15 kg/m2]者。此次入组受试者均根据其术后营养辅助治疗方式分为A(n=34)、B(n=30)、C(n=26)三组,其性别、年龄、BMI、肿瘤位置等基本资料比较,差异无统学意义(P>0.05),具有可比性,详见表1。本研究方案经我院伦理委员会批准,所有患者均签署知情同意书。
1.2 方法
1.2.1 治疗方法 三组患者均参考《消化道肿瘤诊断与治疗》中相关要求完成外科手术治疗[4]。术后,A组接受免疫增强型肠内营养辅助治疗方案:肠内营养乳剂(TPF-T)(商品名称:瑞能,生产企业:华瑞制药有限公司,规格:200 ml/瓶,批准文号:国药准字H20040722),术后第1天予以目标热量的25%,术后第2天予以目标热量的50%,术后第3~7 天予以全量后,逐日减少剂量直至过渡到正常饮食。B组采用常规肠内营养辅助治疗方案:肠内营养混悬液(TPF)[商品名称:能全力,生产企业:纽迪希亚制药(无锡)有限公司,规格:500 ml/瓶,批准文号:国药准字H20030011],术后第1天予以目标热量的25%,术后第2天予以目标热量的50%,术后第3~7天予以全量,后逐日减少剂量直至过渡到正常饮食。C组接受肠外营养辅助治疗方案:术后第1天起,静脉输注葡萄糖、氨基酸、维生素和电解质混合液,总热量以125.52 kJ/kg计算,应用8~10 d后逐渐过渡至正常饮食。
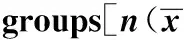
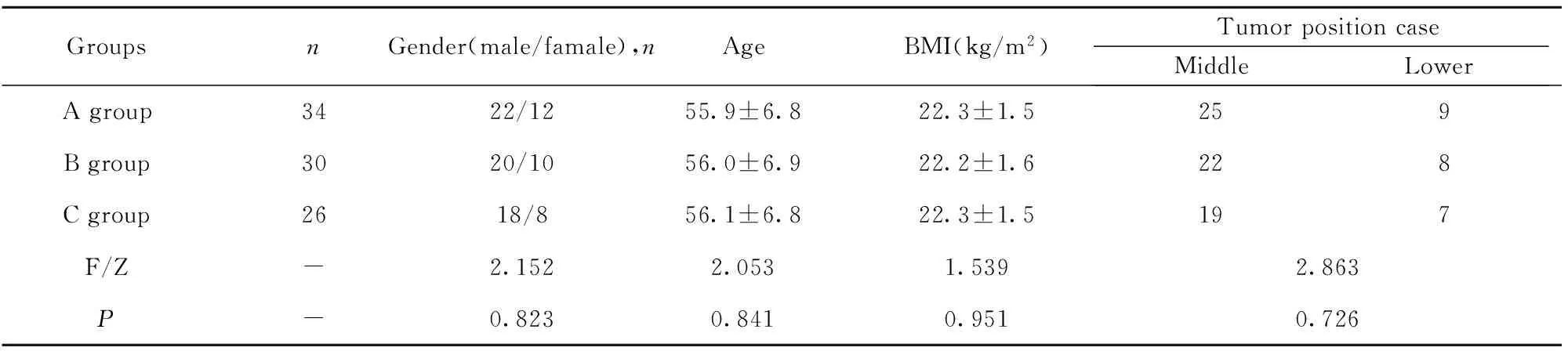
GroupsnGender(male/famale),nAgeBMI(kg/m2)TumorpositioncaseMiddleLowerAgroup3422/1255.9±6.822.3±1.5259Bgroup3020/1056.0±6.922.2±1.6228Cgroup2618/856.1±6.822.3±1.5197F/Z-2.1522.0531.5392.863P-0.8230.8410.9510.726
表2 三组患者术后感染情况比较[n(%)]
Tab.2 Comparison of infection in three groups after surgery[n(%)]
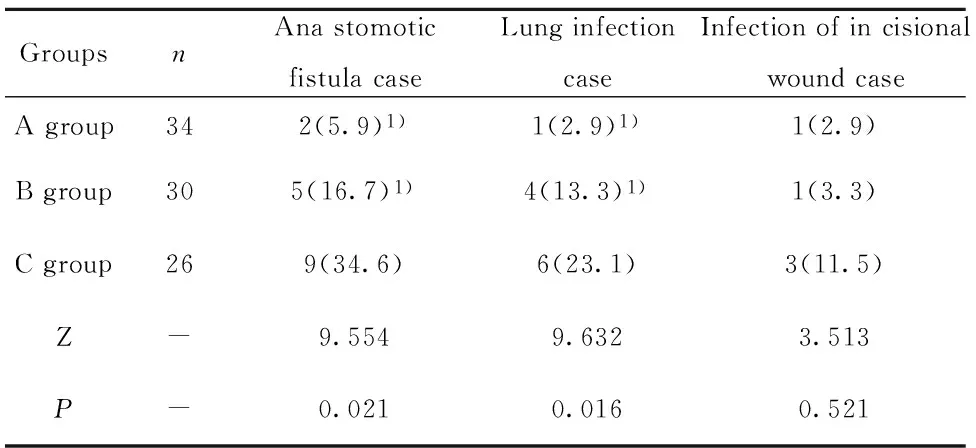
GroupsnAnastomoticfistulacaseLunginfectioncaseInfectionofincisionalwoundcaseAgroup342(5.9)1)1(2.9)1)1(2.9)Bgroup305(16.7)1)4(13.3)1)1(3.3)Cgroup269(34.6)6(23.1)3(11.5)Z-9.5549.6323.513P-0.0210.0160.521
Note:Compared C group,1)P<0.05.
1.2.2 指标检测方法 三组受试者均于术前、术后第1、8天抽取晨起空腹肘前静脉血10 ml,使用BD FACSCalibur 型流式细胞仪检查T淋巴细胞及其亚群(CD3+、CD4+、CD8+、CD4+/CD8+)水平;使用罗氏 Modular P800型全自动生化分析仪检测营养指标(TP、ALB);放射免疫法测定IL-6水平;免疫比浊法测定CRP水平。
1.2.3 观察指标 观察对比三组受试者术后吻合口瘘、肺部感染、切口感染发生率及创口愈合时间、总住院时间、首次排气时间差异,记录其术前及术后第1、8天时免疫指标[T淋巴细胞及其亚群(CD3+、CD4+、CD8+、CD4+/CD8+)]、炎症因子(CRP、IL-6)、营养指标(TP、ALB)变化情况。

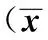
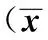
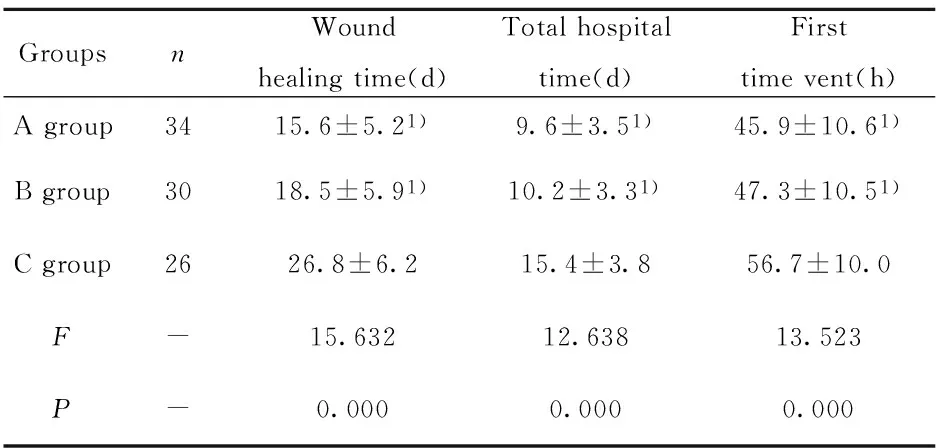
GroupsnWoundhealingtime(d)Totalhospitaltime(d)Firsttimevent(h)Agroup3415.6±5.21)9.6±3.51)45.9±10.61)Bgroup3018.5±5.91)10.2±3.31)47.3±10.51)Cgroup2626.8±6.215.4±3.856.7±10.0F-15.63212.63813.523P-0.0000.0000.000
Note:Compared with C group,1)P<0.05.
2 结果
2.1 三组患者术后感染情况比较 三组术后吻合口瘘及肺部感染发生率对比差异有统计学意义(P<0.05),且C组发生率显著高于其他两组(P<0.05);三组切口感染对比无统计学意义(P>0.05),详见表2。
2.2 三组患者围术期恢复指标比较 三组创口愈合时间、总住院时间及首次排气时间对比均有统计学意义(P<0.05),且C组均长于其他两组,差异有统计学意义(P<0.05),详见表3。
2.3 三组患者手术前后免疫指标比较 术前,三组患者T淋巴细胞及其亚群检测结果对比均无统计学意义(P>0.05);术后第1天,三组患者CD3+、CD4+及CD4+/CD8+均较术前显著降低,CD8+则较术前显著提升,手术前后各指标差异具有统计学意义(P<0.05),但组间对比无统计学意义(P>0.05);术后第8天,三组中除A组各指标与术前比较无统计学意义(P>0.05)外,其余两组患者CD3+、CD4+及CD4+/CD8+水平均显著低于术前,CD8+则明显高于术前水平,差异具有统计学意义(P<0.05),详见表4。
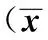
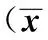
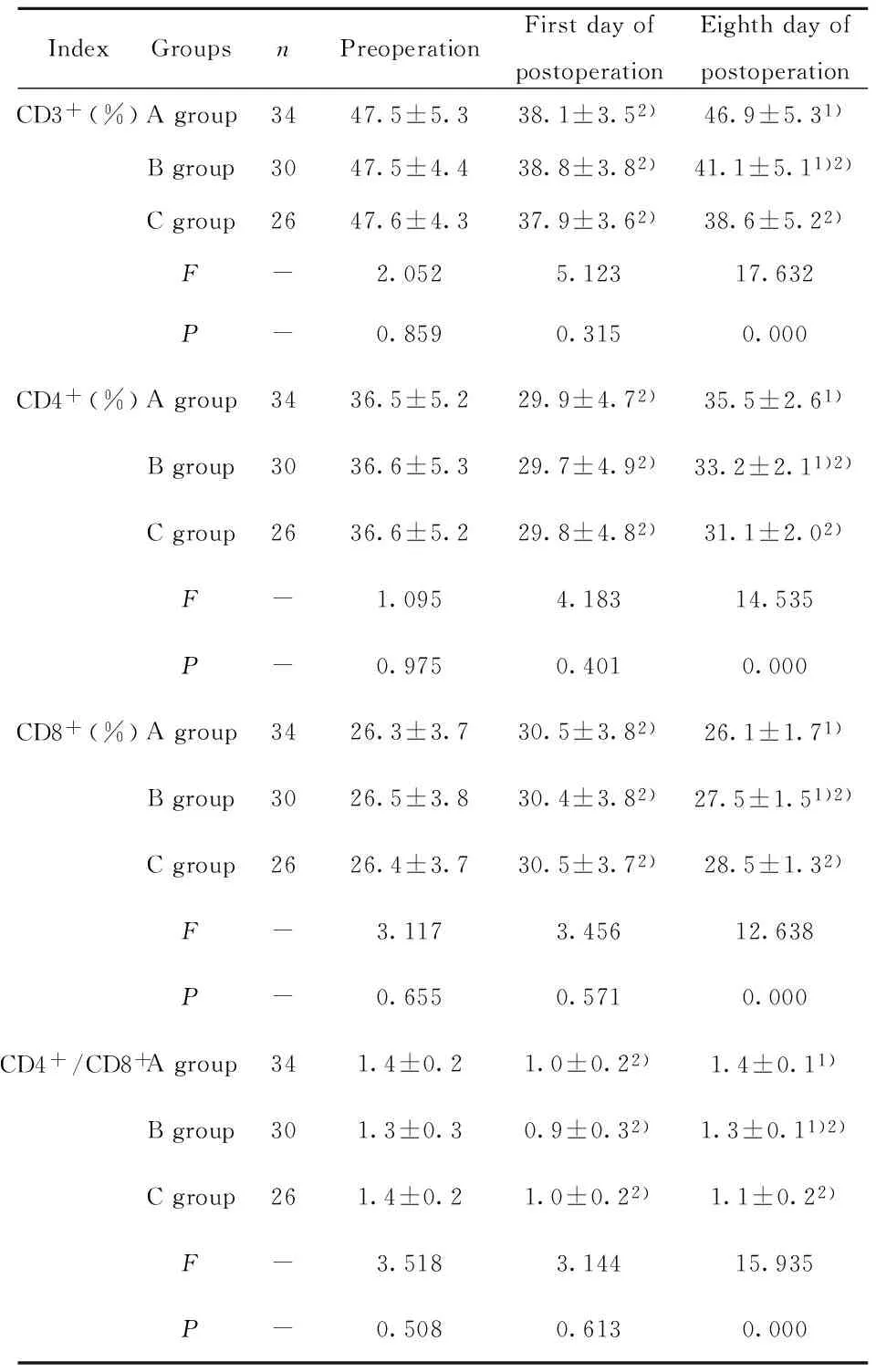
IndexGroupsnPreoperationFirstdayofpostoperationEighthdayofpostoperationCD3+(%)Agroup3447.5±5.338.1±3.52)46.9±5.31)Bgroup3047.5±4.438.8±3.82)41.1±5.11)2)Cgroup2647.6±4.337.9±3.62)38.6±5.22)F-2.0525.12317.632P-0.8590.3150.000CD4+(%)Agroup3436.5±5.229.9±4.72)35.5±2.61)Bgroup3036.6±5.329.7±4.92)33.2±2.11)2)Cgroup2636.6±5.229.8±4.82)31.1±2.02)F-1.0954.18314.535P-0.9750.4010.000CD8+(%)Agroup3426.3±3.730.5±3.82)26.1±1.71)Bgroup3026.5±3.830.4±3.82)27.5±1.51)2)Cgroup2626.4±3.730.5±3.72)28.5±1.32)F-3.1173.45612.638P-0.6550.5710.000CD4+/CD8+Agroup341.4±0.21.0±0.22)1.4±0.11)Bgroup301.3±0.30.9±0.32)1.3±0.11)2)Cgroup261.4±0.21.0±0.22)1.1±0.22)F-3.5183.14415.935P-0.5080.6130.000
Note:Compared with that in group C in the same period,1)P<0.05;compared with that in the same group before surgery,2)P<0.05.
2.4 三组患者手术前后炎症因子指标比较 术前,三组患者各炎症因子检测结果对比均无统计学意义(P>0.05);术后第1天,三组患者CRP、IL-6水平均较术前显著提升,差异具有统计学意义(P<0.05),但组间对比无统计学意义(P>0.05);术后第8天,三组上述指标仍明显高于术前(P<0.05),但A、B组显著低于C组(P<0.05),详见表5。
2.5 三组手术前后营养指标比较 术前,三组患者各营养指标检测结果对比均无统计学意义(P>0.05);术后第1天,三组患者TP、ALB水平均较术前显著降低,差异具有统计学意义(P<0.05),但组间对比无统计学意义(P>0.05);术后第8天,三组上述指标仍明显低于术前(P<0.05),但A、B组显著高于C组(P<0.05),详见表6。
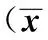
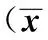

IndexGroupsnPreoporationFirstdayofpostoperationEighthdayofpostoperationCRP(mg/L)Agroup342.7±1.238.9±3.22)4.3±1.21)2)Bgroup302.8±1.138.5±3.22)8.9±2.51)2)Cgroup262.9±1.238.7±3.42)13.2±3.32)F-2.1532.05325.305P-0.8110.8410.000IL-6(pg/ml)Agroup34279.5±135.4516.3±254.32)344.6±69.61)2)Bgroup30281.63±134.2517.7±255.02)413.5±62.21)2)Cgroup26280.3±133.9516.9±254.92)471.3±61.92)F-3.5394.12521.535P-0.4770.4590.000
Note:Compared with that in group C in the same period,1)P<0.05;compared with that in the same group before surgery,2)P<0.05.
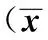

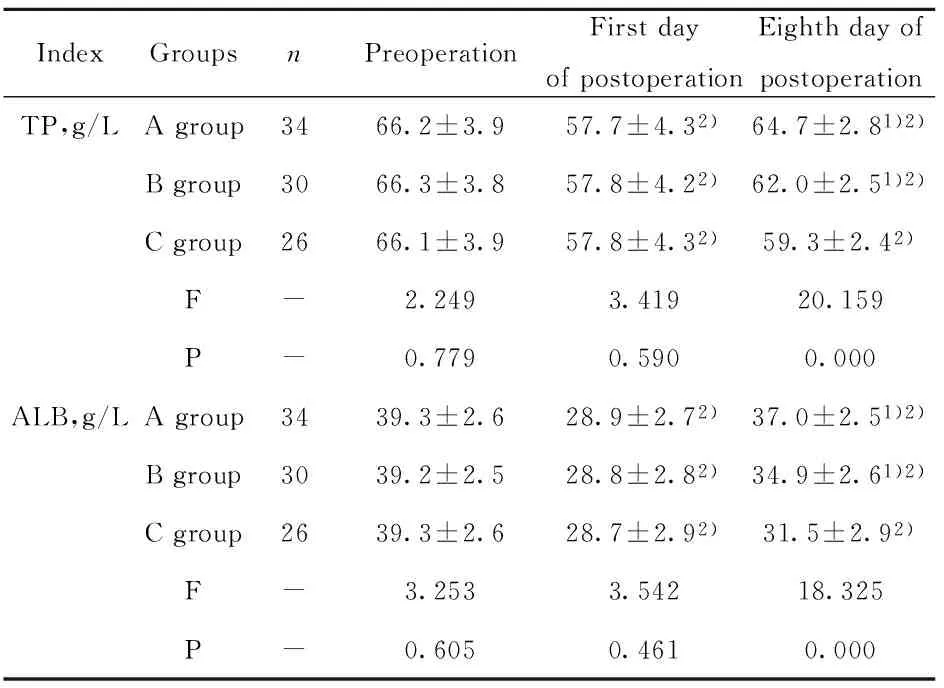
IndexGroupsnPreoperationFirstdayofpostoperationEighthdayofpostoperationTP,g/LAgroup3466.2±3.957.7±4.32)64.7±2.81)2)Bgroup3066.3±3.857.8±4.22)62.0±2.51)2)Cgroup2666.1±3.957.8±4.32)59.3±2.42)F-2.2493.41920.159P-0.7790.5900.000ALB,g/LAgroup3439.3±2.628.9±2.72)37.0±2.51)2)Bgroup3039.2±2.528.8±2.82)34.9±2.61)2)Cgroup2639.3±2.628.7±2.92)31.5±2.92)F-3.2533.54218.325P-0.6050.4610.000
Note:Compared with that in group C in the same period,1)P<0.05;compared with that in the same group before surgery,2)P<0.05.
3 讨论
3.1 食管癌的研究进展 据不完全资料统计,全球每年30万以上的食管癌患者死亡,我国作为该疾病的高发地区之一,每年的病死率约占全球病死患者的50%[6],对患者生命健康安全威胁极大。因食管癌的高发病率和高死亡率,越来越多学者将其作为重点研究对象,临床涉及食管癌发病机制、流行病学、危险因素、治疗方法等内容的报道也日益增多[7-10]
相关研究指出,食管癌以40岁以上的中老年人为主要患病群体,男性发病率高于女性[8];大部分病情发展至中晚期的患者存在典型的进行性咽下困难症状,严重时可能连水或唾液等流质物质也难以吞咽,可引起消瘦、脱水或无力表现,使其难以耐受放化疗或手术,对治疗工作的开展不利。
3.2 不同营养辅助治疗对食管癌患者术后恢复的影响分析 由于瘤体对机体营养的消耗和患者因吞咽困难致食物摄入量少,食管癌患者即使符合手术的相关适应证,也易因机体过度的蛋白质-热量消耗引起的营养不良影响手术效果;加之手术创伤造成的应激反应加剧、炎症反应升高,部分受试者术后可能出现较明显的免疫功能和代谢功能受损情况[9],轻则加剧营养不良程度,影响预后质量;重则引发感染等并发症发生,威胁其生命健康安全。
自“静脉高营养”理念在世纪20世纪60年代被首次提出以来,临床对外科营养支持的研究日益深入,相关治疗干预手段也不断发展、革新。当前越来越多学者发现,外科营养支持不能仅停留于维护能量和氮平衡,还应当以调节机体免疫力、降低炎症反应、减轻氧化应激反应等为目的[10],以此最大程度地维护机体组织及细胞功能,减轻疾病与手术对机体的损害程度,促进患者病情转归、改善其预后质量。术前予以食管癌患者相关肠内外营养辅助治疗,能通过调节其术前机体营养状态,以提升及机体耐受性和免疫力,帮助患者尽快达到最佳手术状态,从而提高治疗效率,节省宝贵的治疗时间[11]。为术后营养治疗利于调节患者术后的机体状态,以减轻手术创伤对预后的不良影响,从而达到改善受试者术后恢复效果的目的。
本研究发现,接受营养辅助治疗的三组食管癌受试者术后第1天均出现明显的免疫功能降低、炎症因子水平升高、营养状态减弱等反应,且组间比较无统计学意义,表明手术创伤可在一定程度上影响患者术后恢复状态,对其预后不利,需引起临床重视,及早予以相关干预措施,最大限度地调节机体状态,以满足术后恢复需求。而三组受试者中,予以肠外营养辅助治疗的C组基本完成治疗措施后,炎症因子水平仍明显高于术前及A、B组检测结果,免疫指标及营养评估指标则显著低于术前和其他两组受试者,证实该营养辅助治疗方案不及肠内营养干预效果突出,对机体炎症反应的抑制作用及对免疫功能、营养状态的调节作用弱于肠内营养干预,建议肠内营养治疗耐受的患者予以此方案,提高预后水平。有学者报道中得到类似结论[12],其认为肠道作为机体免疫系统的主要场所之一,在正常免疫防预中发挥积极作用。肠外营养干预虽能在短期内补充机体所需的氮、能量、脂肪等营养物质,以满足其正常运作需求,但长期干预可能损伤机体细胞免疫功能,促CD3+、CD4+及CD4+/CD8+等水平降低,削弱机体免疫功能[13]。而肠内营养辅助治疗则能通过模拟正常的生理状态,使肠黏膜同营养物质接触,以维持肠黏膜的活性和免疫屏障作用,纠正患者免疫抑制情况,促门静脉循环恢复[14],达到调节免疫力及营养状态、改善预后质量的目的。
随着相关研究的深入,部分学者在免疫增强型肠内营养辅助治疗对消化道肿瘤患者预后影响等方面也取得一定成果[15]。本研究也将其纳入探究范围,发现采用富含谷氨酰胺、精氨酸、ω-3多不饱和脂肪酸等特殊营养成分的TPF-T——瑞能,相较于常规的TPF——能全力对受试者术后营养干预及机体免疫功能的调节效果更突出,同刘莲等[16]报道结论基本一致。该学者认为短期应用常规营养辅助治疗难以完全纠正手术创伤引起的机体免疫功能抑制反应,不利于患者预后恢复,可能增加其术后感染风险;而瑞能相较于能全力增加谷氨酰胺、精氨酸、ω-3多不饱和脂肪酸等特殊营养物质比例,能通过补充氨基酸水平刺激机体蛋白质合成,以补充谷氨酰胺为快速增生细胞提供能量,达到调节免疫功能的目的;ω-3多不饱和脂肪酸则对抑制术后炎症反应、增强肠道屏障作用有利,能通过降低术后感染风险帮助患者获得良好的预后状态。赵得新等[17]学者则指出,予以免疫增强型肠内营养辅助治疗组术后并发症发生率同肠外营养治疗组无显著差异,与本研究结论不符,猜测造成此差异的原因同研究样本量、患者个体因素不同相关,可进一步分析后予以证实。
除术后营养辅助方式的选择外,有学者还将肠内营养的治疗时机作为主要研究对象[18-20],认为腹部手术患者6 h后,胃肠的蠕动、吸收等功能即可基本恢复,食管癌患者并非对胃肠脏器进行有创治疗,故对腹腔的干扰较小,使得此类受试者术后胃肠功能恢复时间更短,更应进行早期治疗干预措施,以尽快调节机体免疫功能、降低相关并发症发生风险,改善患者预后质量。本研究仅针对不同营养辅助方案对食管癌患者术后恢复情况的影响差异予以分析,并未将治疗时机纳入探究范围,可扩大样本量后将其作为后续研究课题展开深入研究。
3.3 本研究的不足 本研究虽取得一定成果,发现肠内营养辅助治疗相较于常规的肠外营养治疗,对促进食管癌患者术后营养状态的恢复效果更突出,更利于机体提高免疫力,降低吻合口瘘等并发症发生风险;在常规肠内营养治疗基础上予以谷氨酰胺、精氨酸、ω-3多不饱和脂肪酸等特殊营养成分的补充,可进一步缩短愈合进程,利于患者尽快恢复机体理想状态,对减轻手术创伤及癌细胞侵袭产生的炎症反应、改善预后效果等具有积极影响。但受样本量、随访时间、受试者年龄、病情严重程度、手术方式、体质等个体因素的影响,仍有部分结论同其他报道内容存在差异,可扩大样本量并尽可能排除相关干扰因素后予以进一步证实,以完善结论,提高研究的准确性。
综上所述,食管癌患者术后予以肠内营养辅助治疗方案,能促进其营养状态恢复,对缩短愈合进程、提升机体免疫功能、调节炎症反应等具有积极影响,对患者预后恢复有利。
[1] 郝 瑞,边 拜.食管癌外科治疗的现状与进展[J].新疆医学,2015,45(4):528-529.
[2] 张 奕,沈国义.微创食管癌切除术150例分析[J].中国微创外科杂志,2014,14(11):998-999.
[3] Hscher AC,Laschat M,Choinitzki V,etal.Quality of life after surgical treatment for esophageal atresia:long-term outcome of 154 patients[J].Eur J Pediatr Surg,2017,doi:10.1055/S-0036-1597956.
[4] Gonzalez JM,Servajean C,Aider B,etal.Efficacy of the endoscopic management of postoperative fistulas of leakages after esophageal surgery for cancer:a retrospective series[J].Surg Endosc,2016,30(11):4895-4903.
[5] 殷 勇.胸腔镜联合腹腔镜手术切除治疗食管癌50例临床观察[J].吉林医学,2014,35(21):4684-4685.
[6] 施庆彤.胸腔镜手术与开胸手术治疗食管癌疗效比较[J].山东医药,2015,55(42):61-62.
[7] Wan J,Che Y,Kang N,etal.Surgical method,postoperative complications,and gastrointestinal motility of Thoraco-Laparoscopy 3-field esophagectomy in treatment of esophageal cancer[J]. Med Sci Monit,2016,22:2056-2065.
[8] Gentilli S,Portigliotti L,Davoli F,etal.Novel double-stapling technique for distal oesophageal resection and oesophago-jejunal anastomosis[J].Ann Ital Chir,2016,87:79-82.
[9] Gentilli S,Portigliotti L,Davoli F,etal.Novel double-stapling technique for distal oesophageal resection and oesophago-jejunal anastomosis[J].Ann Ital Chir,2016,86:79-82.
[10] 徐 迅.不同术式对食管癌患者机体代谢及转移相关指标的影响[J].海南医学院学报,2014,20(10):1392-1393.
[11] 黄 骏.微创McKeown术治疗中下段食管癌的疗效分析[J].现代诊断与治疗,2015,26(20):4584-4585.
[12] Yamana I,Takeno S,Yamada T,etal.The risk factors for refractory fistula after esophagectomy with gastric tube reconstruction in patients with esophageal cancer[J].Dig Surg,2017,34(1):18-24.
[13] Wan J,Che Y,Kang N,etal.Surgical method,postoperative complications,and gastrointestinal motility of thoraco-Laparoscopy 3-Field Esophagectomy in treatment of Esophageal Cancer[J].Med Sci Monit,2016,22:2056-2065.
[14] Nakajima Y,Kawada K,Tokairin Y,etal.Retrospective analyses of esophageal bypass surgery for patients with esophagorespiratory fistulas caused by esophageal carcinomas[J].World J Surg,2016,40(5):1158-1164.
[15] Kitagami H,Morimoto M,Nakamura K,etal.Technique of roux-en-Y reconstruction using overlap method after laparoscopic total gastrectomy for gastric cancer:100 consecutively successful cases[J].Surg Endosc,2016,30(9):4086-4091.
[16] 刘 莲,马颖杰,李 哲,等.肠内和肠外营养对食管癌病人术后免疫功能影响的系统评价[J].肠外与肠内营养,2015,22(5):264-269.
[17] 赵得新,朱甲明,陈云波,等.免疫增强型肠内营养对胃癌根治病人术后免疫功能和炎症反应的影响[J].中国实验诊断学,2011,15(3):428-430.
[18] 黄 川,杨永波,闫万璞,等.术后30天病死率低估了食管癌手术风险[J].中华胃肠外科杂志,2015,19(9):897-700.
[19] 解明然,柳常青,孙效辉,等.微创Ivor Lewis食管癌切除术治疗局部进展期食管癌近期结果分析[J].中华外科杂志,2015,3(7):518-551.
[20] 李 文,杨 柳,陈 敏,等.喉-气管组织瓣重建下咽癌累及颈段食管术后缺损[J].临床耳鼻喉和头颈外科杂志,2014,28(24):1945-1948.
[收稿2017-02-03]
(编辑 许四平 刘格格)
Effects of enteral nutrition assisted therapy in preventing postoperative anastomotic fistula in patients with esophageal cancer and its influence on immunity,healing process and nutritional recovery
JINZhi-Yong,RENHai-Yan,LIANGJun-Guo.
TheDepartmentofThoracicSurgery,theAffiliatedHospitalofInnerMongoliaMedicalUniversity,Huhhot010050,China
Objective:To investigate the effects of enteral nutrition assisted therapy in preventing postoperative anastomotic fistula in patients with esophageal cancer and its influence on immunity,healing process and nutritional recovery.Methods: The clinical data of 90 cases of patients with esophageal cancer who underwent surgical treatment were retrospectively analyzed.According to the mode of postoperative nutritional support,the patients were divided into group A(n=34),B(n=30)and C(n=26)three groups.Group A was treated by immune-enhancing enteral nutrition(Supportan)assisted therapy.Group B was treated with routine enternal nutrition(Nutrison Fibre)assisted therapy.Both of the two groups were treated with 25%,50% and 100% of the full dose on the 1st,2nd and 3rd-7th day after surgery.Later,the dose was reduced day by day till normal diet.Group C was treated by parenteral nutrition assisted therapy.Since the 1st day after surgery,patients in group C were intravenously injected with glucose,vita min and a mino acid mixed liquid calculated by 125.52 kJ/kg.8-10 d later,patients gradually transited to the normal diet.The incidence rates of anastomotic fistula,pulmonary infection and incision infection,wound healing time,total hospitalization time and initial exhaust time were observed and compared between the three groups.The changes of immune index [T lymphocytes and its subsets(CD3+,CD4+,CD8+)],inflammatory factors[C reactive protein(CRP),IL-6]and nutrition indexes[serum total protein(TP),albumin(ALB)]before surgery,on the 1st and 8th day after surgery were recorded.Results: ①There were significant differences in the incidence rates of postoperative anastomotic fistula and pulmonary infection between the three groups(P<0.05),and the incidence rates in group C were significantly higher than those in the other two groups(P<0.05).②There were significant differences in wound healing time,total hospitalization time and initial exhaust time between the three groups(P<0.05)and that of group C group was longer than that of the other two groups(P<0.05).③On the 1st day after surgery,the levels of immune indexes such as CD3+,CD4+,CD4+/CD8+and nutrition indexes such as TP and ALB in the three groups were significantly lower than those before surgery.CD8+levels and levels of inflammatory indexes such as CRP and IL-6 were significantly higher than those before surgery(P<0.05).However,there was no significant difference between the groups(P>0.05).On the 8th day after surgery,the nutrition indexes in the three groups were still significantly lower than those before surgery.However,those in group A and B were significantly higher than those in group C(P<0.05);the inflammatory factors were still significantly higher than those before surgery(P<0.05)but those in group A and B were significantly lower than those in group C(P<0.05).Among the three groups,there was no statistical significance in comparing the immune indexes with those in group A(P>0.05).The levels of CD3+,CD4+,CD4+/CD8+in the other two groups were lower than those before surgery while CD8+level was higher than that before surgery(P<0.05).Conclusion: To apply enteral nutrition assisted therapy in patients with esophageal cancer after surgery can effectively improve the prognosis.It has positive effects on shortening the healing process,improving the immune function and improving the nutritional status.
Enteral nutrition assisted therapy;Esophageal cancer;Anastomotic leakage;Prevention;Immune function;Healing process;Nutritional recovery
10.3969/j.issn.1000-484X.2017.07.025
靳智勇(1979年-),男,博士,副主任医师,主要从事胸部肿瘤临床方面的研究。
及指导教师:梁俊国(1973年-),男,博士,主任医师,主要从事胸外科肿瘤临床方面的研究。
R571
A
1000-484X(2017)07-1076-06
①内蒙古医科大学附属医院外科,呼和浩特010050。

