细胞外基底刚度调控宫颈癌细胞迁移的microRNA 的筛选
朴金兰 张幼怡 李子健 耿 力
(北京大学第三医院妇产科,北京 100083)
·基础研究·
细胞外基底刚度调控宫颈癌细胞迁移的microRNA 的筛选
朴金兰 张幼怡①李子健**②耿 力**
(北京大学第三医院妇产科,北京 100083)
目的 通过microRNA 芯片筛选不同基底刚度影响宫颈癌细胞迁移过程中的关键microRNA 的候选者。 方法用丙烯酰胺及双丙烯酰胺的不同比例配置基底刚度为1、20 kPa 的人工基底膜,在其上种植宫颈癌细胞系Siha,36 h后收取细胞提取总RNA,用microRNA芯片及qRT-PCR方法筛选2种基底刚度条件下的差异表达microRNA。 结果 在2种不同刚度条件下生长的宫颈癌细胞系Siha 共有173 个表达差异的microRNA,其中包括70 个表达上调的microRNA和103 个表达下调的microRNA。在宫颈癌细胞系Siha、Hela、Caski 中,检测与宫颈癌细胞迁移相关的miR-21、miR-125a、miR-75b、miR-150、miR-595、miR-218、miR-200b、miR-107、miR-183 等表达与microRNA芯片结果一致。 结论 不同基底刚度可引起宫颈癌细胞系Siha 的microRNA 表达谱不同,microRNA 在基底刚度调控宫颈癌细胞迁移的过程中可能具有重要作用。
宫颈癌; microRNA 芯片; 迁移
宫颈癌是世界范围内女性常见的恶性肿瘤,每年全球约有528 000个新发病例和266 000个死亡病例[1,2]。宫颈癌的发病特点要经历从正常宫颈上皮细胞、癌前病变和浸润癌阶段,临床数据表明宫颈癌前病变CIN(包括原位癌)的5年生存率可高达100%,Ⅰ期宫颈癌(浸润癌)患者则为70%~90%,而发展到Ⅳ期仅为20%左右,可见宫颈癌的间质浸润和远处转移是影响预后的关键因素。细胞的迁移贯穿于肿瘤的浸润和转移的全过程,该过程中发生癌基因的激活和抑癌基因的失活等一系列的改变[1~5]。microRNA是一种具有转录后调控作用的小分子RNA,可调控一些重要的癌基因及抑癌基因的表达。越来越多的研究显示,恶性肿瘤的发生、发展以及浸润转移、预后都与肿瘤细胞的周围环境因素有密切关系。细胞外基质刚度的变化可以影响细胞的重要功能,如迁移、生长、分化、增殖等[6~11]。2014 年Mouw 等[12]研究显示细胞外基质刚度的变化可通过microRNA 调节PTEN 的表达,促进乳腺癌的发生,提示在细胞外基质刚度影响肿瘤发生发展的过程中microRNA 具有重要的作用。利用microRNA 芯片技术可以高通量地对肿瘤发生中的关键microRNA进行筛选,本研究通过microRNA 芯片研究不同基底刚度作用下的宫颈癌鳞癌细胞系Siha的差异microRNA 表达谱,寻找不同基底刚度的力学信号影响宫颈癌细胞迁移过程中关键microRNA 的候选者。
1 材料与方法
1.1 主要实验材料
丙烯酰胺和双丙烯酰胺的不同比例配置基底刚度为1、20 kPa的人工基底膜,紫外灯照射2 h后,用于种植宫颈癌细胞系Siha,并以玻璃板作为对照。人工基底膜配方见表1。
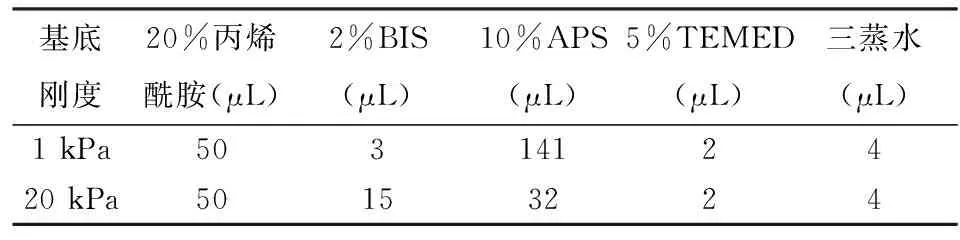
表1 人工基底膜1、20 kPa的配方
1.2 microRNA 芯片
选择1、20 kPa 2种基底刚度,将Siha 种植在人工基底膜上,未设平行孔,待生长36 h后,利用Trizol法提取Siha细胞的总RNA,并用Qiagen’s RNeasy Mini Kits 试剂盒逆转录为cDNA。送北京博奥有限公司进行昂飞microRNA 芯片分析。
1.3 qRT-PCR 方法
应用Qiagen 试剂盒将5 μL RNA 反转录合成cDNA,选取β-actin 作为内参,进行实时荧光定量PCR 检测,以验证基因芯片准确性。实时荧光定量PCR 扩增步骤参照SYBRGreen 实时定量PCR 试剂盒说明书(日本TaKaRa 公司)。采用2-ΔΔCt计算正常宫颈细胞及宫颈癌细胞之间目的mRNA 表达水平的差异倍数。
1.4 统计学处理
应用SPSS19.0统计软件, 2种刚度条件下microRNA表达比较采用配对样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 不同基底刚度作用下宫颈癌细胞Siha 差异表达的microRNA
在基底刚度为1、20 kPa 上生长的宫颈癌细胞系Siha 检测差异表达的microRNA结果显示,在2个不同刚度条件下生长的宫颈癌细胞系Siha 共有173 个表达差异的microRNA,其中包括70 个表达上调的microRNA 和103 个表达下调的microRNA (P<0.05, FRD<0.05),并对差异筛选结果做了聚类图(图1)。聚类图中颜色的深浅代表microRNA 在不同刚度宫颈癌细胞中表达水平的高低,从图1 可以看出1、20 kPa 的宫颈癌细胞系Siha的microRNA 表达谱有明显不同。

图1 1、20 kPa 2种基底刚度条件下宫颈癌细胞系Siha的差异表达的microRNA 聚类图
表2、3显示在基底刚度为1、20 kPa 2种条件下上调、下调倍数较高的差异表达的microRNA。上调倍数较高的microRNA 包括miR-21、miR-125a、miR-75b、miR-150、miR-595等,表达下调倍数较高的包括miR-218、miR-200b、miR-506b、miR-107、miR-183等。

表2 在基底刚度为1、20 kPa刚度条件下宫颈癌细胞系Siha上调倍数较高的差异表达的microRNA

表3 在基底刚度为1、20kPa基金刚度条件下宫颈癌细胞系Siha下调倍数较高的差异表达的microRNA
2.2 实时定量RT-PCR
从microRNA芯片检测结果,再根据文献报道筛选与宫颈癌细胞迁移密切相关且差异倍数较大的microRNA,miR-106b、miR-211、miR-218、miR-200b等,并利用荧光定量RT-PCR在宫颈癌细胞系Caski、Siha、Hela中进行验证,并以U6作为内参照并进行标准化。miR-218(P=0.000)、miR-200b(P=0.008)、miR-107(P=0.000)、miR-183(P=0.000)在20 kPa时明显比1 kPa低,miR-21(P=0.000)、miR-125a(P=0.000)、miR-75b(P=0.000)、miR-150(P=0.000)、miR-595(P=0.000)在20 kPa比1 kPa表达高(图2),除miR-506b在Siha细胞系不一致,其他与芯片结果一致,即不同刚度条件可引起宫颈癌细胞系microRNA表达不同。
3 讨论
我们的研究结果显示,通过microRNA 芯片分析发现基底刚度为1、20 kPa Siha 细胞共有173 个表达差异的microRNA,其中包括70 个表达上调的microRNA和103 个表达下调的microRNA (P<0.05, FRD<0.05),其中表达上调最明显的包括miR-21、miR-125a、miR-75b 等,表达下调最明显的包括miR-218、miR-200b等。人体结缔组织刚度平均值大致是1~10 kPa,人体实体瘤组织刚度平均值大致是20 kPa ,已有研究显示宫颈癌随着病变进展其组织刚度逐渐增加[13]。上述结果提示细胞外基质刚度的变化可引起宫颈癌细胞microRNA 表达谱的不同,在基底刚度影响宫颈癌的发生发展的过程中有众多的microRNA 参与其中。RT-PCR结果显示1、20 kPa 2种基底刚度条件下与宫颈癌细胞迁移关系密切,miR-21、miR-125a、miR-75b、miR-150、miR-595、miR-218、miR-200b、miR-107、miR-183 的表达有明显差异,miR-506b在20 kPa下比1 kPa高,与microRNA芯片结果不一致,需要进一步研究。miR-21 可通过靶向降解抑癌基因PTEN 促进宫颈癌进一步进展[14];miR-125a通过靶向降解ABL2 促进宫颈癌细胞的迁移及增殖功能[15];miR-27b 在宫颈癌细胞系中表达明显比正常宫颈细胞系高,并可通过靶向降解CDH11 促进上皮-间质转换及迁移[16];miR-150 可靶向降解FOXO4 促进宫颈癌细胞的迁移及侵袭[17];miR-519 也可通过靶向降解Smad7 促进宫颈癌细胞的迁移[18];同样miR-595 也通过靶向降解Wnt 信号通路抑制因子SOX 促进肿瘤细胞迁移[19]。而miR-218 表达降低与宫颈癌细胞迁移、侵袭密切相关,在有淋巴结转移宫颈癌组织中的表达明显比无淋巴结转移的宫颈癌组织中低[20];miR-200b 的高表达可靶向降解RhoE 抑制宫颈癌细胞的上皮-间质转换及迁移[21];同样miR-506b 通过靶向降解box Q1 蛋白抑制宫颈癌细胞的上皮间质转换及迁移[22];而且miR-107 通过靶向降解CCR5 抑制宫颈癌细胞的增殖及迁移[23];同时,miR-183 作为抑癌基因靶向降解MMP-9 抑制宫颈癌细胞的浸润与转移[24];miR-195 也被发现可通过靶向降解CCND2 及MYB 抑制宫颈癌细胞的迁移及浸润转移。上述结果提示microRNA在基底刚度调控宫颈癌细胞迁移的过程中发挥了重要作用[7~13]。继续探讨microRNA 在基底刚度影响宫颈癌的发生发展中的作用将有助于宫颈癌的早期诊断及判断预后,也将为寻找基底刚度的力学信号影响宫颈癌细胞迁移过程中的关键microRNA 提供新线索。

图2 A. 1、20 kPa 2种基底刚度的Caski、Siha、Hela 的miR-21 表达情况;B. 1、20 kPa 2种基底刚度的Caski、Siha、Hela 的miR-125a 表达情况;C. 1、20 kPa 2种基底刚度的Caski、Siha、Hela 的miR-75b 表达情况;D. 1、20 kPa 2种基底刚度的Caski、Siha、Hela 的miR-150 表达情况;E. 1、20 kPa 2种基底刚度的Caski、Siha、Hela 的miR-595 表达情况;F. 1、20 kPa 2种基底刚度的Caski、Siha、Hela 的miR-218 表达情况;G. 1、20 kPa 2种基底刚度的Caski、Siha、Hela 的miR-200b 表达情况;H. 1、20 kPa 2种基底刚度的Caski、Siha、Hela 的miR-506b 表达情况;I. 1、20 kPa 2种基底刚度的Caski、Siha、Hela 的miR-107 表达情况;J. 1、20 kPa 2种基底刚度的Caski、Siha、Hela 的miR-183 表达情况 *P<0.05, **P<0.01
1 李 雪,孔为民,韩 超,等.首都医科大学附属北京妇产医院1992 至2011 年间宫颈癌发病趋势分析.中华妇产科学杂志,2013,6(9):310-314.
2 李晓兰.宫颈癌发病年轻化趋势分析.中国妇幼保健,2007,22(23):3206-3207.
3 Torre LA, Bray F, Siegel RL, et al. Global cancer statistics,2012. CA Cancer J Clin,2015,65(2):87-108.
4 张燕茹.宫颈癌防治研究进展.中国肿瘤,2015,24(12):998-1002.
5 王临虹,邱 琇,郑睿敏,等.我国宫颈癌流行病学状况及防治策略的回顾与展望.中国妇幼卫生杂志,2010,1(3):146-149.
6 Lee JW, Choi CH, Choi JJ, et al. Altered microRNA expression in cervical carcinomas. Clin Cancer Res,2008,14(9):2535-2542.
7 Rao Q, Shen Q, Zhou H, et al. Aberrant microRNA expression in human cervical carcinomas. Med Oncol,2012,29(2):1242-1248.
8 Tang J, Li Y, Wang J, et al. Molecular mechanisms of microRNAs in regulating epithelial-mesenchymal transitions in human cancers. Cancer Lett,2016,371(2):301-313.
9 Neth P, Nazari-Jahantigh M, Schober A, et al. MicroRNAs in flow-dependent vascular remodelling. Cardiovascular Res,2013,99(2):294-303.
10 Yehya N, Yerrapureddy A, Tobias J, et al. MicroRNA modulate alveolar epithelial response to cyclic stretch. BMC Genomics,2012,13:154.
11 Valastyan S, Weinberg RA. Roles for microRNAs in the regulation of cell adhesion molecules. J Cell Sci,2011,124(Pt 7):999-1006.
12 Mouw JK, Yui Y, Damiano L, et al. Tissue mechanics modulate microRNA-dependent PTEN expression to regulate malignant progression. Nat Med,2014,20(4):360-367.
13 Nagelkerke A, Bussink J, Rowan AE, et al. The mechanical microenvironment in cancer: How physics affects tumors. Semin Cancer Biol,2015,35(12):62-70.
14 Peralta-Zaragoza O, Deas J, Meneses-Acosta A, et al. Relevance of miR-21 in regulation of tumor suppressor gene PTEN in human cervical cancer cells. BMC Cancer, 2016,16(1):1-16.
15 Qin X, Wan Y, Wang S, et al.MicroRNA-125a-5p modulates human cervical carcinoma proliferation and migration by targeting ABL2. Drug Des Devel Ther,2015,24(10):71-79.
16 Yao J, Deng B, Zheng L, et al. miR-27b is upregulated in cervical carcinogenesis and promotes cell growth and invasion by regulating CDH11 and epithelial-mesenchymal transition. Oncol Rep,2016,35(3):1645-1651.
17 Li J, Hu L, Tian Cet al. microRNA-150 promotes cervical cancer cell growth and survival by targeting FOXO4. BMC Mol Biol,2015,16(24):1-9.
18 Zhou JY, Zheng SR, Liu J, et al. MiR-519d facilitates the progression and metastasis of cervical cancer through direct targeting Smad7. Cancer Cell Int,2016,16(21):62-70.
19 Fornari F, Ferracin M, Trerè D, et al. Circulating microRNAs, miR-939, miR-595, miR-519d and miR-494, Identify Cirrhotic Patients with HCC. PLoS One,2015,10(10):1-15.
20 汤贝贝, 刘水逸, 魏礼清,等.miR-218表达水平与宫颈癌侵袭转移及预后的关系.广东医学,2015,36(14):2195-2197.
21 Cheng YX, Chen GT, Chen C. MicroRNA-200b inhibits epithelial-mesenchymal transition and migration of cervical cancer cells by directly targeting RhoE. Mol Med Rep,2016,13(4):3139-3146.
22 张靖宜,孙 燕.microRNA-506在不同肿瘤中作用的研究进展.中国肿瘤临床,2016,43(3):120-124.
23 Che LF, Shao SF, Wang LX, et al. Downregulation of CCR5 inhibits the proliferation and invasion of cervical cancer cells and is regulated by microRNA-107. Exp Ther Med,2016,11(2):503-509.
24 Fan D, Wang Y, Qi P, et al. MicroRNA-183 functions as the tumor suppressor via inhibiting cellular invasion and metastasis by targeting MMP-9 in cervical cancer. Gynecol Oncol,2016,141(1):166-174.
(修回日期:2016-09-01)
(责任编辑:李贺琼)
Screening of MicroRNAs Related with Cervical Cancer Cell Migration Regulated by Basement Membrane Stiffness
Piao Jinlan*, Zhang Youyi, Li Zijian, et al.*
Department of Obstetrics and Gynecology,Peking University Third Hospital, Beijing 100083, China
Li Zijian, E-mail:lzjgy1995@163.com; Geng Li, E-mail:gengli57@163.com
Objective To screen differently expressed microRNAs of cervical cancer cell line Siha in different basement membrane stiffness conditions. Methods The Siha cells were stimulated with different stiffness of basement membrane (1 kPa and 20 kPa). The total RNA was isolated after 36 h, and the microRNA chip analysis was proceeded to screen differently expressed microRNAs. Results We found 173 differently expressed microRNAs, including 70 microRNAs expressed higher and 103 microRNAs expressed lower in 20 and 1kPa. We also tested some microRNAs (miR-21, miR-125a, miR-75b, miR-150, miR-595, miR-218, miR-200b, miR-107, and miR-183) closely related with migration of cervical cancer cells using real-time PCR, and the results were also in accordance with the results of microRNA chip analysis. Conclusions Cervical cancer cells have differently expressed microRNA profiles in different stiffness of basement membranes. The microRNAs may play important roles in the regulation of cervical cancer cell migration by different basement membranes.
Cervical cancer; MicroRNA chip; Migration
国家自然科学基金(项目编号:81472429,81471893,81270157);973 课题计划(项目编号:2013CB933702,2014CBA02003)
A
1009-6604(2017)07-0653-05
10.3969/j.issn.1009-6604.2017.07.021
2016-04-05)
**通讯作者,E-mail:lzjgy1995@163.com(李子健),gengli57@163.com(耿力)
①心内科
②血管医学研究所

