血清25(OH)D和骨转换标志物与老年髋部骨折的相关性分析
范吉星 李宁 龚晓峰 伊辰 贺良*
1.清华大学临床医学院,北京 100083 2.北京积水潭医院创伤骨科,北京 100035
老年骨质疏松性髋部骨折是由于骨质疏松症引起的一种骨质疏松性骨折。随着老年人口的不断增多,老年髋部骨折的发生率越来越高,预计到2050年全球的髋部骨折患者将达到630万人[1]。由于老年人身体的特殊性,髋部骨折具有较高的致残率和致死率,给家庭和社会造成了极大的经济与生活负担。因此,如何有效地预防髋部骨折的发生至关重要。目前,骨密度是临床上常用的用于评价骨折风险的方法,但是骨密度并不能及时显示骨微结构的变化,有研究显示超过50%的脆性骨折患者在骨密度监测中并未发现明显的骨质疏松[2]。因此,寻找其他方法进行预测髋部骨折的发生至关重要。
骨转换标志物可以有效反映骨微结构的变化,提高检测的敏感性和特异性。骨转换标志物的增高提示骨代谢的增强,与骨质疏松性骨折的发生有一定的关系[3]。骨转换标志物可分为骨形成标志物和骨吸收标志物,其中骨形成标志物包括1型前胶原氨基末端前肽(N-terminal extension propeptide of type-I collagen,P1NP) 和骨钙素(osteocalcin,OC),骨吸收标志物包括1型胶原交联羧基末端肽(C-terminal telopeptide of type-I collagen,CTX)[4]。另外,相关研究表明血清25(OH)D缺乏与髋部骨折的发生密切相关[5],但是目前研究结果尚不一致。因此本文拟对血清25(OH)D和骨转换标志物与老年髋部骨折发生的关系进行探讨,期望找出相关规律,为临床工作提供一定的参考。
1 对象与方法
1.1 研究对象
回顾性分析2015年5月至2016年4月收入我院的老年髋部骨折患者,入组标准:(1)年龄≥65岁;(2)骨折至接受检查的时间≤1 w;(3)均为跌倒等低能量损伤导致骨折。排除标准:患有骨代谢性疾病、服用影响骨代谢的药物、病理性骨折以及临床资料不完整的患者。共330例老年髋部骨折患者满足上述条件,其中男性99人,女性231人;股骨颈骨折177人,股骨粗隆间骨折147人,股骨粗隆下骨折6人。对照组为同时期就诊于我院骨质疏松门诊的非骨折老年患者,年龄均需大于或等于65岁并排除患有骨代谢性疾病及服用影响骨代谢药物的患者,共331人纳入研究,其中男性59人,女性272人。
1.2 研究方法
收集患者的一般临床资料,包括性别、年龄、身高、体重、体质量指数(body mass index,BMI)、吸烟史以及饮酒史。所有受试者均在入院后次日清晨采集空腹血,血清经低温离心分离后置于-20°C保存。采用电化学发光免疫试剂盒(罗氏公司,COBAS)定量测定血清P1NP、OC、CTX、25(OH)D以及甲状旁腺激素(parathyroid hormone,PTH)水平,试剂盒设定的正常范围如下:13.10~58.50 ng/mL、15.00~46.00 ng/mL、0.10~1.008 ng/mL、20.00~40.00 ng/mL和15.00~65.00 pg/mL,批间变异系数及批内变异系数均小于10%。采用全自动化学分析仪(日立7600,东京,日本)对采集的样本检测血清钙、磷的水平。
1.3 统计学处理
连续性变量首先要进行正态性检验,对于符合正态分布的连续性变量采用独立样本t检验进行分析,不符合正态分布的连续性变量采用秩和检验进行分析。对于分类变量采用卡方检验进行分析。采用Pearson相关分析对血清25(OH)D与骨转换标志物之间的相关关系进行分析并以散点图表示相关趋势变化。运用多因素Logistic回归分析髋部骨折发生的独立危险因素。采用受试者工作特征(receiver operator characteristic,ROC)曲线评价各相关指标对预测髋部骨折发生的可能性大小。P<0.05认为差异具有统计学意义。所有统计学分析均采用SPSS 17.0软件进行分析。
2 结果
2.1 研究对象的一般情况
本研究中骨折组患者的平均年龄为(79.15±7.57)岁,明显大于对照组(70.85±4.68)岁(P<0.001),并且血清25(OH)D水平在骨折组明显低于对照组(12.95和23.45,P<0.001),见图1。骨折组的PTH水平明显大于对照组(48.91和41.99,P<0.001)。另外,骨折组的血清P1NP、OC和CTX水平明显高于对照组(分别为58.94和44.53,P<0.001;18.76和16.25,P=0.002;0.65和0.47,P<0.001)。其他因素如身高、体重、BMI、吸烟史、饮酒史以及血钙、血磷等在两组之间差异无统计学意义(P>0.05),见表1。
2.2 血清25(OH)D与骨转换标志物的关系
在总体人群中,运用Pearson相关分析显示血清25(OH)D与PTH呈明显负相关(r=-0.106,P=0.006)(图2 A);血清25(OH)D 水平越低,则血清CTX水平越高(r=-0.230,P<0.001)(图2B);随着血清25(OH)D 水平的增高,血清P1NP的水平逐渐降低(r=-0.155,P<0.001)(图2C);并且血清25(OH)D与OC呈明显负相关,差异具有统计学意义(r=-0.104,P=0.008)(图2D)。

图1 骨折组和对照组中血清25(OH)D的平均水平Fig.1 The mean levels of serum 25(OH)D in fracture group and control group
2.3 以骨折为因变量的二分类变量多因素Logistic回归分析
以骨折为因变量,以年龄、性别、血清P1NP、OC、CTX、25(OH)D、PTH以及血钙、血磷为自变量,经多因素Logistic回归分析显示血清年龄、性别、血清25(OH)D、CTX及PTH是老年髋部骨折发生的独立危险因素(OR值分别为1.219、2.176、0.902、4.355和1.019),并且差异具有统计学意义(P<0.05)。而骨形成标志物如血清P1NP和OC与老年髋部骨折的发生无关(OR值分别为1.000和1.021,P值分别为0.942和0.122),见表2。
2.4 受试者工作特征曲线分析结果
运用受试者工作特征曲线评估各个因素对髋部骨折预测的准确性大小,并计算各个变量的曲线下面积(AUC)值和Cut-off值(表1)。年龄的AUC值为0.819,具有较好的预测性,见图3 A。血清25(OH)D的AUC值为0.802,也具有较好的预测性,见图3B。血清25(OH)D的Cut-off值为12.41 ng/mL,其敏感性和特异性分别为86.7%和59.9%。血清CTX和PTH的AUC值分别为0.666和0.578,具有相对较差的预测性,见图3C和图3D。

表1 骨折组与对照组的一般情况及受试者工作特征曲线分析Table 1 Univariate analysis and ROC evaluation of baseline characteristics between the fracture and control groups
注:AUC:曲线下面积;BMI:体质量指数;CTX:1型胶原交联羧基末端肽;P1NP:1型前胶原氨基末端前肽;OC:骨钙素;PTH:甲状旁腺激素。

图2 血清25(OH)D与骨转换标志物的相关关系。A:血清25(OH)D与PTH的相关性分析;B:血清25(OH)D与CTX的相关性分析;C:血清25(OH)D与P1NP的相关性分析;D:血清25(OH)D与OC的相关性分析Fig.2 The correlations between serum 25(OH)D and bone turnover markers. A: The correlation between serum 25(OH)D and PTH; B: The correlation between serum 25(OH)D and CTX; C:The correlation between serum 25(OH)D and P1NP; D:The correlation between serum 25(OH)D and OC
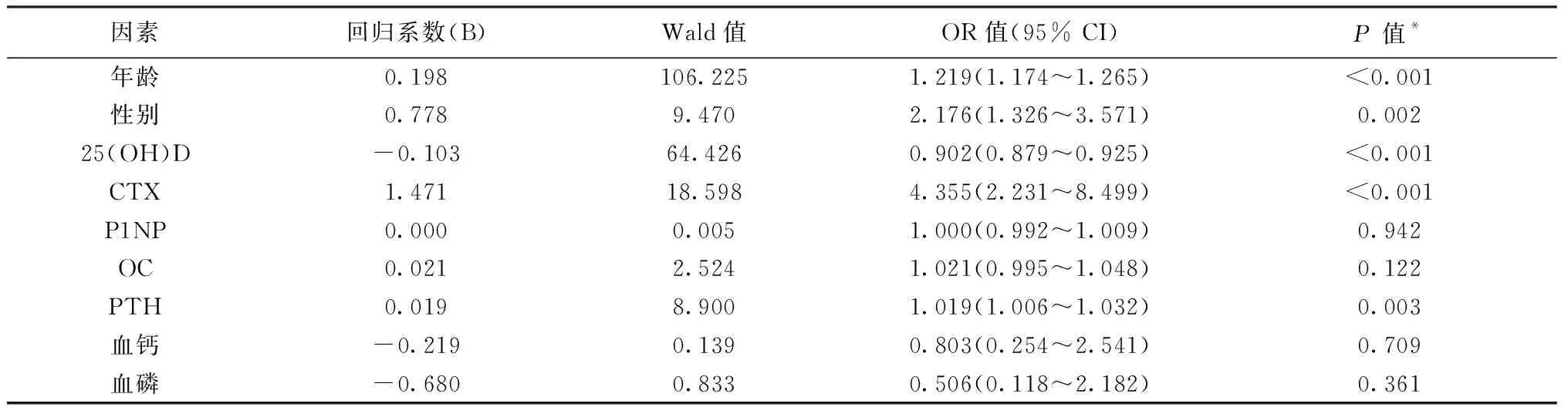
因素回归系数(B)Wald值OR值(95% CI)P 值*年龄0.198106.2251.219(1.174~1.265)<0.001性别0.7789.4702.176(1.326~3.571)0.00225(OH)D-0.10364.4260.902(0.879~0.925)<0.001CTX1.47118.5984.355(2.231~8.499)<0.001P1NP0.0000.0051.000(0.992~1.009)0.942OC0.0212.5241.021(0.995~1.048)0.122PTH0.0198.9001.019(1.006~1.032)0.003血钙-0.2190.1390.803(0.254~2.541)0.709血磷 -0.6800.8330.506(0.118~2.182)0.361
注:CTX:1型胶原交联羧基末端肽; P1NP:1型前胶原氨基末端前肽;OC:骨钙素;PTH:甲状旁腺激素。

图3 主要参数的受试者工作曲线分析。A:年龄的ROC分析;B:血清25(OH)D的ROC分析;C:血清CTX的ROC分析;D:血清PTH的ROC分析Fig.3 The receiver operating curve (ROC) analysis for key parameters. A: The ROC analysis for age; B: The ROC analysis for serum 25(OH)D; C: The ROC analysis for serum CTX; D: The ROC analysis for serum PTH
3 讨论
随着我国老龄人口的增多,老年髋部骨折的发生率逐渐增加,逐渐成为影响我国人民健康和生命的突出问题。因此,如何准确地预测老年髋部骨折的发生至关重要。既往研究表明骨密度与老年髋部骨折的发生相关,但是骨密度在骨质疏松达到一定程度后才能显示出变化[6]。Schuit等[7]发现非椎体骨折的患者只有44%的女性和21%的男性达到骨质疏松症的诊断标准。因此,除了骨密度以外,一定有其他因素影响老年髋部骨折的发生。有研究表明骨转换标志物可以反映骨重塑过程中微结构的变化,与髋部骨折的发生具有一定的关系[3]。本研究针对老年髋部骨折患者探求能够有效预测髋部骨折风险的骨转换标志物指标,以便及时发现脆性髋部骨折高危人群并及时进行干预。
既往的研究表明骨转换标志物与老年脆性骨折的发生具有一定的相关性[4,8],但是究竟是骨形成标志物还是骨吸收标志物在髋部骨折中起主要作用尚不明确。Ivaska等[9]前瞻性随访研究了1 040位老年女性,研究结果发现在老年女性中随着骨吸收标志物的升高,发生脆性骨折的风险随之升高。另一项研究表明骨形成标志物水平的增加比骨吸收标志物更能增大髋部骨折的危险性[10]。Dai等[8]的研究则表明骨形成标志物和骨吸收标志物水平的增加都会增加髋部骨折的风险。本文的研究对象针对老年髋部骨折患者,研究结果发现骨吸收标志物是老年髋部骨折的独立危险因素,而骨形成标志物不是老年髋部骨折的独立危险因素。有研究表明随着年龄的增大,骨吸收增加较快而骨形成则相对稳定[11]。本研究中的老年人年龄较高,平均年龄大于70岁,这可能是导致骨吸收标志物是髋部骨折的危险因素的原因。因此,在未来的研究中需要针对髋部骨折患者进行年龄分层研究,探讨老年髋部骨折患者各个年龄段的骨转换标志物的变化。
许多研究表明维生素D缺乏会导致老年髋部骨折风险的增加[5,12]。维生素D缺乏时会减少肠道对钙的吸收和肾小管对钙的重吸收,造成血钙浓度降低,反射性促进甲状旁腺激素的分泌增加,甲状旁腺激素可以促进破骨细胞的生成,破骨细胞数量增多,破骨细胞可以释放碱性磷酸酶和蛋白水解酶,使骨小管壁上的钙盐和骨基质加速溶解,大量钙盐由骨组织转运入血和细胞外液,从而使血钙浓度升高,维持血钙在正常范围,此过程会造成骨转换加快、骨微细结构的破坏,增加骨折的风险[13]。在本研究中,骨折组患者的血清25(OH)D平均水平为12.95 ng/mL,明显低于正常范围。血清25(OH)D的AUC值为0.802,提示其对老年髋部骨折具有较好的预测价值。经ROC曲线分析显示血清25(OH)D的Cut-off值为12.41 ng/mL,提示当患者的血清25(OH)D小于12.41 ng/mL时应特别警惕骨折的发生。另外,经Pearson相关分析显示,血清25(OH)D与PTH、CTX、P1NP和OC具有明显负相关,血清25(OH)D的变化会影响骨转换标志物的表达,但是目前对此研究结果尚不一致。一些研究认为血清25(OH)D的变化不会影响骨转换标志物的水平[14]。另外,洪伟等[15]的研究表明轻度的维生素D缺乏对骨转换影响不大;只有当25(OH)D严重缺乏时,骨转换才发生变化。因此,对于血清25(OH)D与骨转换的关系仍需进一步的研究。
本研究中,年龄是老年髋部骨折发生的独立危险因素,并且其AUC值为0.819,具有较好的预测价值。随着年龄的增长,骨密度的分布会随之发生变化[16]。有研究显示,65岁之前股骨颈骨密度下降的速率为0.64%,而65岁之后是0.36%,并且随着年龄的增长股骨近端的骨皮质会变薄,骨髓腔增大,影响骨结构的变化[17]。因此,对于高龄患者应特别注意预防髋部骨折的发生。本研究中并未将骨密度纳入其中,这是其不足之一,需要进一步研究。
综上所述,本研究中高龄、维生素D缺乏以及血清CTX水平升高是老年髋部骨折发生的危险因素。另外,血清25(OH)D与血清骨转换标志物明显相关。因此,在预防骨质疏松时既要注意维生素D的补充,也要关注骨转换标志物的变化,为临床决策提供更好的参考,预防髋部骨折的发生。

