多囊卵巢综合征合并卵巢储备功能低下病人的内分泌特征
金 婧 阮祥燕,2* 华 琳 田玄玄 李杨璐 王利娟 赵 越 Alfred O. Mueck,2
(1.首都医科大学附属北京妇产医院内分泌科,北京 100026;2.德国图宾根大学妇女医院妇女保健科,图宾根 D-72076,德国;3.首都医科大学生物信息学教研室,北京 100069)
多囊卵巢综合征合并卵巢储备功能低下病人的内分泌特征
金 婧1阮祥燕1,2*华 琳3田玄玄1李杨璐1王利娟1赵 越1Alfred O. Mueck1,2
(1.首都医科大学附属北京妇产医院内分泌科,北京 100026;2.德国图宾根大学妇女医院妇女保健科,图宾根 D-72076,德国;3.首都医科大学生物信息学教研室,北京 100069)
目的 了解中国多囊卵巢综合征(polycystic ovary syndrome,PCOS)合并卵巢储备功能低下(diminished ovarian reserve,DOR)病人的发生率及内分泌特征。方法 选取2015年1月至2017年1月就诊的多囊卵巢综合征病人338例及同期就诊的单纯DOR病人68例,记录所有研究对象的年龄、月经情况,测量其身高、体质量、腰围、臀围,测定基础血清卵泡刺激素(follicle stimulation hormone,FSH)、黄体生成素(luteinizing hormone,LH)、雌二醇(estradiol,E2)、睾酮(testosterone,T)、抗苗勒管激素(anti-Müllerian hormone,AMH)及基础窦卵泡数(baseline antral follicle count,bAFC)。对PCOS合并DOR病人、单纯PCOS及单纯DOR病人的各指标进行方差分析。结果 1)PCOS合并DOR的病人发生率为16.9%。2)在PCOS合并DOR病人中,基础FSH>10IU/L且<40IU/L、FSH/LH>3、基础E2>80pg/mL、bAFC≤4的发生率分别为38.6%、35.1%、35.1%及36.8%。3)PCOS合并DOR病人基础FSH及睾酮浓度与单纯PCOS及单纯DOR病人之间的差异均具有统计学意义(P<0.05),PCOS合并DOR病人基础E2、FSH/LH、AMH与单纯PCOS之间的差异有统计学意义(P<0.05),而与单纯DOR之间的差异无统计学意义(P>0.05)。4)在单纯PCOS组,AMH与睾酮呈正相关(P<0.01)。在PCOS合并DOR组,AMH与FSH呈负相关,与LH呈正相关(P<0.01)。在单纯DOR组,AMH与年龄、FSH、LH、FSH/LH均呈负相关(P<0.01)。结论 PCOS合并DOR病人的内分泌特征既不同于单纯PCOS组,也不同于单纯DOR病人。
多囊卵巢综合征;卵巢储备功能低下;性激素;抗苗勒管激素
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是育龄妇女最常见的内分泌疾病之一,在19~45岁的中国妇女中患病率约为5.6%[1]。其特征是卵巢中有大量的早期卵泡生长,但不发生优势卵泡的选择,即卵泡发育停止。PCOS是无排卵性不孕的主要原因[2]。有生育要求的PCOS不孕病人治疗的目的是促使无排卵的病人排卵并获得正常妊娠。而促排卵治疗能否成功在很大程度上取决于卵巢储备功能。
卵巢储备功能是指卵巢皮质区卵泡生长发育形成可受精卵母细胞的能力,包括卵巢内存留卵泡的数量和质量。若卵巢内存留的可募集卵泡数量减少、卵母细胞质量下降,导致生育能力降低或出现过早绝经的倾向,称为卵巢储备功能低下(diminished ovarian reserve,DOR)[3]。卵巢储备功能低下的病人生育结局不良,因此成为生殖医学的一个重要难题。尽管DOR的概念得到了公认,但定义仍存在争议[4]。在临床工作中对DOR的诊断标准常包括:40岁以下的女性,基础卵泡刺激素(follicle stimulation hormone,FSH)>10IU/L或FSH/黄体生成素(luteinizing hormone,LH)>3或基础雌二醇(estradiol,E2)>80pg/mL或基础窦卵泡数(baseline antral follicle count,bAFC)≤4[4]。目前,中国关于DOR的诊断标准尚未完全统一。因此,探索新的DOR预测和诊断指标显得尤为重要。
抗苗勒管激素(anti-Müllerian hormone,AMH)属于转化生长因子β(transforming growth factor,TGF-β)超家族成员,是由560个氨基酸残基组成的糖蛋白。在生育期女性主要由窦前和窦状卵泡颗粒细胞分泌,参与卵泡募集,调节卵泡生长。AMH既反映了卵泡的数量,还反映了卵泡的质量[5]。目前,血清AMH蛋白检测已经作为评价卵巢储备功能及卵巢反应性的指标,被认为是卵巢窦卵泡数的准确标志物,是唯一从初级卵泡至窦状卵泡期中颗粒细胞产生的激素,是预测卵巢储备功能和卵巢反应性的可靠指标[6]。然而,在中国的临床工作中,AMH尚未得到广泛使用,AMH用来预测卵巢储备功能低下的临界值尚未统一。
研究[7]表明:多囊卵巢综合征病人相比正常人群而言,其基础LH浓度及LH/FSH浓度更高,而基础FSH浓度相对正常或较低。此外,PCOS病人与正常排卵的女性相比,血AMH浓度显著升高[8]。然而,在临床工作中,笔者发现一部分PCOS病人合并基础FSH浓度升高、FSH/LH浓度升高、基础E2浓度升高或AMH浓度降低。这与先前的研究[1]结果似乎有点矛盾。而既往的研究主要集中在对单纯PCOS、单纯DOR及正常女性的激素浓度及相关指标进行比较。目前,尚未发现对中国PCOS合并DOR这一特殊群体进行的报道。本研究则旨在了解中国PCOS中DOR的发生率以及这一特殊群体的内分泌特征,从而为这一群体的临床治疗提供一定的依据。
1 对象与方法
1.1 研究对象
选取2015年1月至2017年1月在首都医科大学附属北京妇产医院内分泌科就诊的PCOS病人338例,年龄20~39(28.50±4.34)岁,诊断标准按2003年鹿特丹会议制定的诊断标准[9]:1)稀发排卵或无排卵;2)高雄激素的临床表现或高雄激素血症;3)卵巢多囊改变:超声提示一侧或双侧卵巢直径2~9 mm的卵泡≥12个,和(或)卵巢体积≥10 mL;4)3项中符合2项并排除高泌乳素血症及产生高雄激素的其他内分泌疾病,如库欣综合征、先天性肾上腺皮质增生症、卵巢或肾上腺肿瘤等。并选取同期在医院内分泌科诊断为单纯卵巢储备功能低下的病人68例,年龄20~39(33.93±5.89)岁。卵巢储备功能低下组诊断标准为:基础FSH>10 IU/L且<40 IU/L,或FSH/LH>3,或基础E2>80 pg/mL,或bAFC≤4,符合上述标准之一者考虑卵巢储备功能低下。多囊卵巢综合征病人中同时满足卵巢储备功能低下标准的病人则为多囊卵巢综合征合并卵巢储备功能低下组,共57例,年龄20~39(29.72±5.26)岁,余为单纯多囊卵巢综合征病人,共281例,年龄20~39(28.40±4.16)岁。所有研究对象均无严重肝、肾疾病,不合并高泌乳素血症或甲状腺、肾上腺等内分泌相关疾病,进入本研究前3个月内未使用过影响内分泌的药物。本研究经首都医科大学附属北京妇产医院伦理委员会批准。所有研究者均自愿签署知情同意书。
1.2 观察指标
1)一般指标:包括研究对象的年龄、月经情况,测量身高、体质量、腰围和臀围。测量身高和体质量时受检者脱鞋、帽,限穿单衣单裤,两手自然下垂。测量腰围和臀围,受试者取站位,双脚分开25~30cm,使体质量均匀分配,在平稳呼吸时,在髂前上嵴和第12肋下缘连线的中点水平测量腰围(waist circumference, WC);臀围(hip circumference, HC)在臀部(骨盆)最突出部测量周径。根据身高、体质量计算体质量指数(body mass index,BMI)=体质量(kg)/身高2(m2),根据腰围、臀围计算腰臀比(waist hip ratio,WHR)=腰围(cm)/臀围(cm)。
2)内分泌指标的测定:月经规律者,基础激素浓度及AMH浓度检测取月经第2~3天空腹静脉血;月经不规律及闭经者取空腹随机血。测定受试者血FSH、LH、E2、睾酮(testosterone,T)、AMH。
3)B超检查:月经周期第5天,使用经阴道超声监测直径2~9 mm的窦卵泡数,对于无性生活者采用经直肠超声检查。卵巢数目测量包括横面和纵面扫描。
1.3 统计学方法

2 结果
2.1 PCOS合并DOR发生率
PCOS病人共338例,其中合并DOR的病人为57例,发生率为16.9%。
2.2 PCOS合并DOR者各指标比率
57例PCOS合并DOR的病人中,评价DOR的各种指标,基础FSH>10IU/L且<40IU/L、FSH/LH>3、基础E2>80pg/mL、bAFC≤4的发生率分别为38.6%、35.1%、35.1%及36.8%,详见表1。

表1 PCOS合并DOR的病人中卵巢储备功能低下的各种指标所占比例
PCOS:polycystic ovary syndrome; DOR:diminished ovarian reserve; FSH:follicle stimulating hormone;LH:luteinizing hormone;E2:estradiol; bAFC:baseline antral follicle count.
2.3 3组病人各指标比较
PCOS合并DOR病人基础FSH及睾酮浓度与单纯PCOS及单纯DOR之间的差异均具有统计学意义(P<0.05),其基础E2、FSH/LH、AMH与单纯PCOS间的差异均具有统计学意义(P<0.05),而与单纯DOR间的差异没有统计学意义,详见表2。
2.4 3组病人AMH与年龄及性激素Pearson相关分析
在单纯PCOS组,AMH仅与睾酮呈正相关(P<0.01);在PCOS合并DOR组,AMH与FSH呈负相关,与LH呈正相关(P<0.01);而在单纯DOR组,AMH与年龄、FSH、LH、FSH/LH均呈负相关(P<0.01)。详见表3。
3 讨论
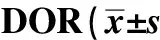
表2 PCOS合并DOR的病人与单纯PCOS及单纯DOR病人之间各指标的比较

表3 各组AMH与年龄及性激素的相关关系
PCOS合并DOR病人的发生现状及其内分泌特征:本研究以基础FSH>10IU/L且<40IU/L,或FSH/LH>3,或基础E2>80pg/ mL,或bAFC≤4作为DOR的诊断标准。既往研究[7]显示:与正常人群相比,PCOS病人基础LH浓度及LH/FSH水平更高,而基础FSH浓度相对正常或较低。笔者研究团队近期的一项研究[10]显示:中国大多数PCOS病人LH及LH/FSH都高于对照组。有研究[11]显示:PCOS病人无排卵的部分原因为相对低下的FSH浓度或FSH抵抗。然而,临床上笔者会遇到一些PCOS病人合并较高的基础FSH浓度,或较高的FSH/LH比值,或较高的基础E2浓度,而这些内分泌的表现往往提示卵巢储备功能低下。这种现象似乎有些矛盾。这部分人群是否与单纯的PCOS病人或单纯的DOR病人有所差别?目前尚未见这一特殊人群的相关报道。本研究显示:PCOS病人DOR的发生率为16.9%,高于体外受精-胚胎移植病人中DOR的发生率12%[12]。本研究还对这一部分人群各种评价DOR的指标所占比例进行了统计,发现各种指标的异常所占比例相近。本研究还显示:PCOS合并DOR病人基础FSH及睾酮浓度与单纯PCOS及单纯DOR之间的差别均具有统计学意义,而前者基础E2、FSH/LH与单纯PCOS之间的差别具有统计学意义,而与单纯DOR之间的差别没有统计学意义。这可能在一定程度上说明:PCOS合并DOR的病人在内分泌特征上与单纯PCOS及单纯DOR均存在一定的差异,其与单纯DOR病人在内分泌上的差异相对单纯PCOS更小一些。
PCOS合并DOR病人与单纯PCOS及单纯DOR病人之间AMH的比较:AMH反映了卵巢卵泡池的数量和质量[5],与月经周期无关[13],是评估卵巢储备功能的可靠指标[14]。近期一项前瞻性观察研究[15]表明,AMH≤1 μg/L时,预示着卵巢反应不良,妊娠结局较差。而早期的另一研究[16]显示,在AMH≥1.26 μg/L时,对卵巢高反应的灵敏度达到98%。本团队先前的研究[17]表明:中国PCOS病人AMH的浓度是正常对照组的2~3倍。PCOS病人血AMH浓度较正常组及DOR组均明显升高[18]。研究显示:PCOS病人血AMH的浓度升高不仅与过多的窦卵泡数有关[19],还与单个窦卵泡产生的AMH浓度更高有关[20]。用血AMH浓度来诊断PCOS的临界值从2.8 ng/mL到8.4 ng/mL不等[21-22]。本研究显示:PCOS合并DOR病人、单纯DOR病人的AMH浓度均与单纯PCOS病人的AMH浓度差异具有统计学意义,而PCOS合DOR病人与单纯DOR病人之间AMH浓度差异无统计学意义,说明PCOS合并DOR病人的卵巢储备功能与单纯DOR病人具有相似性。笔者先前的研究[23]通过ROC曲线计算出了AMH预测PCOS合并DOR的临界值为2.53 ng/mL,灵敏度为92.5%,特异度为73.7%,高于既往研究报道的AMH诊断单纯DOR的临界值0.5~1.1 ng/mL[4]。由此可见,PCOS合并DOR的病人具有其特有的内分泌特征。这部分人群对促排卵药物的反应如何,是否和单纯PCOS和单纯DOR有差异,将有待于临床的进一步验证。
PCOS合并DOR病人与单纯PCOS及单纯DOR病人各组AMH与年龄及性激素的相关关系:既往研究表明:PCOS病人血AMH浓度升高不仅因为窦卵泡数多,还因为每个窦卵泡产生的AMH更多,而后者可能与高雄激素、高LH或高胰岛素有关[24-25]。本研究显示:单纯PCOS组,AMH与睾酮呈正相关;PCOS合并DOR组,AMH与LH呈正相关。笔者团队先前研究[17,23]以所有PCOS为研究对象,结果显示病人年龄与AMH浓度呈负相关,而将单纯PCOS与PCOS合并DOR分开后,年龄与AMH反而没有明显的负相关,而单纯DOR组,年龄与AMH呈明显的负相关关系。此外,本研究显示:PCOS合并DOR组及单纯DOR组,AMH均与FSH呈负相关。因此,我们是否可以设想,在不同内分泌疾病的病人中,AMH的相关因素是不完全一致的。当然,本研究的样本含量有限,结论的准确性尚需进一步的研究证实。
综上,笔者团队发现了PCOS病人中DOR的发生率,并发现这一群体的内分泌特征既不同于单纯PCOS病人,也不完全同于单纯DOR病人,说明这是一个特殊的妇科内分泌异常的群体。但这个群体对促排卵药物的反应性是否也和单纯PCOS病人以及单纯DOR病人存在差别,尚需临床工作的进一步验证。此外,本研究人群来源于一个中心,结论尚不能完全外推。我们需要多中心、大样本的研究来进一步验证上述结果,并对这部分人群的临床治疗进行前瞻性研究,从而使PCOS合并DOR的病人这一特殊群体的临床治疗更加有效。
[1] Li R, Zhang Q, Yang D, et al. Prevalence of polycystic ovary syndrome in women in China: a large community-based study[J]. Hum Reprod,2013,28(9):2562-2569.
[2] Norman R J, Dewailly D, Legro R S, et al. Polycystic ovary syndrome[J]. Lancet,2007,370(9588):685-697.
[3] 沈杨,任慕兰.卵巢储备功能的影响因素[J].实用妇产科杂志,2013,29(9):643-645.
[4] Cohen J,Chabbert-Buffet N, Darai E. Diminished ovarian reserve, premature ovarian failure, poor ovarian responder—a plea for universal definitions[J]. J Assist Reprod Genet,2015,32(12):1709-1712.
[5] La Marca A, Broekmans F J, Volpe A, et al. Anti-Müllerian hormone (AMH): what do we still need to know? [J].Hum Reprod,2009,24(9):2264-2275.
[6] Hansen K R,Hodnett G M,Knowlton N,et al.Correlation of ovarian reserve tests with histologically determined primordial follicle number[J].Fertil Steril,2011,95(1):170-175.
[7] Chun S. Serum luteinizing hormone level and luteinizing hormone/follicle-stimulating hormone ratio but not serum anti-Müllerian hormone level is related to ovarian volume in Korean women with polycystic ovary syndrome[J]. Clin Exp Reprod Med,2014,41(2):86-91.
[8] Li L, Chen X, Mo Y, et al. Elevated serum anti-Müllerian hormone in adolescent and young adult Chinese patients with polycystic ovary syndrome[J]. Wien Klin Wochenschr,2010,122(17-18):519-524.
[9] Rotterdam ESHRE/ASRM-sponsored PCOS Consensus Workshop Group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome (PCOS) [J]. Hum Reprod,2004,19(1):41-47.
[10]Zhao Y, RuanX, Mueck A O. Clinical and laboratory indicators of polycystic ovary syndrome in Chinese Han nationality with different Rotterdam criteria-based Phenotypes[J].Gynecol Endocrinol,2016,32(2):151-156.
[11]Piltonen T, Koivunen R, Perheentupa A, et al. Ovarian age-related responsiveness to human chorionic gonadotropin in women with polycystic ovary syndrome[J]. J ClinEndocrinol Metab,2004,89(8):3769-3775.
[12]Maheshwari A, Fowler P, Bhattacharya S. Assessment of ovarian reserve-should we perform tests of ovarian reserve routinely? [J].Hum Reprod,2006,21(11):2729-2735.
[13]van Disseldorp J, Lambalk C B, Kwee J, et al. Comparison of inter-and intra-cycle variability of anti-Müllerian hormone and antral follicle counts[J].Hum Reprod,2010,25(1):221-227.
[14]Kwee J, Schats R, McDonnell J, et al. Evaluation of anti-Müllerian hormone as a test for the prediction of ovarian reserve[J]. Fertil Steril,2008,90(3):737-743.
[15]胡琳莉, 孙莹璞.卵巢储备功能与卵巢反应性评估[J].中国实用妇科与产科杂志,2015,31(1):18-21.
[16]Ficicioglu C, Cenksoy P O, Yildirim G, et al. Which cut-off value of serum anti-Mullerian hormone level can predict poor ovarian reserve, poor ovarian response to stimulation and in vitro fertilization success-A prospective data analysis[J].Gynecol Endocrinol,2014,30(5):372-376.
[17]Tian X, Ruan X, Mueck A O,et al. Anti-Müllerian hormone levels in women with polycystic ovarian syndrome compared with normal women of reproductive age in China[J]. Gynecol Endocrinol,2014,30(2):126-129.
[18]李莹,杨晓葵. 抗苗勒管激素和抑制素B预测卵巢储备功能的临床研究[J]. 实用妇产科杂志,2014,30(1):26-28.
[19]Tian X, Ruan X, Mueck A O, et al. Serum anti-Müllerian hormone and insulin resistance in the main phenotypes of non-obese polycystic ovarian syndrome women in China[J]. Gynecol Endocrinol,2014,30(11):836-839.
[20]Bhide P, Homburg R. Anti-Müllerian hormone and polycystic ovary syndrome[J]. Best Pract Res Clin Obstet Gynaecol,2016,37:38-45.
[21]Piouka A, Farmakiotis D, Katsikis I, et al. Anti-Mullerian hormone levels reflect severity of PCOS but are negatively influenced by obesity: relationship with increased luteinizing hormone levels[J]. Am J Physiol Endocrinol Metab,2009, 296(2):E238-243.
[22]Catteau-Jonard S, Bancquart J, Poncelet E, et al. Polycystic ovaries at ultrasound: normal variant or silent polycystic ovary syndrome? [J]. Ultrasound Obstet Gynecol,2012,40(2):223-229.
[23]Jin J,Ruan X,Hua L,et al.Prevalence of diminished ovarian reserve in Chinese women with polycystic ovary syndrome and sensitive diagnostic parameters[J].Gynecol Endocrinol,2017:1-4.
[24]Bhide P, Dilgil M, Gudi A, et al. Each small antral follicle in ovaries of women with polycystic ovary syndrome produces more anti-müllerian hormone than its counterpart in a normal ovary: an observational cross-sectional study[J]. Fertil Steril,2015,103(2):537-541.
[25]Nardo L G, Yates A P, Roberts S A, et al. The relationships between AMH, androgens, insulin resistance and basal ovarian status in non-obese subfertile women with and without polycystic ovarian syndrome[J]. Hum Reprod, 2009,24(11):2917-2923.
编辑 陈瑞芳
Endocrine characteristics of diminished ovarian reserve in Chinese women with polycystic ovary syndrome
Jin Jing1,Ruan Xiangyan1,2*, Hua Lin3, Tian Xuanxuan1, Li Yanglu1, Wang Lijuan1, Zhao Yue1, Alfred O. Mueck1,2
(1.DepartmentofGynecologicalEndocrinology,BeijingObstetricsandGynecologyHospital,CapitalMedicalUniversity,Beijing100026,China; 2.DepartmentofWomen’sHealth,UniversityWomen’sHospitalofTuebingen,TuebingenD-72076,Germany;3.DepartmentofBioinformatics,CapitalMedicalUniversity,Beijing100069,China)
Objective To assess the prevalence of diminished ovarian reserve (DOR) in patients with polycystic ovary syndrome (PCOS) in China, and to investigate the endocrine characteristics of these patients.Methods Totally 338 PCOS women and 68 simple DOR women, who came to Department of Gynecological Endocrinology in Beijing Obstetrics and Gynecology Hospital between January 2015 and January 2017 were recruited.Age and menstruation of these patients were recorded. Body height, body weight, waist circumference, hip circumference, basal follicle stimulating hormone (FSH), luteinizing hormone (LH), estradiol (E2), testosterone(T),anti-Müllerian hormone (AMH) and baseline antral follicle count (bAFC) of these patients were measured. The differences of indices between PCOS with DOR,simple PCOS and simple DOR were analyzed with analysis of variance. Results (1) The prevalence of DOR in our Chinese PCOS patients was 16.9%.(2)In PCOS with DOR patients, the prevalence of basal FSH value>10IU/L, FSH/LH ratio>3,basal estradiol (E2)>80 pg/mL and baseline antral follicle count (bAFC) fewer than four were 38.6%,35.1%,35.1% and 36.8%,respectively. The basal FSH and testosterone in PCOS with DOR patients were different from both simple PCOS and simple DOR patients(P<0.05). The basal estradiol, FSH/LH ratio,AMH in PCOS with DOR patients had significant differences from simple PCOS patients(P<0.05),while had no difference from simple DOR patients. (4)In simple PCOS patients,AMH had a positive correlation with testosterone(P<0.01).In PCOS with DOR patients, AMH had a negative correlation with FSH(P<0.01),while had a positive correlation with LH(P<0.01).In simple DOR patients, AMH had a negative correlation with age,FSH,LH and FSH/LH ratio(P<0.01).Conclusion The endocrine characteristics of PCOS with DOR patients are different from simple PCOS patients as well as simple DOR patients.
polycystic ovary syndrome; diminished ovarian reserve; sex hormones; anti-Müllerian hormone
北京市属医院科研培育计划(PX2017053),北京妇产医院中青年学科骨干培养专项(fcyy201427),首都临床特色应用研究与成果推广(Z161100000516143),北京市医院管理局临床技术创新项目(扬帆项目XMLX201710)。This study was supported by Beijing Municipal Administration of Hospitals Incubating Program(PX2017053); Beijing Obstetrics and Gynecology Hospital;Capital Medical University(fcyy201427); Beijing Municipal Science and Technology Commission(Z161100000516143); Beijing Municipal Administration of Hospitals Clinical medicine Development of special funding support(XMLX201710).
时间:2017-07-16 17∶24 网络出版地址:http://kns.cnki.net/kcms/detail/11.3662.r.20170716.1724.034.html
10.3969/j.issn.1006-7795.2017.04.006]
R711.75
2017-06-05)
*Corresponding author, E-mail:ruanxiangyan@163.com

