补骨脂抑制肝组织NF—κB活性治疗幼龄小鼠脂肪肝的机制研究
周俪姗+鄢素琪+熊小丽+黄娟+张领领+汤建桥

[摘要] 探讨补骨脂对幼龄小鼠脂肪肝(NAFLD)的防治作用及机制。该实验采用高脂饮食建立幼龄小鼠NAFLD模型,给予补骨脂颗粒剂(低、高剂量)治疗5周后,检测血糖、血脂(TC,TG,LDL-C,HDL-C)、空腹胰岛素、肝功能(ALT,AST)水平,计算胰岛素抵抗指数(HOMA-IR),观察肝组织形态学改变,检测肝脏甘油三酯(TG)含量、CD44蛋白表达,同时检测肝组织核因子κB(NF-κB)p65磷酸化(p-p65)及非磷酸化蛋白(p65)表达及其下游细胞因子(TNF-α,IL-8)水平。结果显示与模型组比较,补骨脂组HOMA-IR,ALT,AST,空腹血糖,血脂(TC,TG,LDL-C),肝脏TG含量降低(P<0.01,P<0.05),HDL-C水平升高(P<0.01,P<0.05),肝细胞脂肪变性减轻,汇管区纤维组织增生及炎细胞浸润改善,肝脏CD44蛋白表达减少,肝组织TNF-α,IL-8水平、p-p65/p65明显下降(P<0.01)。高剂量组疗效优于低剂量组(P<0.01,P<0.05)。结果表明补骨脂对幼龄小鼠脂肪肝具有防治作用,还可调节其糖脂代谢紊乱、改善肝纤维化。其机制可能与下调NF-κB的活性抑制炎症反应有关。
[关键词] 非酒精性脂肪性肝病;补骨脂;炎症;核因子κB;幼龄小鼠
[Abstract] To investigate the mechanism and effect of Psoralea corylifolia(PC) in the treatment of NAFLD in juvenal mice. The NAFLD model in juvenal mice was established by feeding high-fat diet. Then PC herbal granules (at low and high dose) were administered for 5 weeks. Blood glucose (FBG, PG-1 h/2 h), blood lipid (TC, TG, HDL-C, LDL-C), fasting insulin, liver function (ALT, AST) were examined. HOMA-IR was calculated. Hepatic histological changes were observed. The content of TG, inflammatory factor (TNF-α, IL-8) and protein expressions of CD44, NF-κB p65, p-NF-κB p65 in hepatic tissues were determined. The ratio of p-NF-κB p65 to NF-κB p65 (p-p65/p65) was calculated. The result showed that compared with the model group, both PC treatment groups showed reduction in hepatic steatosis, inflammatory cell infiltration and fibroplasia in portal area. HOMA-IR, ALT, AST, FBG, PG-2 h, TC, TG, LDL-C concentrations and hepatic TG content were also significantly decreased, with the reduction of TNF-α, IL-8 contents, CD44 expression and p-p65/p65 ratio in hepatic tissues (P<0.01). High-dose PC group had a better effect than low-dose group (P<0.01, P<0.05). In conclusion, PC is effective in treating hepatic injury, glucolipid metabolism disturbances and fibrosis in juvenal NAFLD mice. The mechanism may be related to inhibition of inflammation and down-regulation of the activation of hepatic NF-κB.
[Key words] NAFLD;Psoralea corylifolia;inflammation;NF-κB;juvenal mouse
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)呈現全球化、低龄化流行趋势,是儿童就诊消化专科或肝病专科的首要病因[1-3]。肥胖与脂肪肝关系密切,我国儿童肥胖症的流行已是客观事实[4-5],肥胖儿童NAFLD患病率高达68.2%[2-3]。起源于儿童期的NAFLD更是成人肝硬化、代谢综合征相关疾病的主要后备人群[6]。随着我国城市化进程、中产家庭崛起及“二胎”政策的全面开放,NAFLD迅速蔓延,已取代慢性病毒性肝炎,成为威胁我国儿童健康的重大问题。
然而,目前临床尚缺乏针对儿童NAFLD的有效治疗药物[6-7]。近年来,“核因子κB(nuclear factor κB,NF-κB)”相关炎症通路在NAFLD发病机制中的重要地位被不断证实[8-9]。中药补骨脂(Psoralea corylifolia L.,PC)是儿科的传统常用药,具有温脾补肾壮阳的药用特点。该药的现代药理学研究主要与成人疾病相关,除抗肿瘤和改善骨质疏松等功效外,其肝脏保护及抗炎功效亦受到关注[10-11]。但是,PC对儿童脂肪肝的治疗作用及其机制研究未见报道,因此,本课题组通过建立幼龄小鼠脂肪肝动物模型,进一步探讨PC的抗脂肪肝作用及对肝组织NF-κB炎症通路的影响。
1 材料
1.1 动物 SPF级雄性C57BL/6J小鼠(3周龄)40只,购自北京华阜康生物科技股份有限公司(实验动物质量合格证号11401300041293)。动物饲养于华中科技大学同济医学院实验动物中心屏障系统(实验设施使用证明号00141016)。动物伦理符合《湖北省实验动物管理条例》和《华中科技大学实验动物伦理委员会章程》,经华中科技大学同济医学院附属妇女儿童医疗保健中心实验动物伦理委员会审核通过。
1.2 饲料 D12451高脂饲料购自北京华阜康生物科技股份有限公司,配方为:45%kcal脂肪,20%kcal蛋白质,35%kcal碳水化合物。普通饲料由华中科技大学同济医学院实验动物中心提供,配方为:35%面粉,20%大豆粉,20%玉米粉,15.5%麸子,0.5%豆油,5%鱼粉,2.5%骨头粉,1%酵母粉,0.5%盐。
1.3 药物 补骨脂配方颗粒由华润三九医药股份有限公司提供(批号1407001W)。维生素E软胶囊购自浙江医药股份有限公司新昌制药厂(批号140638)。
1.4 试剂 血糖(BG)试纸(批号460752)、Cocktail蛋白酶抑制剂(货号04693159001)均购自瑞士Roche公司。葡萄糖测定试剂盒(货号G022)购自上海名典生物工程有限公司。总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)测试盒(货号A111-1,A110-1,A112-1,A113-1);谷丙转氨酶(ALT)、谷草转氨酶(AST)试剂盒(货号C009-2,C0010-2);小鼠白细胞介素-8(IL-8)酶联免疫检测试剂盒(货号H008)均购自南京建成科技有限公司。小鼠胰岛素(INS)酶联免疫吸附测定试剂盒(货号E-EL-M2614c)、小鼠肿瘤坏死因子α(TNF-α)酶联免疫吸附测定试剂盒(货号E-EL-M0049c)均购自武汉伊莱瑞特生物科技有限公司。EDTA修复液(货号AS1016)、BCA蛋白浓度测定试剂盒(货号AS1086)、RIPA总蛋白裂解液(货号AS1004)、PMSF(货号AS1006)、磷酸化蛋白酶抑制剂(货号AS1008)均购自武汉ASPEN生物技术有限公司。DAB显色试剂盒(货号ZLI-9033)购自北京中杉金桥生物技术有限公司。兔抗小鼠CD44单克隆抗体(货号ab41478)、GAPDH多克隆抗体(货号ab37168)、磷酸化NF-κB p65(磷酸化位点S276)多克隆抗体(货号ab106129)均购自Abcam公司。兔抗小鼠NF-κB p65单克隆抗体(货号#8242)购自CST公司。山羊抗兔多克隆二抗(货号074-1506)购自KPL公司。
2 方法
2.1 模型制备、分组及处理 小鼠适应性喂养3 d。随机抽取8只小鼠编为正常组,继续正常饲料喂养。其余32只小鼠随机编为4组:模型组、补骨脂(低、高剂量)组、维生素E组,每组8只小鼠,换用D12451高脂饲料喂养。3 d后,正常及模型组给予0.02 mL·g-1生理盐水灌胃;补骨脂(低剂量)组给予1.125 mg·g-1补骨脂配方颗粒溶液灌胃;补骨脂(高剂量)组给予2.25 mg·g-1补骨脂配方颗粒溶液灌胃;维生素E组给予0.01 mg·g-1维生素E软胶囊混悬液灌胃。各组灌胃给药至10周龄。处死前禁食12 h,摘除眼球法采集血液标本,采血量2~3 mL,3 000 r·min-1條件下离心30 min,分离血清,-80 ℃保存;取肝脏组织:肝左外叶、左中叶装入冻存管,-80 ℃保存,备用;肝右中叶、右上叶和右下叶予4%多聚甲醛固定,石蜡包埋,用于苏木精-伊红(HE)及免疫组化检测。
2.2 口服葡萄糖耐量试验(OGTT) 处死前3 d行OGTT实验。禁食12 h,剪尾取血法采集血液标本,用罗氏血糖仪检测空腹血糖(FBG)值,之后予50%葡萄糖2 g·kg-1灌胃,然后再次剪尾取血,血糖仪分别测定灌胃后1,2 h血糖(PG-1 h,PG-2 h)值。
2.3 计算胰岛素抵抗指数(HOMA-IR) 葡萄糖氧化酶法测定空腹血糖(FBG),ELISA方法测定空腹胰岛素(FINS)。根据公式:FBG (mmol·L-1)×FINS(mIU·L-1)/22.5计算HOMA-IR。
2.4 苏木精-伊红(HE)染色 取石蜡切片,二甲苯脱蜡,梯度乙醇水化,去离子水冲洗,苏木精染色1~5 min,去离子水冲洗2 min,1%盐酸乙醇分化15 s,去离子水冲洗1 min,1%氨水泛蓝30 s,去离子水冲洗1 min,伊红染色30 s,去离子水冲洗30 s,梯度乙醇脱水,二甲苯透明,干燥后中性树胶封片,于光学显微镜观察。
2.5 生化指标及炎症指标检测 酶法测定血TC,TG,HDL-C,LDL-C,ALT,AST及肝组织TG含量。ELISA方法测定肝组织TNF-α,IL-8水平。
2.6 免疫组化方法测定肝组织CD44蛋白表达 将石蜡切片置于65 ℃烘箱中烘片2 h,脱蜡、水化。用PBS洗涤后,将切片置于EDTA缓冲液中微波修复,自然冷却后用PBS洗涤。再将切片置于3%过氧化氢溶液中,室温下避光孵育10 min。PBS洗涤甩干后5%牛血清蛋白封闭20 min。去除封闭液,每张切片加入约50 μL稀释的(比例为1∶150)兔抗小鼠CD44单克隆抗体覆盖组织,4 ℃过夜。用PBS洗涤后,37 ℃下每张切片孵育二抗50 min。PBS洗涤后,每张切片加新鲜配制DAB溶液显色。显色完全后,蒸馏水或自来水冲洗,苏木素复染,1%盐酸乙醇分化,自来水冲洗,氨水返蓝,流水冲洗。切片经过梯度乙醇脱水干燥,二甲苯透明,中性树胶封固。
2.7 Western blot方法测定肝组织NF-κB p65、磷酸化NF-κB p65蛋白表达 提取肝组织总蛋白,用BCA法测定蛋白浓度,-80 ℃保存。取40 μg蛋白,变性后用10%SDS-PAGE分离胶电泳,PVDF膜转膜,5%脱脂奶粉(非磷酸化蛋白)或0.5%牛血清蛋白(磷酸化蛋白)封闭,4 ℃孵育一抗(GAPDH稀释比例为1∶1万;NF-κB p65稀释比例为1∶2 000;磷酸化NF-κB p65稀释比例为1∶1 000)摇床过夜,TBST洗膜后,孵育二抗30 min,TBST洗膜后,化学发光法检测PVDF膜,用AlphaEaseFC软件进行分析灰度值。
2.8 统计学方法 运用SPSS 19.0软件进行数据处理,所有数据均符合正态分布,以±s表示,各组间比较采用单因素方差分析(ANOVA),多样本均数间的两两比较根据方差齐同性检验结果,选择结果判读标准“LSD-t”或者“Games-Howell”,以P<0.05为差异有统计学意义。
3 结果
3.1 补骨脂对幼龄脂肪肝小鼠OGTT及HOMA-IR的影响 与正常组比较,模型小鼠血清FBG,PG-2 h,HOMA-IR均有升高(P<0.01);与模型组比较,补骨脂各剂量组、维生素E组血清PG-2 h水平无统计学差异,但FBG,HOMA-IR有不同程度降低(P<0.01,P<0.05),其中补骨脂高剂量组降幅最大(P<0.01),HOMA-IR较低剂量组有统计学意义(P<0.01)。各组小鼠血清PG-1 h水平未见明显差异,见表1。
3.2 补骨脂对幼龄脂肪肝小鼠血脂的影响 与正常组比较,模型小鼠出现血脂代谢紊乱,血清TG,TC及LDL-C均显著升高(P<0.01),且血清HDL-C水平明显降低(P<0.01);与模型组比较,补骨脂各剂量组、维生素E组各血脂单项水平均有不同程度改善(P<0.01,P<0.05),其中补骨脂高剂量组改善幅度最明显(P<0.01),差异较低剂量组有统计学意义(P<0.01,P<0.05),见表2。
3.3 补骨脂对幼龄脂肪肝小鼠肝脏形态学的影响 正常组小鼠肝小叶结构可见,肝细胞索及肝血窦排列正常。与正常组比较,模型组肝细胞明显水肿、变性,肝细胞明显脂肪变性,汇管区纤维组织及小胆管增生,较多炎性细胞浸润。与模型组比较,各治疗组肝脏病理改变均有改善,补骨脂高剂量组病变最轻。镜下具体情况为:补骨脂低剂量组肝细胞水肿,其内见散在脂滴空泡,汇管区纤维组织轻度增生,炎性细胞浸润;补骨脂高剂量组部分肝细胞轻度脂肪变性,汇管区少许炎性细胞浸润;维生素E组汇管区炎性细胞浸润,肝细胞内见散在脂滴空泡,见图1。
3.4 补骨脂对幼龄脂肪肝小鼠肝功能及肝脏TG含量的影响 与正常组比较,模型小鼠血清ALT,AST均有升高(P<0.01),肝脏TG含量升高(P<0.01);与模型组比较,补骨脂各剂量组、维生素E组血清ALT,AST均降低(P<0.01),肝脏TG含量降低(P<0.01),其中补骨脂高剂量组较低剂量降幅明显(P<0.01,P<0.05),见表3。
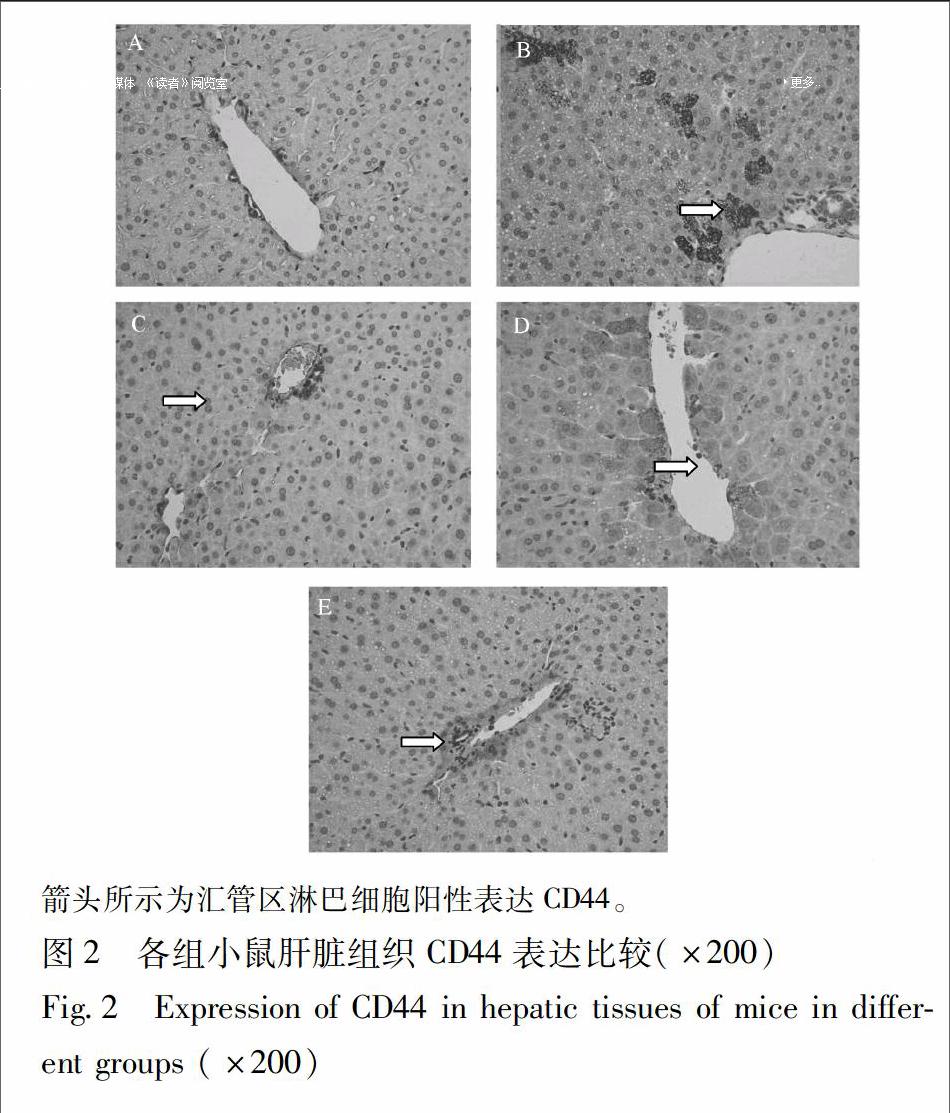
3.5 补骨脂对幼龄脂肪肝小鼠肝组织CD44蛋白表达的影响 正常组小鼠肝组织汇管区淋巴细胞呈阴性表达CD44。与正常组比较,模型组小鼠汇管区淋巴细胞呈强阳性表达CD44。与模型组比较,各治疗组CD44表达均有减少:补骨脂低剂量小鼠汇管区部分淋巴细胞表达CD44;补骨脂高剂量组及维生素E组小鼠汇管区部分淋巴细胞弱表达CD44,见图2。
3.6 补骨脂对幼龄脂肪肝小鼠肝组织炎癥因子的影响 与正常组比较,模型小鼠肝组织TNF-α,IL-8均有升高(P<0.01);与模型组比较,补骨脂各剂量组、维生素E组肝组织TNF-α,IL-8均降低(P<0.01),其中补骨脂高剂量组较低剂量降幅明显(P<0.01),见表4。
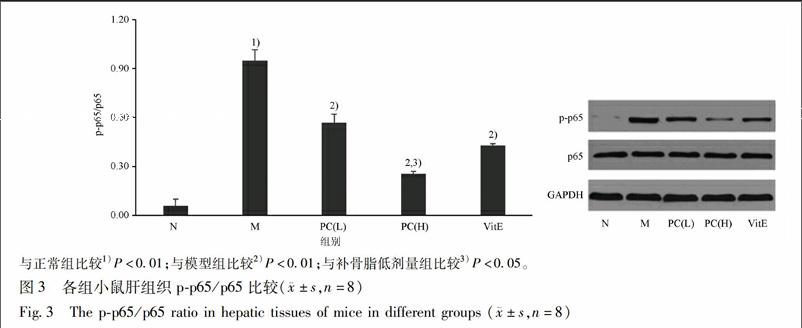
3.7 补骨脂对幼龄脂肪肝小鼠肝组织NF-κB的活性的影响 以p-p65/p65表示NF-κB的活性。与正常组比较,模型小鼠肝组织p-p65/p65显著升高(P<0.01);与模型组比较,补骨脂各剂量组、维生素E组肝组织p-p65/p65均明显降低(P<0.01),其中补骨脂高剂量组较低剂量降幅明显(P<0.05),见图3。
4 讨论
传统中药材补骨脂(PC),是现代药理研究的热点[10-11]。现如今,PC的多重药理活性逐渐被发现,特别是在治疗骨质疏松和性激素样作用方面的研究已取得了较多成绩[12]。但是,补骨脂对代谢性疾病,尤其是脂肪肝的治疗作用,尚未见报道。
采用高脂饮食喂养的方法,可成功建立幼龄小鼠脂肪肝模型[13]。本研究模型小鼠在体成熟(10周龄)前进行了取材[14],成年前出现了胰岛素抵抗、肝功能受损(ALT>AST)、肝脏TG含量增高、肝脏组织学显示脂肪变性和炎细胞浸润等表现,具备NAFLD典型特征[7]。给予补骨脂颗粒灌胃后,模型小鼠HOMA-IR降低、ALT及AST水平降低、肝脏TG含量减少,高剂量组优于低剂量组。进一步对比肝脏病理学改变显示PC治疗后肝细胞脂肪变性减轻、炎细胞浸润减少,且高剂量组优于低剂量组。说明PC可改善幼龄小鼠脂肪肝,疗效呈剂量依赖性。
此外,为进一步评估肝纤维化情况,除观察各组小鼠肝脏HE染色汇管区纤维增生情况外,还检测了肝组织CD44蛋白表达。CD44是I型跨膜蛋白,是细胞表面受体,通常表达在肝脏Kupffer细胞和浸润淋巴细胞表面。当肝脏出现纤维变性时,可与过表达的细胞外基质产物透明质酸特异性结合。因此,CD44可视为是评估早期肝纤维化的间接指标[15]。模型小鼠肝脏HE染色见汇管区纤维组织增生,且汇管区淋巴细胞CD44蛋白表达呈强阳性,均提示肝纤维化存在。经PC治疗后,观察肝脏HE染色,低剂量组小鼠汇管区纤维增生减轻,高剂量组消失;肝组织CD44蛋白表达下降,高剂量组较低剂量组下降更明显。说明PC可改善幼龄脂肪肝小鼠早期肝纤维化,疗效亦呈剂量依赖性。
NAFLD的发病涉及氧化应激、胰岛素抵抗和炎症等多个机制[16],且各机制之间互相影响互相促进。慢性炎症反应不仅在上述关联中扮演重要角色,还推进肝纤维化进程[17]。NF-κB炎症信号通路激活在众多有关NAFLD的临床和实验室研究中被证实[18-21],本研究亦显示模型小鼠肝组织磷酸化与非磷酸化NF-κB p65蛋白表达比值明显升高,并伴随NF-κB下游炎症因子肝组织TNF-α,IL-8表达增多。进一步检测PC治疗组,发现:模型小鼠经PC治疗后,肝组织磷酸化与非磷酸化NF-κB p65蛋白表达比值明显下降,且肝组织TNF-α,IL-8水平也明显减少。说明PC改善脂肪肝的疗效可能是通过抑制NF-κB炎症通路活化来实现的。同时,高剂量组的下调强度较低剂量组明显。
综上所述,本研究证实了补骨脂的防治幼龄小鼠脂肪肝、肝纤维化的功效,并进一步探讨了其改善肝脏慢性炎症的能力,抑制NF-κB的活化是补骨脂发挥抑制炎症反应的可能机制之一。
[参考文献]
[1] Mencin A A, Lavine J E. Nonalcoholic fatty liver disease in children[J]. Curr Opin Clin Nutr Metab Care,2011, 14(2): 151.
[2] Fan J G. Epidemiology of alcoholic and nonalcoholic fatty liver disease in China[J]. J Gastroenterol Hepatol,2013, 28(Suppl. 1): 11.
[3] 朱婵娟,范建高. 儿童非酒精性脂肪性肝病[J]. 实用肝脏病杂志, 2013, 16(6): 483.
[4] Ji C Y.Cooperative study on childhood obesity: working group on obesity in China (WGOC). The prevalence of childhood overweight/obesity and the epidemic changes in 1985-2000 for Chinese school-age children and adolescents[J]. Obesity Rev,2008, 9(Suppl. 1): 78.
[5] Guo X F, Zheng L Q, Li Y, et al. Prevalence and risk factors of being overweight or obese among children and adolescents in northeast China[J]. Pediatr Res, 2013, 74(4): 443.
[6] Alkhouri N, Feldstein A E. The TONIC trial: a step forward in treating pediatric nonalcoholic fatty liver disease[J]. Hepatology, 2012, 55(4):1292.
[7] 周伟,申昆玲. 儿科学最新诊断与治疗[M]. 20版. 北京:人民军医出版社,2014: 608.
[8] Fuchs C D, Traussnigg S A, Trauner M. Nuclear receptor modulation for the treatment of nonalcoholic fatty liver disease[J]. Semin Liver Dis, 2016, 36(1): 69.
[9] Wang Y D, Chen W D, Wang M H, et al. Farnesoid X receptor antagonizes nuclear factor kappaB in hepatic inflammatory response[J]. Hepatology, 2008, 48(5): 1632.
[10] 吴疆,魏巍,袁永兵. 补骨脂的化学成分和药理作用研究进展[J]. 药物评价研究,2011,34(3): 217.
[11] 邱蓉丽,李璘,乐巍. 补骨脂的化学成分与药理作用研究进展[J]. 中药材,2010,33(10): 1656.
[12] 李劲平,王小静,曾英,等. 补骨脂定抗实验性绝经后骨质疏松的效应及作用机制研究[J]. 中国中药杂志, 2013, 38(11): 1816.
[13] Marin V, Rosso N, Dal Ben M, et al. An animal model for the juvenile non-alcoholic fatty liver disease and non-alcoholic steatohepatitis[J]. PLoS ONE, 2016, 11(7): e0158817.
[14] 汤宏斌,孔利佳. 实验动物学[M]. 武汉:湖北长江出版集团,湖北人民出版社,2006: 112.
[15] Bruce K D, Cagampang F R, Argenton M, et al. Maternal high-fat feeding primes steatohepatitis in adult mice offspring, involving mitochondrial dysfunction and altered lipogenesis gene expression[J]. Hepatology, 2009, 50(6):1796.
[16] Ratziu V, Bellentani S, Cortez P H, et al.A position statement on NAFLD/NASH based on the EASL 2009 special conference[J]. J Hepatol, 2010, 53(2): 372.
[17] Takaki A, Kawai D, Yamamoto K. Molecular mechanisms and new treatment strategies for non-alcoholic steatohepatitis (NASH)[J]. Int J Mol Sci, 2014, 15(5): 7352.
[18] 陆洪国,王建儿,赵振中,等. 吡格列酮对非酒精性脂肪性肝病患者核因子-κB及白介素-6的影响[J].中西医结合肝病杂志, 2012,22(6): 340.
[19] 金二荣,邸阜生. 胰岛素对内毒素、chemerin激活肝脏NF-κB炎症通路的影响[D].天津:天津医科大学,2012.
[20] Tian Y L, Ma J T, Wang W D, et al. Resveratrol supplement inhibited the NF-κB inflammation pathway through activating AMPKα-SIRT1 pathway in mice with fatty liver[J].Mol Cell Biochem, 2016, 422(1/2): 75.
[21] Tang W J, Zeng L, Yin J J, et al. Hugan Qingzhi exerts anti-inflammatory effects in a rat model of nonalcoholic fatty liver disease[J]. Evid Based Complement Alternat Med, 2015, 2015: 810369.
[責任编辑 张宁宁]

