蜂产品中黄酮类化合物的提取工艺及功能活性的研究进展
李强强,王 凯,梁馨文,吴黎明
(中国农业科学院蜜蜂研究所,北京 100093)
蜂产品中黄酮类化合物的提取工艺及功能活性的研究进展
李强强,王 凯,梁馨文,吴黎明*
(中国农业科学院蜜蜂研究所,北京 100093)
蜂产品中富含黄酮类化合物,不同蜂产品中黄酮类化合物的种类和含量分布大不相同。黄酮类化合物具有显著的抗菌、抗病毒和抗炎作用等诸多生物活性,因此蜂产品中的黄酮类提取物可用于各类新型食品、药品、保健品的开发,对保障人类健康有重大意义。本文综述了近年来对蜂产品中黄酮类化合物的提取分离纯化工艺及相关功能活性研究,旨在为蜂产品的深入研究提供一定的技术支撑。
蜂产品,黄酮类化合物,提取工艺,分离鉴定,功能活性
黄酮类化合物指具有两个苯环结构通过中央三碳链相互连接而成的C6-C3-C6基本碳骨架的一系列化合物。随取代基和位置的不同,形成了黄酮、黄酮醇、双氢黄酮、双氢黄酮醇、异黄酮、双氢异黄酮等多种基本碳骨架。研究表明,黄酮类化合物具有诸多生物活性,如抗菌,抗炎和抗癌作用等[1-2]。
蜂产品是指来源于蜜蜂的产品,包括蜂蜜、蜂花粉、蜂胶、蜂王浆、蜂蜡等,富含黄酮类化合物。经研究表明[3],蜂胶中黄酮类化合物含量较其他种类蜂产品较多,从不同品种的蜂胶中共计分离鉴别出超过100种的黄酮类化合物,其中杨梅素、槲皮素、白杨素、山萘酚、高良姜素等被认为是蜂胶黄酮中具有主要生物活性的组分。蜂产品中的黄酮提取物可用于各类新型食品、药品、保健品的开发,对保障人类健康有重大意义。本文则综述了近年来针对蜂产品中黄酮类化合物的提取分离纯化工艺及相关功能活性研究,旨在为日后蜂产品进一步的研究开发提供相应的理论支持。
1 蜂产品中黄酮类化合物的提取分离纯化工艺研究进展
目前,针对不同蜂产品(包括蜂胶、蜂花粉、蜂蜜、蜂王浆等)中的黄酮类化合物,均有相应的提取分离纯化工艺。其中主要包括对总黄酮的提取,进而对总黄酮提取液进行各种黄酮单体的分离、纯化、鉴定工艺。本部分内容总结了各种蜂产品中总黄酮的提取方法及各种黄酮单体的分离、纯化、鉴定方法。
1.1 蜂产品中总黄酮的提取工艺研究进展
1.1.1 蜂产品中总黄酮的提取方法 蜂产品中总黄酮提取方法大致可分为:传统醇提取法,超声波辅助提取法,微波协同提取法,超临界流体萃取法,超高压萃取法等。具体提取工艺的研究进展如下所述。
1.1.1.1 传统醇提取法 乙醇提取法因其提取工艺简单,对提取设备要求不高,且成本低廉、溶剂易挥发等优点而成为当前蜂产品大规模提取的主要方法。王正等[4]采用甲醇、乙醇、正丁醇、丙酮、乙酸乙酯、乙醚、三氯甲烷七种不同极性的溶剂,提取蜂胶中黄酮类化合物,结果表明其提取能力顺序为:丙酮>甲醇>乙醇>乙醚>正丁醇>乙酸乙酯>三氯甲烷。但综合考虑提取能力、成本及溶剂毒性等因素,最终确定乙醇为最佳提取溶剂。此外,经过乙醇提取得到的活性成分受浸渍时间长短、温度高低、乙醇溶液浓度等因素的影响。通过单因素和正交实验等方法进行提取时间、提取温度、溶剂浓度等条件的优化,可获得最佳的提取工艺参数,以提高黄酮类化合物的提取率。夏广英[5]等人以茶花粉和油菜花粉为原料,进行蜂花粉黄酮类物质的提取研究,经过优化确定了最佳提取条件为:乙醇浓度65%、料液比1∶6、提取温度65 ℃、提取时间32 h、搅拌速度为150 r/min,在此最佳条件下,茶花粉和油菜花粉的提取率分别为55.52%和48.60%。
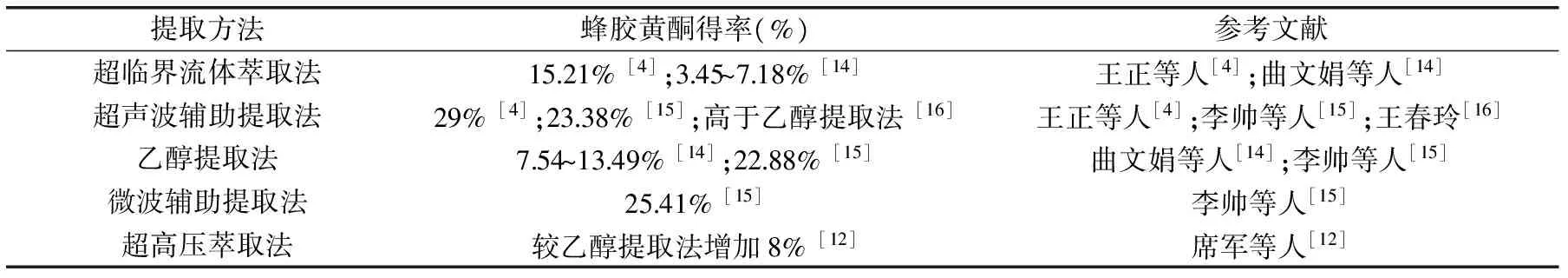
表1 不同提取方法间提取能力比较Table 1 The comparation of extraction capability among different methods
1.1.1.2 超声波、微波辅助提取法 与传统醇提取法相比,超声波提取方法有提取时间短、温度要求低、得率高等优点,而被广泛应用于蜂产品中黄酮类化合物的提取工艺中。杨洁等[6]利用超声波辅助技术提取蜂花粉中黄酮类化合物,并优化得到其最佳提取条件为:乙醇浓度76%、料液比1∶30、超声波时间 33 min,超声波温度为 51 ℃。潘秋月等[7]研究了蜂胶黄酮的超声波提取工艺,并优化得到其最佳提取条件为:乙醇浓度75%、料液比为1∶10、提取时间20 min、提取温度 60 ℃、超声波提取 2 次,此时黄酮提取含量高达5.046 mg/g。
也有研究者利用超声波辅助微波萃取蜂产品中的黄酮类化合物。余晶晶等[10]用超声微波协同法研究了蜂胶中黄酮类化合物的最佳提取条件为:乙醇浓度65%、料液比1∶15、提取时间150 s、微波功率175 W。在该提取条件下,蜂胶提取液中总黄酮含量为30.64%。此方法克服了常规浸提、超声波和微波萃取的不足之处,并实现了在低温常压环境下对固体样品进行快速、高效、可靠的处理,且成本相对超临界CO2萃取较低。
1.1.1.3 超临界流体萃取法 超临界流体萃取技术获得的蜂产品黄酮提取物一般具有难溶于酒精、脂溶性强、抗应变性强等特点。高荫榆等[11]研究了超临界流体萃取蜂胶黄酮类化合物的工艺,结果表明,萃取压力对萃取得率的影响最大,其次为乙醇浓度、料液比、萃取温度;最佳萃取条件为:萃取压力25 MPa、乙醇浓度 95%、料液比6∶1、萃取温度为 500 ℃、萃取时间为 4 h、流体流速为 35 kg/h,此时蜂胶黄酮得率为15%以上。超临界流体萃取得到的黄酮类化合物虽然含量低,一般仅为同一原料乙醇提取的1/5,但用超临界流体萃取的黄酮类化合物具有色泽淡黄、提取溶剂用量低、无溶剂残留、杂质少、重金属含量低、工艺流程简单等优点。
1.1.1.4 超高压萃取法 高压加工技术是一种重要的非热加工方法。在100~800 MPa的流体静压力下,病原微生物能快速被灭活,达到食品保鲜的目的。席军等[12]研究了高压加工技术在蜂胶黄酮类化合物提取中的应用,发现高压提取的组分和室温浸泡提取的组分无差异,而且在高达600 MPa压力作用下,黄酮类化合物的提取率并没有减少,说明压力对蜂胶黄酮类化合物组分不产生破坏作用。而且高压能够显著地提高溶剂渗透的通量和速率,强化有效成分的传质过程,使有效成分的提取率更高。经进一步分析,得到了较优的操作工艺参数:当提取压力在 450~500 MPa、乙醇浓度在 65%~75%、料液比在1∶28~1∶35之间时,黄酮类化合物的提取率较高。王娜等[13]对超高压提取蜂胶黄酮的工艺参数进行了优化,得到其最优提取条件为:乙醇浓度85.9%、液料比46.75∶1、保压时间2 min、最佳压力357.5 MPa,此时蜂胶黄酮得率为12.38%。
1.1.2 不同提取方法比较 不同提取方法,例如传统醇提取法、超声波辅助提取法、微波辅助提取法、超临界流体萃取法、超高压萃取法,对蜂产品中黄酮类化合物的提取率各不相同(见表1)。不同提取方法对蜂产品中黄酮的提取能力顺序为:微波辅助提取法>超声波辅助提取法>传统醇提取法>超临界萃取法。
1.2 蜂产品中黄酮单体的分离纯化工艺研究进展
蜂产品中黄酮单体的分离鉴定研究一直是蜂产品活性成分研究领域的热点,仅蜂胶中就分离鉴定得到超过100种黄酮单体[3]。蜂产品中黄酮单体的分离一般是在醇提取物的基础上,经柱层析法洗脱富集,并通过不断优化有机试剂浓度梯度、pH等条件进行逐级分离、纯化获得化合物后,再结合色谱技术、液相色谱串联质谱技术、气相色谱串联质谱技术、光谱技术以及核磁共振技术对其定性检测,从而鉴定出已知或新型未知的化合物。
柱层析技术又称为柱色谱技术,是一种根据样品混合物中各组分在固定相和流动相中分配系数不同,经多次反复分配将组分分离开的分离纯化技术,广泛应用于蜂产品中黄酮化合物的分离纯化。孙丽萍等人[17]采用聚酰胺树脂对蜂花粉中黄酮类化合物进行分离纯化,结果证明,经聚酰胺树脂处理后的总黄酮得到了有效富集,由乙醇粗提物中的5.91%提高到19.68%,较原材料中蜂花粉黄酮含量提高13倍。邢建军等[18]研究了XAD-2树脂对康思农油菜蜂蜜中黄酮类物质的最佳柱层析分离条件,并得出其加标回收率高达82.8%。郑洁等[19]研究发现加入极性共聚单体(例如甲基丙烯酸甲酯或丙烯酰胺),或者使用比表面积和孔径较大的树脂都利于对总黄酮的吸附。经优化获得含2%丙烯酰胺共聚单体、比表面积为700 m2/g、孔径为14 nm的大孔苯乙烯树脂对蜂胶总黄酮的富集效果最优,其最终含量为36%~38%,较未经树脂法处理的蜂胶总黄酮含量提高10%以上,且总回收率为70%以上。由此可见,柱层析对蜂产品黄酮提取物的分离、纯化有重要作用,该方法设备简单,操作简便,且具有较高的回收率。但同时该方法操作过程较为费时,而且对于分子量相近的物质难以达到很好的分离,通常需要与其他技术配合使用以达到分离纯化的目的。
冠心病是心内科最常见的疾病,而心绞痛则是冠心病的一个最常见类型,因冠脉粥样硬化导致管腔狭窄和血管痉挛引起心肌缺血,导致患者前胸阵发性、压榨性疼痛。对于冠心病心绞痛的治疗,临床上包括药物治疗和介入治疗两种方法,药物治疗对于症状较轻,持续时间不长的患者有很好的疗效,但对于心绞痛发作次数多、持续时间长的患者建议行PCI手术治疗[1] 。本次研究以我院收治的104例高龄冠心病心绞痛患者为例,探讨PCI治疗冠心病心绞痛的疗效。
邢建军等[18]利用柱层析技术分离得到蜂蜜黄酮类化合物,并采用LC/MS/MS(液质联用)分析发现康思农油菜蜂蜜样品中含有槲皮素、异鼠李素、山萘酚、木樨草素、白杨黄酮、高良姜黄素、短叶松素、芹菜素、5,7-二羟基双氢黄酮和汉黄芩素10种黄酮类物质。蔡蕊等[20]利用石油醚、乙酸乙酯、正丁醇溶剂对蜂胶65%乙醇提取物进行逐级分配,并利用硅胶色谱柱层析、重结晶、制备液相等方法进行分离和纯化,通过理化测试、红外、紫外、质谱、核磁共振波谱分析共鉴定31个化合物结构。郑洁等[19]通过pH梯度萃取法分离了蜂胶中的7,4′-二羟基类黄酮(芦丁、杨梅素、槲皮素和芹菜素)和7-羟基类黄酮(柯因、高良姜素和松属素)。蒋丽琴等[21]建立了胶束电动毛细管色谱法,用以分离蜂胶和银杏叶中10种具有生物活性的黄酮类化合物,包括芦丁、芹菜素、木犀草素、圣草酚、山奈酚、白杨素、金合欢素、黄烷酮、黄酮及菲瑟酮。Piccinelli等[22]从一种红色古巴蜂胶样品的甲醇提取物中利用柱层析技术,并结合HPLC-MS和NMR技术鉴定出11种黄酮类物质(包括2种异黄酮、3种异黄烷和6种紫檀素)。Falcão等[23]从葡萄牙蜂胶中得到乙醇提取物,并利用高效液相色谱法分离乙醇提取物后,再通过质谱技术在电喷雾负离子模式下识别出37个酚酸类和黄酮类化合物。Kumazawa等[24]利用硅胶柱层析和制备液相色谱技术从日本蜂胶中分离出一种新型的异戊烯基黄酮类化合物异长叶醇和3种已知的长叶醇。Li等[25]将墨西哥蜂胶用甲醇提取,利用硅胶柱层析,经正己烷、甲醇-氯仿溶剂体系洗脱分离,并利用光谱法鉴定出两种新的丙烯黄酮化合物。由此可见,柱层析法、有机溶剂逐级萃取分离法、色谱法等是黄酮类化合物分离纯化的重要手段,光谱技术、质谱技术以及核磁共振技术在黄酮类化合物的结构鉴定中发挥着重要作用。此外,蜂产品中黄酮类化合物种类繁多,且蜂产品的植物来源、产地来源各异,从而导致针对不同品种蜂产品中黄酮类化合物的分离鉴别难度较大,有待日后进一步完善,以开发出更多新型的具有生物活性的黄酮类化合物造福人类。
2 蜂产品中黄酮类化合物的功能活性研究进展
由于蜂产品(尤其是蜂胶制品)中富含黄酮类化合物,而具有抗氧化、抑菌、抗炎、增强免疫力、降血糖、抗癌等活性,其保健与临床应用价值较高。近年来,国内外针对蜂产品(尤其是蜂胶制品)中黄酮类化合物的功能活性及其作用机制研究越来越多,为进一步开发新型功能性食品及临床药品奠定了一定的基础。
2.1 抗氧化功能
蜂产品中黄酮类化合物具有清除自由基、提高SOD和GSH-Px的活性、抑制脂质过氧化、降低MDA含量等抗氧化功能。李帅等[15]研究了蜂胶黄酮的抗氧化性。当精制蜂胶黄酮浓度达0.25 mg/mL时,对超氧阴离子的清除率达98.3%;当精制蜂胶黄酮提取物浓度达0.05 mg/mL时,对羟自由基的清除率达98.9%,对DPPH·清除率高达96.9%,对NO2-离子的清除率97.9%。杜夏等[26]从蜂胶中分离得到21种化合物,实验结果表明,其中山奈酚、3′,4′,5′-三羟基-3,7-二甲氧基黄酮、咖啡酸苯乙酯、异鼠李素、槲皮素可通过清除自由基、抑制脂质过氧化、提高细胞清除超氧阴离子的能力,减轻细胞膜在氧自由基攻击下的损伤程度,从而起到保护受损肝细胞的功效。
王馨等[27]利用70%的乙醇溶液提取蜂胶,并通过二氯甲烷将乙醇提取物分级萃取,之后对二氯甲烷萃取物进行柱层析分离获得不同组分,并以CCK-8法检测N2a细胞存活率为指标,对蜂胶各分离组分及化合物进行活性筛选。实验表明,其中一种组分具有高活性,进一步分离纯化该组分可制备出松属素、短叶松素、短叶松素-3-醋酸酯、白杨素、高良姜素五种化合物,均可提高SOD和GSH-Px的活性,降低MDA含量,以减轻缺血再灌注损伤导致的细胞氧化损伤。杨明等[28-29]研究了蜂胶总黄酮对大鼠心肌缺血-再灌注损伤的保护作用,结果显示蜂胶总黄酮可明显降低MDA含量,增强SOD活力。葛苗苗等[30]从蜂胶中分离、纯化并鉴定出6种具有抗心肌细胞氧化损伤作用的活性物质。并证明蜂胶中咖啡酸酯类物质(咖啡酸苄酯、咖啡酸苯乙酯和咖啡酸肉桂酯)和黄酮类物质(白杨素、短叶松素)均具有保护氧化损伤性心肌细胞的作用,其作用机制可能是通过保护抗氧化酶、抑制脂质过氧化反应、降低Ca2+和改善细胞凋亡现象实现的。由此可见,黄酮类化合物可通过清除自由基,提高SOD和GSH-Px的活性,抑制脂质过氧化,降低MDA含量等抗氧化活性达到减轻细胞氧化损失的目的,具有较高的保健和临床应用价值。
2.2 抑菌功能
Bueno-Silva等[31]从巴西红蜂胶(BRP)中得到乙醇提取物(EEP),并分离得到两种新黄酮类化合物neovestitol和vestitol。经抑菌活性实验结果显示,neovestitol的MICs范围从<6.25至25~50 μg/mL,MBCs范围从25~50到50~100 μg/mL,而vestitol的MICs范围从25~50到50~100 μg/mL,MBCs范围从25~50到50~100 μg/mL。Uzel等[32]从四种不同的安纳托利亚蜂胶样品中获得乙醇提取物,经高分辨气相色谱串联质谱法检测出安纳托利亚蜂胶中主要成分为黄酮类物质,其对远缘链球菌、粪肠球菌、藤黄微球菌、白色念珠菌、克柔念珠菌、变异链球菌、金黄色葡萄球菌、表皮葡萄球菌和产气肠杆菌等多种病原菌均有一定杀菌作用。李帅等[15]用纯化后的蜂胶黄酮提取物进行抑菌实验,发现蜂胶黄酮对食品中常见的致腐菌有一定抑菌效果。结果表明其对几种菌种的抑菌能力大小依次为为:啤酒酵母>金黄色葡萄球菌>大肠杆菌>沙门氏菌。
2.3 抗炎功能
蜂胶中具有良好抗炎效果的化合物主要包括:黄酮类化合物(槲皮素、柯因、高良姜素、山萘酚等)和酚酸类化合物(咖啡酸、阿魏酸、肉桂酸等)[33]。Wang等[34-35]利用高效液相色谱法(HPLC)分析中国蜂胶乙醇提取物(EECP),发现含有丰富的黄酮类化合物,并对其化学成分进行体外抗炎作用评估实验,结果显示EECP具有良好抗炎效果。Blonska等[36]探讨了蜂胶乙醇提取物(EEP)和特定的黄酮类化合物(白杨素、高良姜素、山萘酚和槲皮素)对白细胞介素-1(IL-1)和诱导型一氧化氮合酶(iNOS)在脂多糖(LPS)诱导的J774A.1巨噬细胞中基因表达的影响。结果表明,EEP可显著抑制IL-1 mRNA和iNOS mRNA的表达。而且除高良姜素以外,其他三种黄酮类化合物均能显著降低IL-1 mRNA水平、IL-1浓度,以及iNOS mRNA水平和NO的产生,其中最有效的是白杨素。测试结果证明黄酮类化合物有助于蜂胶的抗炎活性。
平舜等[37]研究了茶蜂花粉提取物(BPE)的抗炎活性。通过福林酚法和三氯化铝比色法测定BPE中的总酚酸和总黄酮质量分数分别为(255.23±21.43) mg/g(绿原酸当量)和(132.85±14.77) mg/g(芦丁当量),并采用脂多糖(LPS)诱导的小鼠Raw 264.7细胞体外炎症模型,探究了BPE对炎症因子和相关基因表达的调控作用。结果显示,在体外细胞实验中,BPE能显著抑制Raw 264.7 细胞释放NO,并显著抑制iNOS、IL-1β和IL-10,增强HO-1 基因mRNA 水平的表达,且呈一定的剂量相关性,表现出了良好的抗炎症效果。
2.4 增强免疫的功能
韩彦彬等[38]探讨了蜂胶黄酮对小鼠免疫功能的影响。分别以175、350、700 mg/kg BW(相当于人体推荐用量的5、10、20倍)3个剂量的总黄酮(以芦丁计)给小鼠连续灌胃30~35 d后,检测各项免疫指标。结果显示,蜂胶黄酮能明显刺激小鼠的脾淋巴细胞增值和转化作用,促进小鼠迟发型变态反应作用,提高小鼠抗体生成细胞数和血清溶血素水平,促进小鼠单核-巨噬细胞碳廓清作用,增强小鼠的单核-腹腔巨噬细胞吞噬能力,提高小鼠NK细胞(天然杀伤细胞)活性,从而说明蜂胶黄酮具有增强免疫功能的作用。
2.5 降血糖功能
王爱霞等[39]参考GBT 24283-2009的测定方法对蜂胶醇提物,以及市售蜂胶胶囊中总黄酮含量进行测定,得出含量分别为24.6、8.3、7.9 g/100 g。之后以四氧嘧啶建造糖尿病小鼠模型,分别将三种物质给小鼠灌胃,连续给药14 d。结果显示:蜂胶醇提物组及蜂胶胶囊组用量均可有效降血糖,换算成小鼠单位体重灌胃黄酮量后发现基本接近,均为49 mg/kg。孙岩等[40]以总黄酮含量为考察指标,利用溶剂萃取和大孔树脂对油菜蜂花粉乙醇提取物进行分离纯化,富集黄酮,然后对不同极性组分进行抑制α-葡萄糖苷酶实验,并利用红外光谱(IR)和液-质联用(LC-MS)对体外降糖活性最高的组分进行化学成分分析。结果表明,黄酮类物质在抑制α-葡萄糖苷酶活性中起主要作用;该活性组分中共鉴定出含5种主要物质,其中已确定的4种为槲皮素-3-O-β-D-吡喃葡萄糖基-(1→2)-O-β-D-吡喃葡萄糖苷、山萘酚-3,4′-双-O-β-D-吡喃葡萄糖苷、异鼠李素-3-O-β-D-吡喃葡萄糖基-(1→2)-β-D-吡喃葡萄糖苷、山奈酚-3-O-β-D-吡喃葡萄糖基-(1→2)-β-D-吡喃葡萄糖苷,第5种物质尚需进一步研究。
2.6 抗癌功能
Li等[41]从巴西红蜂胶的甲醇提取物中分离出42种黄酮类化合物(包括10种黄酮,1种黄酮醇,7种异黄酮,4种二氢异黄酮,4种异黄烷,4种查尔酮,1种黄酮醇,6种紫檀素,3种木酚素,2-芳基苯并呋喃和新黄酮)。并研究其对六种不同癌细胞系的毒性作用(包括小鼠结肠26-l5癌细胞系,小鼠B16-BL6黑色素癌细胞系,小鼠Lewis肺癌细胞系,A549人肺腺癌细胞系,人Hela宫颈癌细胞系,和人HT-1080纤维肉瘤细胞系)。结果显示,7-羟基-6-甲氧基二氢黄酮对B16-BL6、LLC、A549和HT-1080癌细胞系最有效,微尖头酚对LLC和A549癌细胞系最有效。这两种黄酮类化合物可用于日后新抗癌药物的开发。Li等[42]从墨西哥蜂胶的甲醇提取物中分离出三种新黄酮类化合物,并进行体外PANC-1人乳腺癌细胞系毒性评估实验,结果表明,这三种物质对PANC-1都有毒性,可引发PANC-1细胞凋亡。Chen等[43]从台湾蜂胶中分离出两种新的异戊烯基黄烷酮类化合物,命名为propolin A和propolin B,通过研究发现这两种化合物具有较强的自由基清除作用,并且可有效诱导癌细胞凋亡。
3 总结
综上所述,国内外已针对不同种类蜂产品中的黄酮类化合物开发了相应的提取工艺,并围绕其功能活性进行了相应研究。然而,针对蜂产品中黄酮类化合物的提取分离纯化工艺尚且不能够工业扩大化生产,因此进一步开发更加有效的蜂产品中黄酮类化合物提取分离纯化方法以提高黄酮分离效果及其得率是非常必要的。此外,蜂产品因其植物来源、地理来源等条件各异而致其品种多样,且不同品种蜂产品中黄酮类化合物的种类、含量分布有所不同。目前国内外针对蜂产品品种研究不够全面,并且存在许多已知或新型未知的黄酮类化合物在不同品种蜂产品中有待进一步分离鉴定,从而发掘其生物活性为预防或治疗人类各种疾病带来希望。与此同时,对蜂产品中总黄酮及黄酮单体的功能活性研究还需深入,且应采用体外和体内实验相结合的手段来发现蜂产品中黄酮提取物的更多功能活性,并阐明更准确的功能活性作用机制,以应用于各种功能性食品、临床药品等开发,从而保障人类健康。
[1]Nijveldt RJ,van Nood E,van Hoorn DE,et al. Flavonoids:A review of probable mechanisms of action and potential applications[J]. Am J Clin Nutr,2001,74:418-425.
[2]Chantarudee A,Phuwapraisirisan P,Kimura K,et al. Chemical constituents and free radical scavenging activity of corn pollen collected from Apismellifera hives compared to floral corn pollenat Nan,Thailand[J]. BMC Complementary and Alternative Medicine,2012,12:45-57.
[3]Huang S,Zhang C,Wang K,et al. Recent advances in the chemical composition of propolis[J]. Molecules,2014,19:19610-19632.
[4]王正. 蜂胶黄酮的提取及其抗氧化活性的研究[D]. 上海:上海海洋大学,2008.
[5]夏广英. 蜂花粉中总黄酮的提取研究[D]. 福州:福建农林大学,2008.
[6]杨洁,陈纯,邢建军,等. 油菜蜂花粉中黄酮类化合物的提取与鉴定[J]. 食品科学,2010,31(22):273-278.
[7]潘秋月,李英华,周晓红,等. 蜂胶黄酮的超声波提取工艺研究[J]. 蜜蜂杂志,2011,12:10-12.
[8]蔡运涛. 六种蜂产品中黄酮提取纯化及其抗氧化性研究[D]. 福州:福建农林大学,2009.
[9]江津津,黎海彬,韩明,等. 超声热浸-紫外分光光度法测定蜂巢蜜中总黄酮含量[J]. 食品工业科技,2012(8):92-94.
[10]余晶晶,童群义. 超声微波协同萃取蜂胶中黄酮类物质的研究[J]. 食品工业科技,2013(4):314-317.
[11]高荫榆,游海,陈芩,等.蜂胶黄酮类化合物超临界萃取工艺研究[J]. 食品科学,2002,23(8):154-157.
[12]席军. 高压加工技术在蜂胶黄酮类化合物提取中的应用研究[D]. 长春:吉林大学,2005.
[13]王娜. 超高压提取蜂胶黄酮与蜂胶微粉功能特性研究[D]. 杨凌:西北农林科技大学,2009.
[14]曲文娟,王然然,刘书元,等. 不同方法萃取蜂胶的黄酮含量及地区化差异[J]. 食品与发酵工业,2014,40(5):246-251.
[15]李帅. 蜂胶黄酮分离纯化和生物学活性的研究[D]. 长春:吉林农业大学,2012.
[16]王春玲. 蜂胶中芦丁和槲皮素的含量及抗氧化性能研究[J]. 食品研究与开发,2016(1):39-41.
[17]孙丽萍. 蜂花粉中黄酮类化合物的检测及纯化方法的研究[D]. 北京:中国农业科学院,2005.
[18]邢建军,杨洁,郑国伟,等. XAD-2树脂对油菜蜂蜜中黄酮类物质分离条件的优化[J]. 中国蜂业,2010,61(12):9-12.
[19]郑洁. 蜂胶中黄酮类化合物的富集分离研究[D]. 无锡:江南大学,2007.
[20]蔡蕊. 荆条蜂胶化学成分及降糖药物的分析方法研究[D]. 大连:大连理工大学,2012.
[21]蒋丽琴. 毛细管电泳测定蜂胶和银杏叶中10种黄酮[D].天津:天津科技大学,2009.
[22]Piccinelli AL,Campo-Fernandez M,Cuesta-Rubio O,et al. Isoflavonoids isolated from Cuban propolis[J]. J Agric Food Chem,2005,53:9010-9016.
[23]Falcão SI,Vilas-Boas M,Estevinho LM,et al. Phenolic characterization of Northeast Portuguese propolis:Usual and unusual compounds[J]. Anal Bioanal Chem,2010,396:887-897.
[24]Kumazawa S,Goto H,Hamasaka T,et al. A new prenylated flavonoid from propolis collected in Okinawa,Japan[J]. Biosci Biotechnol Biochem,2004,68:260-262.
[25]Li F,He Y,Awale S,et al. Two new cytotoxic phenylallylflavanones from Mexican propolis[J]. Chem Pharm Bull,2011,59:1194-1196.
[26]杜夏. 蜂胶保肝活性成分的分离及其保肝机制初探[D].北京:中国农业科学院,2013.
[27]王馨. 蜂胶黄酮对小鼠N2a细胞缺氧缺糖所致损伤的保护作用及机理研究[D]. 北京:中国农业科学院,2014.
[28]杨明,朱姝,隋殿军,等. 蜂胶总黄酮对大鼠心肌缺血-再灌注损伤的保护作用[J]. 中国药理学通报,2005(4):413-415.
[29]杨明,朱姝,隋殿军,等. 蜂胶总黄酮对大鼠心肌缺血-再灌注损伤诱导细胞凋亡的影响[J]. 中国药理学通报,2005(5):551-554.
[30]葛苗苗. 蜂胶活性成分抗心肌细胞氧化性损伤的作用及机制研究[D]. 福州:福建农林大学,2014.
[31]Bueno-Silva B,Alencar SM,Koo H,et al. Anti-inflammatory and antimicrobial evaluation of neovestitol and vestitol isolated from brazilianred propolis[J]. J Agric Food Chem,2013,61:4546-4550.
[33]王凯,张江临,胡福良. 蜂胶抗炎活性及其分子机制研究进展[J]. 中草药,2013,16:2321-2329.
[34]Wang K,Ping S,Huang S,et al. Molecular mechanisms underlying theinvitroanti-inflammatory effects of a flavonoid-rich ethanol extract from chinese propolis(poplar type)[J]. EvidBased Complement Alternat Med,2013(1):127672.
[35]Wang K,Zhang J,Ping S,et al. Anti-inflammatory effects of ethanol extracts of Chinese propolis and buds from poplar(Populus×canadensis)[J]. J Ethnopharmacol,2014,155:300-311.
[36]Blonska M,Bronikowska J,Pietsz G,et al. Effects of ethanol extract of propolis(EEP)and its flavoneson inducible gene expression in J774A.1 macrophages[J]. J Ethnopharmacol,2004,91:25-30.
[37]平舜,王凯,张江临,等. 茶蜂花粉提取物BPE对LPS诱导的Raw 264.7细胞的体外抗炎症作用研究[J]. 食品与生物技术学报,2015,34(12):1302-1307.
[38]韩彦彬,姚思宇,赵鹏,等. 蜂胶黄酮对小鼠免疫功能影响的实验研究[J]. 中国卫生检验杂志,2009(7):1658-1660.
[39]王爱霞. 不同蜂胶产品的降糖作用研究[D]. 福州:福建农林大学,2011.
[40]孙岩,郭庆兴,童群义. 油菜蜂花粉黄酮体外降糖活性研究[J]. 食品工业科技,2015(12):122-126.
[41]Li F,Awale S,Tezuka Y,et al. Cytotoxic constituents from Brazilian red propolis and their structure-activity relationship[J].Bioorg Med Chem,2008,16:5434-5440.
[42]Li F,Awale S,Tezuka Y,et al. Study on the constituents of Mexican propolis and their cytotoxic activity against PANC-1 human pancreatic cancer cells[J]. J Nat Prod,2010,73:623-627.
[43]Chen CN,Wu CL,Shy HS,et al. Cytotoxic prenylflavanones from Taiwanese propolis[J]. J Nat Prod,2003,66:503-506.
Advance in studies on extraction processand biological activity of flavonoids in bee products
LI Qiang-qiang,WANG Kai,LIANG Xin-wen,WU Li-ming*
(Institue of Agicultural Research,Chinese Academy of Agricultural Sciences,Beijing 100093,China)
Flavonoids,which are abundant in bee products,have versatile biological activities such as anti-bacterial,anti-viral,anti-inflammatory etc.. The flavonoids extracted from bee products can be developed into new types of food,medicines,healthy products,which are beneficial for human health. This article reviewed recent extraction and separation processes and related researches on the biological activity of flavonoids in bee products,designed to provide some technical supports for future studies.
bee products;flavonoids;extraction processes;separation and identification;biological activities
2016-12-02
李强强(1991-),女,博士研究生,从事蜂产品质量安全研究,E-mail:qiangqiangli1991@163.com。
*通讯作者:吴黎明(1973-),男,博士,研究员,从事蜂产品质量安全研究,E-mail:apiswu@126.com。
现代农业产业技术体系(CARS45-KXJ8);中国农业科学院科技创新工程(CAAS-ASTIP-2016-IAR)资助。
TS201.1
A
1002-0306(2017)13-0339-06
10.13386/j.issn1002-0306.2017.13.064

