接骨草总黄酮提取工艺及其抑菌作用的研究
黄国文,管天球,赵雨云,陈莫林,刘宏辉
(湖南科技学院生化系,湖南永州 425199)
接骨草总黄酮提取工艺及其抑菌作用的研究
黄国文,管天球,赵雨云,陈莫林,刘宏辉
(湖南科技学院生化系,湖南永州 425199)
以碱溶酸沉法研究接骨草总黄酮的提取条件和抑菌作用。以料液比、温度、时间、提取液pH为影响因素,进行单因素实验和正交实验,研究提取接骨草总黄酮的最优条件,调节提取液pH来沉淀总黄酮,并用比浊法和滤纸圆片法研究总黄酮的抑菌作用。结果表明,提取接骨草总黄酮的最优条件是料液比1∶40 (g/mL)、温度为80 ℃、时间为45 min、提取液pH10,此条件下接骨草总黄酮的得率为3.11%。调节总黄酮提取液pH3.5沉淀接骨草总黄酮的量较多,其得率为2.15%。接骨草总黄酮在酸性pH4~5时对金黄色葡萄球菌、枯草芽孢杆菌和大肠杆菌的抑制作用较强,并能够增加三种细菌的电导率,对三种菌最小抑菌浓度分别为0.63、1.25、2.50 mg/mL。用碱溶酸沉法提取接骨草总黄酮的工艺简单,总黄酮具有较高的抑菌活性,为进一步开发接骨草的总黄酮打下了基础。
接骨草,总黄酮,提取工艺,抑菌作用
接骨草(SambucuschinensisLindl)为忍冬科接骨木属多年生草本或半灌木植物[1],产于陕西、河南、湖南、贵州、云南等省区的路旁和林缘等地。茎无毛有棱;叶片无柄,椭圆形;雌雄异株,花期4~5月,果熟期8~9月。全草药用,有活血散瘀、祛风湿功效,能治疗风湿痹痛、肾炎、脚气、慢性气管炎、跌打损伤、骨折等疾病[2]。接骨草含有很多生物活性物质,已经分离出黄酮类、三萜、甾体、酚酸、挥发油和苯丙素类等50多个化合物,其中,黄酮类主要以黄酮醇为主,具有由两个羟基的苯环通过中央三个碳原子连接而成的母核,母核上羟基的氢原子可以被不同糖苷中的半缩醛羟基取代生成不同的黄酮苷[3]。植物中黄酮类化合物的含量与植物的木质化程度有关,存在于微管植物中[4],特别在植物的叶和花等器官中含量较高[5-6],黄酮类化合物具有保护心血管系统[7]、抗氧化[8]、抗菌[9-10]、抗病毒、抗肿瘤、杀虫等作用[11-12],是保健食品的一种活性成分[13]。接骨草可以用于外敷、内服,炮制的接骨草药茶含有较多的黄酮类物质[14]。接骨草黄酮的抗氧化作用已有报道[15],其抗菌作用报道较少,因此,有必要研究接骨草总黄酮提取及其抑菌作用。黄酮类化合物的提取方法有热水提取、有机溶剂提取、碱溶酸沉、超声波辅助提取、半仿生法、酶解、超临界CO2萃取法等[16-17]。目前报道,用80%乙醇提取的接骨草成分含有槲皮素为苷元的黄酮醇,总黄酮含量为41.43 mg/g[18];用超声辅助50%乙醇提取接骨草黄酮,其得率为8.352 mg/g[15]。与有机溶剂浸提和超声辅助浸提法相比,碱溶酸沉法提取黄酮类物质的得率低,但是具有设备简单、操作方便、无环境污染、不使用有机溶剂、生产成本低廉等优点[19-21]。本文采用碱溶酸沉法研究接骨草总黄酮的提取条件,并研究其对大肠杆菌、枯草芽孢杆菌和金黄色葡萄球菌的抑菌作用,为开发和利用接骨草总黄酮打下基础。
1 材料与方法
1.1 材料与仪器
在湖南科技学院周围的西山林缘于2015年11月份采集接骨草地上部分,在100 ℃杀青后烘干粉碎成粉末。按1∶8 (g/mL)比例加入石油醚,80 ℃回流60 min,过滤除去脂溶性成分,取干燥后的滤杂来提取总黄酮。供试菌种(大肠杆菌Escherichiacoli、金黄色葡萄球菌Staphylococcusaureus、枯草芽孢杆菌Bacillussubtilis) 由湖南科技学院微生物实验室提供。试剂:芦丁,琼脂粉,蛋白胨,牛肉膏,氯化钠,硝酸铝,亚硝酸钠,氢氧化钠等均为分析纯 均购于国药集团。
HH三用恒温水箱 江苏国盛实验仪器厂;TG16G型离心机 上海赵迪生物科技有限公司;DHG-9070AS型新型电热恒温鼓风干燥箱 宁波江南仪器厂;AUY120型电子分析天平 日本岛津;H722B可见分光光度计 天津市拓普仪器有限公司;DDS-11A上海雷磁电导率仪 上海右一仪器有限公司。
1.2 实验方法
1.2.1 提取接骨草总黄酮条件的研究
1.2.1.1 提取接骨草总黄酮的单因素实验 以碱性pH溶液(用10% NaOH调节成的水溶液)为溶剂用浸提法来提取接骨草总黄酮,固定提取条件:提取时间60 min,温度60 ℃,料液比1∶40 (g/mL)和浸提pH10。改变因素料液比为1∶10、1∶20、1∶30、1∶40、1∶50 (g/mL),提取液pH8、9、10、11、12,温度为60、70、80、90、100 ℃,时间为30、45、60、75、90 min。将各条件下提取的总黄酮溶液离心(6000 r/min,10 min),取上清液测定总黄酮含量。对四次生物学重复实验结果作图分析,并用SPSS软件进行方差分析和LSD法进行多重比较,确定各因素的适合水平。
1.2.1.2 正交实验 根据单因素实验结果,设计正交因素水平表(表1),通过L9(34)正交表安排实验,对结果进行极差分析和方差分析,优化总黄酮的提取条件。
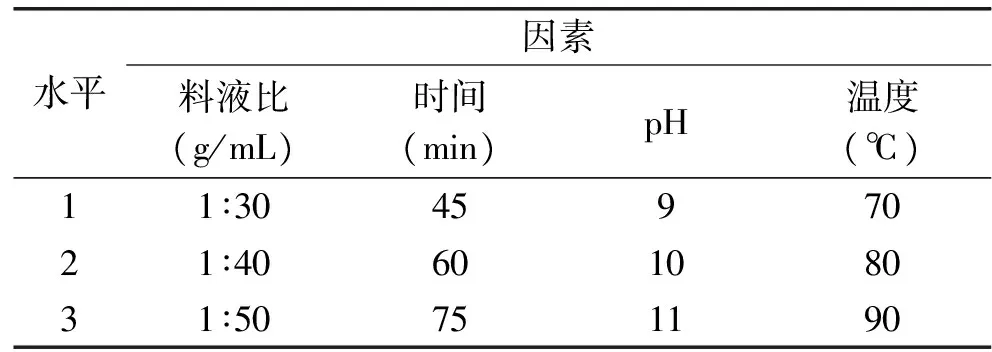
表1 提取接骨草总黄酮的正交实验设计表Table 1 Orthogonal experiment design of the extraction of total flavonoids of Sambucus chinensis Lindl
1.2.2 pH沉淀总黄酮 准确称取5份烘干后的接骨草粉末各10.0 g,脱脂后按照最佳提取条件提取总黄酮。待材料浸出液冷却后,离心(6000 r/min,10 min)收集上清液。分别缓慢滴加浓盐酸调pH为2、3、4、5,静置过夜,离心(3500 r/min,15 min),收集沉淀,沉淀物用乙醚洗涤2次后再用蒸馏水洗涤2次,60 ℃干燥后称量其总黄酮质量,计算其得率。

1.2.3 制作芦丁标准曲线 用30%乙醇配制0.10 mg/mL[22]的芦丁标准溶液100 mL。在6个10 mL容量瓶中分别加入芦丁标准溶液0、0.1、0.2、0.3、0.4、0.5 mL。各加入0.3 mL 5%亚硝酸钠溶液,摇匀后放置6 min,加入0.3 mL10%硝酸铝溶液,摇匀后放置6 min,加入4.0 mL 4%氢氧化钠溶液,再用30%乙醇定容,摇匀后放置10 min。以没有加入芦丁标准溶液的混合溶液为空白参比,在波长400~600 nm之间测定各样品的吸收光谱,确定最大吸收波长为510 nm[23]。经过实验,芦丁标准曲线为Y=0.119X-0.0182,R2=0.9994,式中Y为吸光度,X为芦丁的质量浓度(mg/mL)。
1.2.4 总黄酮含量测定方法 根据芦丁的标准曲线测定方法测定接骨草提取液的总黄酮浓度,再计算黄酮的得率。总黄酮的得率=(CV/103W)×100%,式中:W为接骨草干粉的质量(g),C为提取液的浓度(mg/mL),V为提取液的体积(mL)。其值表示生物学重复样品三次测定的平均值±SD。
1.2.5 菌悬液的制备方法 在超净工作台中,在牛肉膏蛋白胨固体培养基上,对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌等细菌分别划线培养(37 ℃,24 h),用接种环挑取一个菌落接种到液体培养基中,37 ℃振荡培养(200 r/min,24 h)。菌液用无菌水稀释到吸光度为0.6~0.8时,用于抑菌研究。
1.2.6 不同浓度的接骨草总黄酮对三种菌的抑制作用 用滤纸圆片法。将最佳提取条件和最优pH沉淀条件下制备的接骨草总黄酮用蒸馏水溶解,配制成浓度为0.31、0.63、1.25、2.5、5.0、10 mg/mL的溶液,浸泡滤纸圆片(直径6 mm)1 h。在牛肉膏蛋白胨固体培养基上加入200 μL菌悬液,用涂布棒涂匀菌液并干燥。用无菌镊子夹取滤纸圆片贴在含菌培养基表面,每个培养皿上放置3个处理滤纸片和1个水处理的滤纸圆片(阴性对照),置于37 ℃下培养24 h,测量抑菌圈直径。
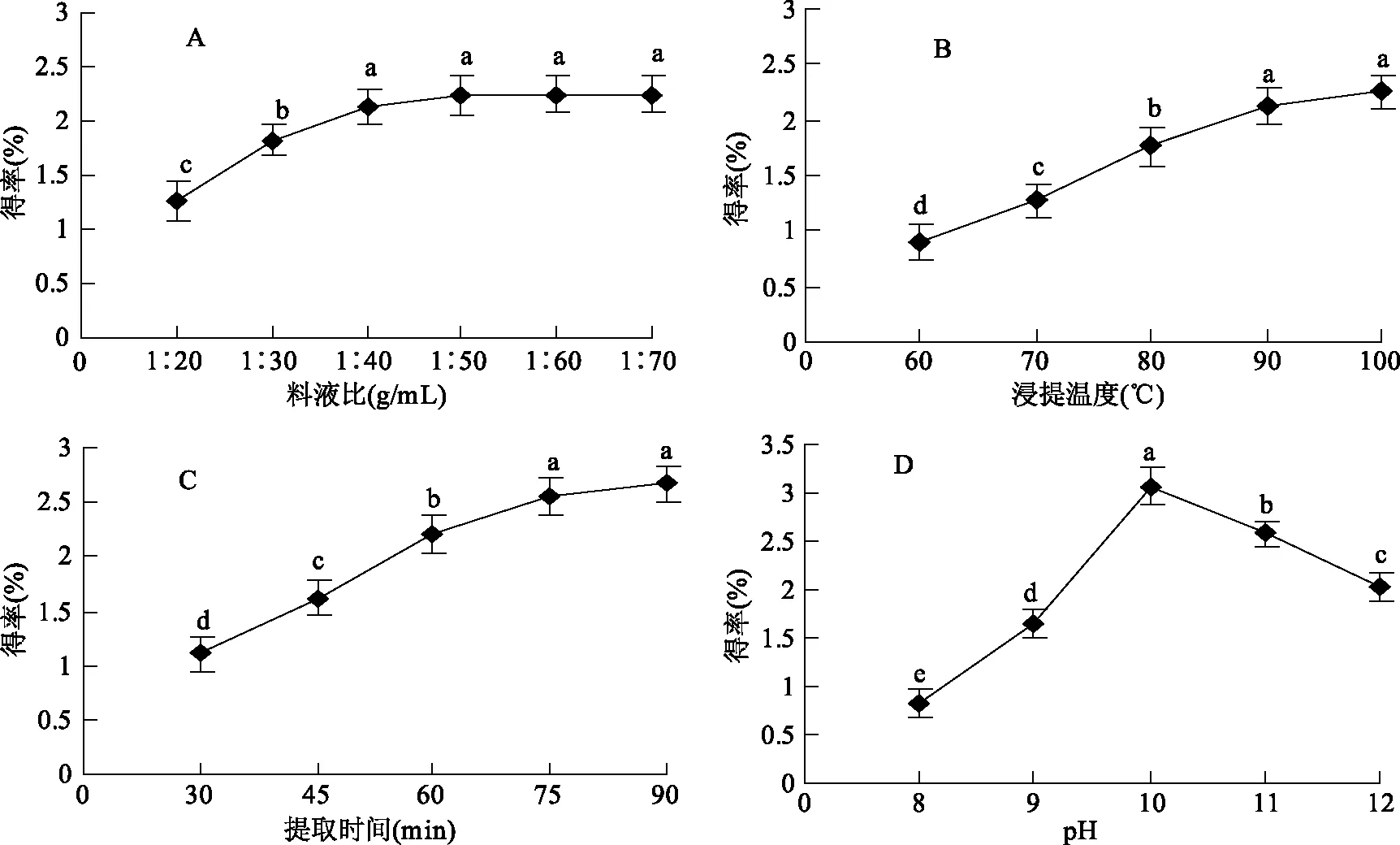
图1 提取条件对接骨草总黄酮得率的影响Fig.1 Effects of extracting conditions on the extracting rate of total flavonoids of Sambucus chinensis Lindl注:不同字母表示差异显著(p<0.05)。
1.2.7 不同作用时间的接骨草总黄酮对三种菌抑制作用 用比浊法。在无菌状态下,向5 mL的牛肉膏蛋白胨液体培养基里加入菌悬液200 μL,并加入一定浓度的接骨草总黄酮。于37 ℃摇床里振荡培养(200 r/min),以培养液作为对照,在600 nm下测定细菌悬液的吸光度(A)。每个菌设定3个生物学重复,每培养2 h测定各个重复样品3次,求平均值,计算抑菌率,计算公式如下:
抑菌率(%)=(菌悬液的吸光度-含有总黄酮的菌悬液的吸光度)/菌悬液的吸光度×100
1.2.8 不同pH接骨草总黄酮对三种菌抑制作用 用滤纸圆片法。称取一定量的接骨草总黄酮5份,分别加入到用0.1 mol/L HCl和0.1 mol/L NaOH配制成的pH为4、5、6、7、8的溶液中,配成总黄酮质量体积浓度10%(g/mL),混匀。将滤纸圆片浸泡到总黄酮溶液中1 h,取出沥干后贴在含菌培养基表面,每个培养皿上放置3个滤纸片,置于37 ℃培养24 h,测量抑菌圈直径。
1.2.9 电导率的测定 取18只大试管,分别加入5 mL牛肉膏蛋白胨培养基和200 μL OD600为0.6~0.8的三种细菌培养物以及10%总黄酮提取物。其中三个试管只加入蒸馏水代替总黄酮作为对照组。将试管放在200 r/min,37 ℃条件下振荡培养0、1、2、3、4、5 h。分别测定培养液的电导率值,从电导率变化趋势来说明菌膜的完整性。
2 结果与分析
2.1 接骨草总黄酮的提取条件
2.1.1 料液比对接骨草总黄酮得率的影响 料液比对总黄酮得率有显著影响(图1A),随着料液比的增加,接骨草总黄酮的得率逐渐增加,当料液比达到1∶40 (g/mL)以后,总黄酮得率增加较少。可能原因是一定体积的溶剂能够增加死细胞内的蛋白质和多糖等物质的溶胀作用,引起细胞膜的通透性增加或者膜破裂,从而溶解并释放出接骨草总黄酮,再增加溶剂的体积总黄酮量也很难增加。方差分析结果表明料液比对总黄酮得率有重要影响,选择1∶30、1∶40、1∶50 (g/mL)料液比作为优化条件。
2.1.2 提取温度对接骨草总黄酮得率的影响 提取温度明显影响总黄酮得率(图1B),随着温度增高总黄酮得率逐渐增高,但90 ℃之后得率增加相对不多,表明在一定的温度范围内,较高温度能够疏松或破碎细胞壁而使黄酮容易渗出;过高的温度(100 ℃)虽然会破坏更多的细胞壁和渗出更多黄酮,但是也引起溶剂蒸发和破坏黄酮结构,导致总黄酮增加不多,并且增加了耗能。方差分析结果表明,提取温度对总黄酮得率有重要影响,选择70、80、90 ℃作为优化条件。
2.1.3 提取时间对接骨草总黄酮得率的影响 提取时间对总黄酮的得率有明显影响(图1C),随提取时间增加,接骨草总黄酮得率逐渐增高,但75 min之后,黄酮得率的增加量不明显,可能是大部分总黄酮已经完全溶解。另外,提取的时间越长,提出的杂质就越多[24],也不利于后续分离纯化。方差分析结果表明,提取时间对总黄酮得率有重要影响,选择45、60、75 min作为优化条件。
2.1.4 pH对接骨草总黄酮得率的影响 提取液pH对总黄酮得率有较大影响(图1D)。在pH10.0时提取效果最好,在pH10.0之前随着pH增大得率相应提高,但在pH10.0之后随着pH增大得率反而逐渐降低。说明过高pH可能引起黄酮结构的破坏,导致得率下降[25]。方差分析结果表明,pH对总黄酮得率有重要影响,选择pH为9、10、11作为优化条件。
2.1.5 提取接骨草总黄酮的正交实验 根据单因素实验结果,选择料液比、浸提温度、浸提时间和浸提液pH这四个因素,以正交表为(L9(34))安排实验。结果见表2和表3。
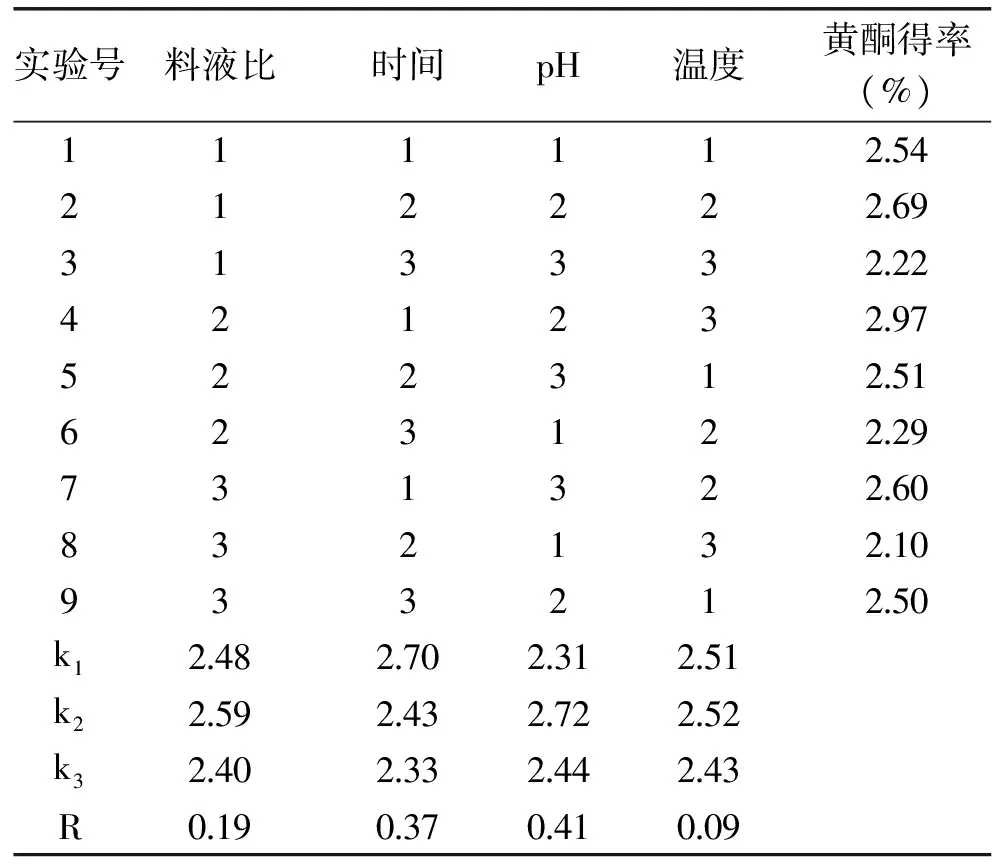
表2 提取接骨草总黄酮的正交实验结果和极差分析Table 2 L9(34)experimental results and analysis of extracting total flavonoids of Sambucus chinensis Lindl
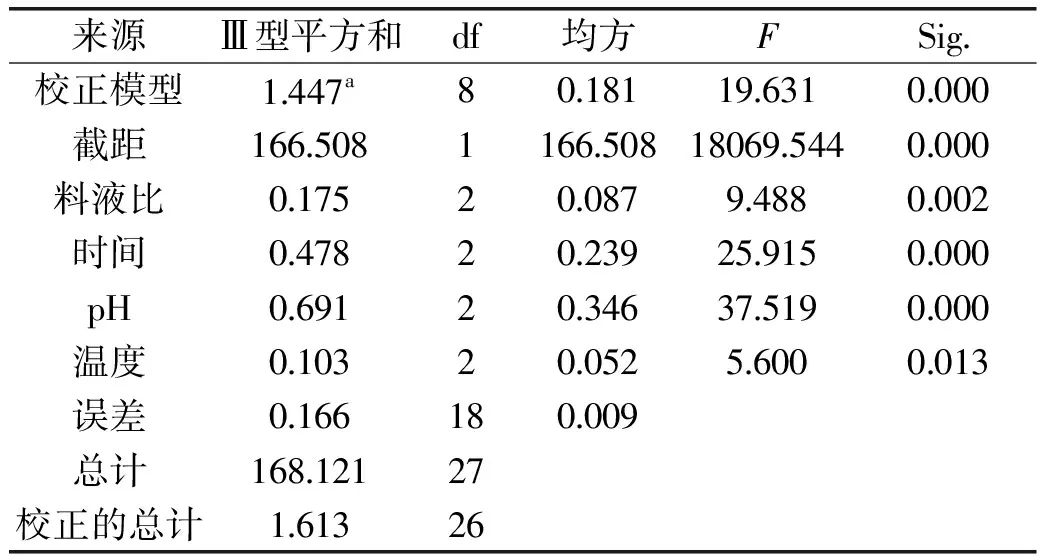
表3 提取接骨草总黄酮的正交实验结果方差分析表Table 3 Mean standard deviation analysis of L9(34)experimental results of extracting total flavonoids of Sambucus chinensis Lindl
注:a.R2=0.897(调整R2=0.851)。
分析接骨草总黄酮的提取结果(表2和表3),影响提取接骨草总黄酮的因素顺序为浸提液pH>提取时间>料液比>提取温度,表明提取液pH是影响接骨草总黄酮提取的主要因素。提取接骨草总黄酮的最佳条件是浸提液pH10,提取时间为45 min,料液比为1∶40 (g/mL)、提取温度为80 ℃。
2.2 验证结果
称取接骨草粉末20.0 g三份,按照总黄酮的最佳提取条件提取黄酮,分别测定总黄酮含量,计算总黄酮得率的平均值为3.11%。
2.3 酸沉pH对接骨草总黄酮得率的影响
以提取总黄酮的最佳工艺条件提取脱脂后(可以去除脂溶性物质如色素和磷脂等)接骨草粉末中的总黄酮,提取液经过用浓盐酸调酸性pH来沉淀总黄酮,测定酸性pH沉淀接骨草总黄酮的得率(图2)。结果表明,在调节成pH3.5的溶液中沉淀的总黄酮含量较大。此后,调节的pH越大,沉淀的黄酮含量越少。说明不同类型的黄酮化合物在酸性过强的溶液中生成烊盐而析出[26]。用酸沉pH3.5溶液来沉淀接骨草总黄酮,其得率2.15%。比较最佳提取条件下提取的总黄酮得率3.11%,pH3.5溶液来沉淀接骨草总黄酮得率少,说明提取液中还有部分黄酮没有成盐析出。
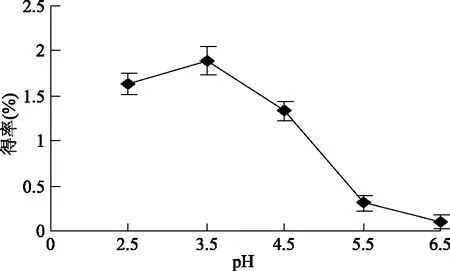
图2 酸性pH对接骨草总黄酮得率的影响Fig.2 Effects of pH on extracting rate of total flavonoids of Sambucus chinensis Lindl
2.4 接骨草总黄酮的抑菌作用
2.4.1 不同浓度接骨草总黄酮对三种细菌生长的影响 以pH3.5沉淀提取液得到的总黄酮,用无菌水溶解,配制成浓度为0.31、0.63、1.25、2.5、5.0、10 mg/mL的溶液,检测其抑菌作用(图3)。表明,随着浓度的增大,接骨草总黄酮对这三种细菌的抑制作用逐渐增强;对照组无抑菌作用。根据抑菌圈明显大于6 mm有抑菌性,接骨草总黄酮对金黄色葡萄球菌的抑制作用最强,最小抑菌浓度约为0.63 mg/mL;对枯草芽孢杆菌的抑制作用较强,最小抑菌浓度约为1.25 mg/mL;对大肠杆菌的抑制作用较弱,最小抑菌浓度约为2.5 mg/mL。因此,接骨草总黄酮对革兰氏阳性菌枯草芽孢杆菌和金黄色葡萄球菌的抑菌作用较强,对革兰氏阴性菌大肠杆菌的抑菌作用较弱。可能是与这两种菌的细胞壁不同有关。革兰氏阳性菌的细胞壁主要是由肽聚糖和磷壁酸组成的,结构简单;而革兰氏阴性细菌的细胞壁除了含有少量肽聚糖以外,还含有蛋白质、类脂质、脂多糖等成分,使得阳性菌对理化因子的敏感性强于阴性菌[27]。
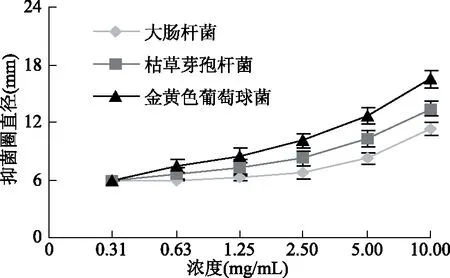
图3 不同浓度接骨草总黄酮对三种菌抑制作用Fig.3 Inhibition of different concentrations of total flavonoids of Sambucus chinensis Lindl on the three bacteria fruit
2.4.2 不同作用时间接骨草总黄酮对三种细菌生长的影响 在液体培养基中加入10%接骨草总黄酮来培养细菌以研究对三种菌的抑制作用。结果表明,随着培养时间的增长,接骨草总黄酮对三种菌的抑制作用逐渐增强,并且抑菌强弱为金黄色葡萄球菌>枯草芽孢杆菌>大肠杆菌,在处理10 h以后对金黄色葡萄球菌的抑菌率达到100%(图4)。由于黄酮类物质通过抑制细菌细胞壁和细胞膜的合成、抑制细菌的能量代谢和核酸合成起作用[10],这种作用不是瞬时就可以完成,因此随着作用时间延长抑菌率逐渐增加。
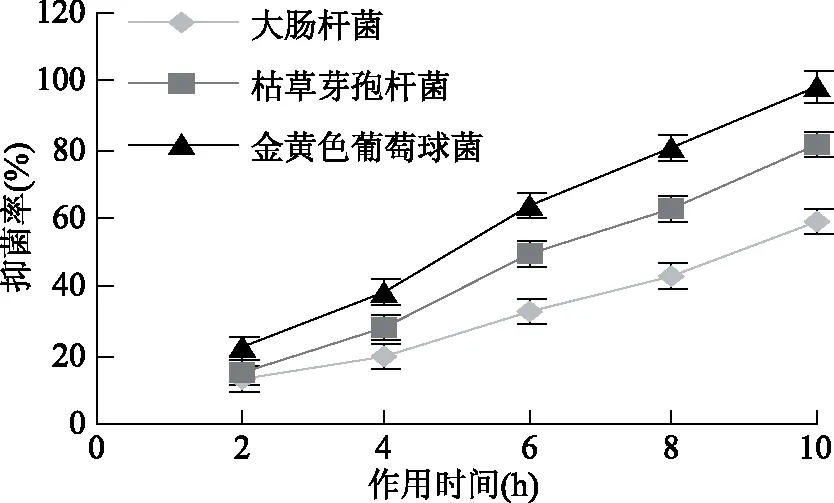
图4 接骨草总黄酮不同处理时间对三种菌的抑制作用Fig.4 Inhibiton of total flavonoids of Sambucus chinensis Lindl of diffrent incubation times on the three bacteria
2.4.3 不同pH接骨草总黄酮溶液对三种细菌的抑制作用 测定不同pH的10%接骨草总黄酮溶液对三种菌的抑制作用(图5)。结果表明,在pH4~5时接骨草总黄酮对这三种菌都有较强抑制作用,在pH6以后抑菌作用大幅度降低,在pH8时抑菌作用很弱了。可能是由于大多数黄酮化合物含有酚羟基呈酸性,在酸性溶液中结构稳定,在强碱性条件下可能会破坏其母核[28],因而降低了其抑菌活性。
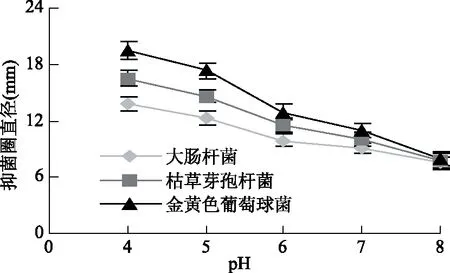
图5 不同pH接骨草总黄酮对三种菌的抑制作用Fig.5 Inhibition of total flavonoids of Sambucus chinensis Lindl of different pH on the three bacteria
2.4.4 接骨草总黄酮对三种细菌细胞膜通透性的影响 为了检测接骨草总黄酮处理条件下细菌细胞膜的完整性,用10%的接骨草总黄酮提取物培养三种菌一段时间测量其电导率。表明,随着培养时间的延长,三种菌液的电导率都增加(图6)。结果说明,接骨草总黄酮破坏了三种菌的细胞膜,导致细菌细胞质的电解质外渗,破坏细胞结构,从而产生了抑菌作用[29]。与对照相比,在培养5 h时,菌液的电导率以金黄色葡萄球菌的增加的幅度最多,而大肠杆菌培养液的电导率增加的最少,枯草芽孢杆菌的电导率增加的幅度居中。因此,接骨草总黄酮对菌膜的伤害作用以金黄色葡萄球菌的最强,枯草芽孢杆菌次之,大肠杆菌的最差。
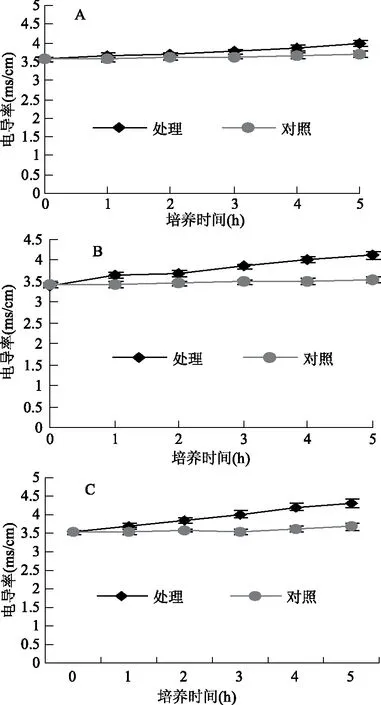
图6 接骨草总黄酮对三种菌电导率的影响Fig.6 Effects of total flavonoids of Sambucus chinensis Lindl on the electrical conductivity of the three bacteria注:A:大肠杆菌;B:枯草芽孢杆菌;C:金黄色葡萄球菌。
3 结论
本文用碱溶酸沉法研究了接骨草总黄酮的提取条件,确定了碱提工艺的最优条件为浸提液pH10,提取时间45 min,料液比1∶40 (g/mL)、温度为80 ℃;在这种条件下接骨草总黄酮的得率为3.11%。最优提取工艺条件下的接骨草总黄酮提取液经过用浓盐酸调节pH3.5时能够沉淀2.15%的总黄酮。用碱溶酸沉法提取的接骨草总黄酮抑制金黄色葡萄球菌作用最强、抑制枯草芽孢杆菌的作用较强、抑制大肠杆菌的作用较弱,其最小抑菌浓度分别是0.63、1.25、2.50 mg/mL。接骨草总黄酮对这三种菌的抑制作用随着处理时间(0~10 h)的延长逐渐增强,在处理时间为10 h时对金黄色葡萄球菌的抑菌率可以达到100%,同时引起三种菌的电导率增加。接骨草总黄酮在酸性pH时对这三种菌都有抑制作用,且在pH4~5时抑制作用强,在碱性pH8时抑制作用很弱。由于接骨草总黄酮具抑菌作用,所以,接骨草总黄酮用于食品的保鲜防腐有待于研究。这种研究为进一步开发和利用接骨草总黄酮提供了积极的指导作用。
[1]马养民,吴昊.接骨木属植物的化学成分研究进展[J].有机化学,2012,32:2063-2072.
[2]方建新.接骨草的开发利用[J].中国林副特产,2007(6):85-86.
[3]姚元枝,伍贤进,黎晓英,等.接骨草的化学成分与药理活性研究进展[J].中成药,2015,37(12):2726-2732.
[4]王长远,吴洪奎,于长青,等.黄酮类化合物研究进展[J]. 黑龙江八一农垦大学学报,2007,19(2):75-78.
[5]朱文振,马龙,李国荣.黄酮类化合物的抗癌作用及作用机制[J].生命科学,2012,24(5):444-449.
[6]何佳珂,于洋,陈西敬,等.黄酮类化合物的药物代谢研究进展[J].中国中药杂志,2010,35(21):2789-2794.
[7]胡彦武,刘凯,闫梦彤,等.淫羊藿总黄酮及淫羊藿苷的心血管保护作用及机制研究进展[J].中国实验方剂学杂志,2015(13):227-230.
[8]Wang LJ,Yang XS,Qin PY,et al. Flavonoid composition,antibacterial and antioxidant properties of tartary buckwheat bran extract[J].Industrial Crops and Products,2013,49:312-317.
[9]邓红梅,马超. 皇帝柑皮中粗黄酮的提取及其抑菌活性研究[J]. 食品工业,2013(1):21-24.
[10]柯春林,任茂生,王娣,等.黄酮化合物抗菌机理的研究进展[J].食品工业科技,2015,36(2):388-391.
[11]魏良柱,李筱玲.黄酮类化合物药理活性研究进展[J].陕西农业科学,2014,60(12):52-56.
[12]Kumar S,Pandey AK. Chemistry and biological activities of flavonoids:an overview[J].Science World Journal,2013. doi:10.1155/2013/162750.
[13]耿敬章,冯君琪.黄酮类化合物的生理功能与应用研究[J]. 中国食物与营养,2007(7):62-65.
[14]熊燕,姚元枝,安晓刚,等.接骨草药茶的炮制及黄酮类化合物含量的比较[J].中国民族医药杂志,2013(9):53-55.
[15]李伟.接骨草黄酮类物质超声提取工艺优化及其抗氧化活性[J].中药材,2011,34(11):1789-1791.
[16]刘宁,朱沛沛,李嘉乐.黄酮类化合物提取工艺研究进展[J].饮料工业,2012,15(7):7-9.
[17]Pan GY,Yu GY,Zhu CH,et al.Optimization of ultrasound-assisted extraction(UAE)of flavonoids compounds(FC)from hawthorn seed(HS)[J]. Ultrasonics Sonochemistry,2012,19:486-490.
[18]蔡凌云.接骨草黄酮成分的初步研究[J]. 凯里学院学报,2010,28(6):62-64.
[19]陈继光,米丽雪,上官新晨,等.青钱柳愈伤组织总黄酮碱溶酸沉提取工艺[J].食品科学,2011,32(16):103-107.
[20]田哲榕,侯先槐.干豌豆中皂苷与黄酮类化合物含量研究[J].忻州师范学院学报,2011,27(2):128-130.
[21]Li XN,Huang JL,Wang ZD,et al.Alkaline extraction and acid precipitation of phenolic compounds from longan(Dimocarpus longan L.)seeds[J]. Separation and Purification Technology,2014,124:201-205.
[22]赵洪,杨颖,黎李.碱溶液提取竹叶总黄酮工艺的初步研究[J].山东化工,2015,44:58-59,62.
[23]唐红军.中国药典2000年版一部检测芦丁含量方法的改进[J].中国医院药学杂志,2002,22(1):60.
[24]赵文红,范青生,马永花,等.杜仲叶中总黄酮的醇提工艺[J].南昌大学学报(理科版),2007,31(1):69-72.
[25]张雁,池建伟,张名位,等.新鲜葛根中总黄酮和淀粉的提取工艺研究[J].中国食品学报,2008,8(3):73-77.
[26]盛玉青,侍海娇,邓晓亚,等. 大孔吸附树脂纯化凤尾草总黄酮工艺研究[J].现代中药研究与实践,2014,28(6):52-55.
[27]郑津辉,王威,黄辉.苦参提取液中黄酮类化合物的抑菌作用[J].武汉大学学报(理学版),2008,54(4):439-442.
[28]许明,韩亮,李艳琴,等.苦荞黄酮类化合物的稳定性研究[J].食品与药品,2012(9):305-308.
[29]陈国妮,孙飞龙,闫亚茹,等.马齿苋黄酮类化合物抑菌机理的研究[J].化学与生物工程,2015,32(10):34-37.
Study on the extraction and antibacterial effect oftotal flavonoids fromSambucuschinensisLindl
HUANG Guo-wen,GUAN Tian-qiu,ZHAO Yu-yun,CHEN Mo-lin,LIU Hong-hui
(Department of Biological Sciences and Chemical Engineerings,Hunan College ofScience and Technology,Yongzhou 425199,China)
By using alkali soluble and acid sinking method,total flavonoids ofSambucuschinensisLindlwere extracted,and its antibacterial effect were studied in this paper. The extraction conditions including solid-liquid ratio,extraction temperature,extraction time,pH of xetraction liquid of flavonoids fromSambucuschinensisLindlwere optimized by single factor experiments and orthogonal experiments,and meanwhile the sinking efficiency of total flavonoids were studied by acidic pH precipitation,and the antibacterial activity of total flavonoids was studied by filter paper discs method and turbidimetric method. The results showed that the optimum extraction conditions of total flavonoids ofSambucuschinensisLindlwere as follow:solid-liquid ratio 1∶40 (g/mL),extraction temperature 80 ℃,extraction time 45 min,extraction liquid pH10,in which the extraction rate of total flavonoids ofSambucuschinensisLindlwas 3.11%. Adapting the extract to pH3.5 with HCl could better precipitate about 2.15% total flavonoids ofSambucuschinensisLindl. Total flavonoids ofSambucuschinensisLindlhad a stronger antibacterial activity onStaphylococcusaureus,Bacillussubtilis,Escherichiacoliat acidic pH4~5 than at neutral pH and alkaline pH value,and these bacteria conductivity was increased by total flavonoids. The minimum inhibitory concentration of total flavonoids ofSambucuschinensisLindlon three bacteria were 0.63,1.25,2.50 mg/mL,respectively. The extracting process of total flavonoids fromSambucuschinensisLindlby using alkali soluble and acid sinking method was simple and inexpensive,and its total flavonoids had a great antibacterial activity,in which played a foundation on the development and utilization of total flavonoids ofSambucuschinensisLindl.
SambucuschinensisLindl;flavonoids;extraction process;antibacterial effect
2016-12-29
黄国文(1965-),男,博士,讲师,从事植物生物学的教学和研究工作,E-mail:huanggwdax@163.com。
湖南省科技计划项目(2014NK2021);湘南优势植物资源综合利用湖南省重点实验室资助项目(XNZW15C19)。
TS201.3
A
1002-0306(2017)13-0036-06
10.13386/j.issn1002-0306.2017.13.007

