玄参中化学成分的分离鉴定及其降糖活性研究
田金凤,尚远宏,李学刚
(1.攀枝花学院干热河谷特色生物资源研发四川省高校重点实验室,四川攀枝花 617000;2.西南大学 药学院 重庆市药效评价工程技术研究中心,重庆 400716)
玄参中化学成分的分离鉴定及其降糖活性研究
田金凤1,2,尚远宏1,李学刚2,*
(1.攀枝花学院干热河谷特色生物资源研发四川省高校重点实验室,四川攀枝花 617000;2.西南大学 药学院 重庆市药效评价工程技术研究中心,重庆 400716)
本文探讨分离玄参的化学成分,并研究玄参中分离出的化合物在 HepG2 细胞中降糖作用的影响。采用渗滤提取,结合大孔树脂、硅胶柱层析、HSCCC色谱等分离方法,NMR波谱数据鉴定结构,MTT法检测HepG2细胞活力,试剂盒检测细胞消耗的葡萄糖。结果表明,分离出玄参中9个化合物:类叶升麻苷(1)、升麻素苷(2)、桃叶珊瑚苷(3)、哈巴苷(4)、蔗糖(5)、肉桂酸(6)、哈巴俄苷(7)、安格洛苷C(8)、二十七烷(9)。在0.1~2.5 μg/mL浓度范围内,哈巴俄苷在HepG2细胞中降糖活性最好。其中,二十七烷为首次从该属植物中分离得到,化合物7是一个潜在的降糖化合物,值得进一步研究和开发。
玄参,分离鉴定,降糖活性,哈巴俄苷
玄参为玄参科植物玄参(ScrophularianingpoensisHemsl.)的干燥根,且为药食两用的药材,其中环烯醚萜类和苯丙素苷类是玄参属植物的主要化学成分[1],药理研究表明其具降压、抗血小板聚集、增强免疫功能、降血糖、抗氧化和抗肿瘤等作用[2]。
糖尿病属于代谢疾病,其主要表现为肝脏及其肌肉、脂肪组织等对葡萄糖的摄取存在障碍,以及肝脏葡萄糖输出增多,使血液中的葡萄糖无法正常进入细胞,导致人体血糖升高的一种疾病[3]。传统中医对糖尿病的记载和治疗有着悠久的历史,各种中药被广泛用于糖尿病的治疗。现在,从传统中药方剂中筛选单味药,再从中分离降糖活性成分已成为糖尿病治疗药物的研究热点[4-5]。Kim等[6]发现丹东玄参和S.borealikoreanaNakai.对晶状体醛糖还原酶的抑制作用要明显强于S.takesimensisNakai.和北玄参。张宁等[7]探讨了玄参及其各组分(粗分的提取物)对糖尿病大鼠的降血糖作用,发现玄参水煎液组和大/小环烯醚萜苷组对高脂饲料喂养并结合小剂量STZ注射所导致的2型糖尿病大鼠具有降血糖作用。但关于玄参及其分离的单体的降血糖药理作用及其机制研究的文献尚未见相关报道,因此本部分实验为了能更好的开发利用玄参药食两用的价值,以南川区为来源地的玄参为研究对象,采用大孔树脂、硅胶、Sephadex LH-20等[8]色谱技术进行提取分离纯化,通过波谱数据进行分析和结构鉴定其化学成分,并以HepG2细胞高糖模型来研究其降糖活性,为进一步研究玄参降糖药效和开发奠定了基础。
1 材料与方法
1.1 材料与仪器
玄参来源于重庆南川区。玄参根经西南民族大学化学与环境保护工程学院刘圆教授鉴定为ScrophularianingpoensisHemsl.的根。Sephadex LH-20 上海浩然生物技术有限公司;D101大孔树脂、柱层析用硅胶(100~200目)和薄层层析硅胶板GF254 青岛海洋化工厂;HepG2细胞株 第三军医大学现代高血压研究所;胰蛋白酶、MTT Sigma公司;EDTA 鼎国生化试剂公司;葡萄糖酶法测定试剂盒、RPMI-1640细胞培养基 南京建成生物工程研究所;青、链霉素 Hyclone公司;特级胎牛血清 Gibco公司;48孔板、96孔板 Corning公司;其它试剂均为分析纯。
YP6000N电子天平 上海精密仪器科技有限公司;玻璃层析柱 上海亚荣生化仪器厂;AM-500M核磁共振仪 瑞士Bruker公司;TOMY SS-325灭菌锅 TOMY KOGYO有限公司;EOS BRAVO全自动生化分析仪 上海安泰分析仪器有限公司;BioTek ELx808全自动酶标读数仪 美国伯乐公司;超净工作台 苏州金燕净化设备有限公司;二氧化碳培养箱 上海跃进医疗仪器厂;HHW-21CU-600B恒温水浴锅 上海福玛实验设备有限公司;AVANTI J-30I高速冷冻离心机 BECKMAN公司。
1.2 提取与分离
1.2.1 玄参的大孔树脂提取 取6 kg干燥的玄参根,切片粉碎,在渗漉桶中加70%的乙醇提取48 h,三次,渗漉液合并,减压浓缩成浸膏,玄参的浸膏得率约为28.4%。再取玄参的浸膏1420 g,溶于自来水中(上样药液比<5%),经D101大孔树脂柱色谱,依次用30%、60%、90%乙醇洗脱,减压浓缩,回收乙醇,得30%乙醇浸膏为224 g、60%乙醇浸膏为105 g、90%乙醇浸膏为8 g。
1.2.2 柱层析分离 取30%乙醇浸膏100 g,经硅胶(100~200目)柱色谱,以乙酸乙酯-甲醇(50∶1→1∶10)梯度洗脱,经TLC检识合并得到6个部位Fr. 1~6。Fr. 2经硅胶、Sephadex LH-20分离得到化合物1(375 mg)、化合物2(350 mg)、化合物3(1.02 g);Fr. 4经Sephadex LH-20、重结晶分离得到化合物4(2.45 g)、化合物5(68 mg)。
取60%乙醇浸膏20 g,硅胶柱色谱(100~200目),以氯仿-甲醇(25∶1→10∶1)梯度洗脱,经TLC检识合并得到4个部位Fr. 1~4。Fr.1经氯仿-甲醇25∶1洗脱,重结晶分离得到化合物6(45 mg);Fr. 2经高速逆流色谱(HSCCC)分离得到化合物7(0.44 g)和化合物8(0.62 g)。
取90%乙醇浸膏5 g,以石油醚-乙酸乙酯(25∶1→1∶1)梯度洗脱,经 TLC检识合并得到4个部位 Fr. 1~4。Fr.2经硅胶柱,用石油醚-乙酸乙酯(10∶1)洗脱,回收溶剂至干,适量乙酸乙酯溶解,再加适量甲醇而沉淀,过滤,沉淀放置后得白色粉末,为化合物9(22 mg)。
1.2.3 降糖活性
1.2.3.1 HepG2葡萄糖消耗实验 参照相关文献的方法[9-10],将胰酶消化好的HepG2细胞均匀地点在96孔板中(2×105个/mL),24 h后分别放入含有不同浓度的浸膏组分、化合物1~4,6~8的无血清培养基中培养。每种浓度设置3复孔,以200 μL PBS液为空白对照组。孵育24 h后,取115 μL培养基,用葡萄糖试剂盒在全自动生化分析仪上检测培养基中葡萄糖残存量。通过下式可以计算出细胞促进葡萄糖消耗量。为了考虑细胞增殖的影响,葡萄糖消耗最终结果用GC/MTT表示[10-11](其中,促进葡萄糖消耗量(GC)=空白培养基中葡萄糖残存量-药物组培养基中葡萄糖残存量,MTT为“1.2.3.2 MTT实验”中用酶标仪于490 nm波长下检测各孔的吸光度值)。
1.2.3.2 MTT实验 参照相关文献[9],在剩下的培养基中加入15 μL MTT,37 ℃孵育4 h,加200 μL DMSO,振荡10 min,用酶标仪在490 nm波长下检测吸光度。
1.3 统计分析
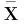
2 结果与分析
2.1 结构鉴定
化合物1(C29H36O15,acteoside),淡黄色无定形粉末,mp 135~136 ℃,UV365下显蓝色荧光。1H-NMR(CD3OD,500 MHz)δ ppm:7.06(1H,d,J=2.0 Hz,H-2‴),6.78(1H,d,J=8.0 Hz,H-5‴),6.96(1H,dd,J=8.0,2.0 Hz,H-6‴),7.58(1H,d,J=16.0 Hz,H-7‴),6.25(1H,d,J=16.0 Hz,H-8‴),6.70(1H,d,J=2.0 Hz,H-2),6.67(1H,d,J=8.0 Hz,H-5),6.56(1H,dd,J=8.0,2.0 Hz,H-6),2.79(2H,m,H-7),3.72(1H,dd,J=16.0,8.0 Hz,H-8),4.02(1H,dd,J=16.0,8.0 Hz,H-8),4.38(1H,d,J=8.0 Hz,H-1′),3.39(1H,dd,J=9.3,8.0 Hz,H-2′),3.81(1H,t,J=9.3 Hz,H-3′),3.52(1H,t,J=9.3 Hz,H-5′),3.52(1H,m,H-6′),3.60(1H,m,H-6′),5.20(1H,d,J=1.5 Hz,H-1″),3.93(1H,d,J=1.5 Hz,H-2″),3.58(2H,m,H-3″,5″),3.30(1H,m,H-4″),1.09(3H,d,J=6.0 Hz,H-6″);13C-NMR(CD3OD,500 MHz)δ ppm:δ 168.35(C=O),131.46(C-1),117.17(C-2),146.14(C-3),144.09(C-4),116.62(C-5),121.26(C-6),36.56(C-7),72.26(C-8),104.18(C-1′),76.20(C-2′),81.65(C-3′),70.57(C-4′),76.02(C-5′),62.36(C-6′),103.02(C-1″),72.33(C-2″),72.04(C-3″),73.78(C-4″),70.41(C-5″),18.45(C-6″),127.63(C-1‴),115.21(C-2‴),144.61(C-3‴),148.02(C-4‴),116.30(C-5‴),123.22(C-6‴),146.83(C-7‴),114.66(C-8‴)。根据以上核磁的波谱资料与相关参考文献的波谱资料基本一致,确定为类叶升麻苷[12]。
化合物2(C22H28O11,Prim-O-glucosylcimifugin),白色粉末,mp 126~128 ℃。1H NMR(CD3OD,500 MHz)δ ppm:6.60(1H,s,8-H),6.37(1H,s,3-H),4.77(1H,m,2′-H),4.76(1H,d,J=13.8 Hz,-O-CH2a),4.58(1H,d,J=13.8 Hz,-O-CH2b),4.60(1H,d,J=7.8 Hz,1″-H),4.43(1H,m,6″a-H),3.93(3H,s,-OCH3),3.87(1H,m,6″b-H),3.68(1H,m,3′a-H),3.26-3.38(5H,in,3,b′-H及glc上2″,3″,4″,5″-H),1.29(3H,s,4′-CH3),1.24(3H,s,4′-CH3)。13C-NMR(CD3OD,500 MHz)δ ppm:179.55(C-4),167.10(C-5),165.04(C-2),161.39(C-7),157.01(C-10),118.45(C-6),112.42(C-9),111.06(C-3),103.77(C-1″),94.15(-C8),92.07(C-2′),78.16,77.95(C-3″或C-5″),74.96(C-2″),72.21(C-4′),71.53(C-4″),67.14(2-O-CH2),61.82(C-6″),60.48(5-O-CH3),28.18(C-3′),25.40(CH3-4′),25.31(CH3-4′)。根据以上核磁的波谱资料与相关参考文献的波谱资料基本一致,确定为升麻素苷[13]。
化合物3(C15H22O9,Aucubin),白色针状结晶。1H-NMR(CD3OD,500 MHz)δ ppm:6.32(1H,dd,J=6.1,1.8 Hz),5.76(1H,s),5.09(1H,dd,J=6.1,3.9 Hz),4.96(1H,d,J=7.2 Hz),4.68(1H,dd,J=8.0 Hz),4.44(1H,dd,J=3.3,1.7Hz),4.34,4.18(各1H,AB,J=15.4 Hz),3.87(1H,dd,J=12.8,1.5Hz),3.68(1H,dd,J=12.8,5.3 Hz),3.37(1H,t,J=8.5 Hz),3.32(1H,m),3.23(1H,dd,J=8.5,8.0 Hz),2.89(1H,t,J=7.2 Hz),2.66(1H,m)。13C-NMR(CD3OD,500 MHz)δ ppm:148.02(C-8),141.98(C-3),130.24(C-7),105.71(C-4),99.92(C-1′),97.72(C-1),82.84(C-6),78.26(C-3′),77.89(C-5′),74.91(C-2′),71.56(C-4′),62.66(C-6′),61.41(C-10),47.93(C-9),46.27(C-5)。根据以上核磁的波谱资料与相关参考文献的波谱资料基本一致,确定为桃叶珊瑚苷(mp 180~182 ℃)[14]。
化合物4(C15H24O10,Harpagide),mp 130~132 ℃,Amorphous powder.1H-NMR(CD3OD,500 MHz)δ ppm:d 1.24(3H,s,H-10),1.78(1H,dd,J=13.7/5.1 Hz,H-7a),1.89(1H,dd,J=14.5 Hz,H-7b),2.54(1H,s,H-9),3.89(1H,d,J=4.0 Hz,H-6),4.94(1H,dd,J=6.4/1.4 Hz,H-4),5.74(1H,s,H-1),6.32(1H,d,J=6.4 Hz,H-3),4.57(1H,d,J=8.0 Hz,H-1″),3.21(1H,t,J=8.4 Hz,H-2″),3.37(1H,t,J=8.6 Hz,H-3″),3.30(1H,dd,J=8.1 Hz,H-4″),3.31(1H,dd,J=5.8/2.1 Hz,H-5″),3.66(1H,dd,J=12.5/5.8 Hz,H-6a″),3.70(1H,dd,J=12.5/2.1 Hz,H-6b″);13C-NMR(CD3OD,500 MHz)δ ppm:93.65(C-1),142.84(C-3),108.51(C-4),72.21(C-5),77.63(C-6),47.44(C-7),78.65(C-8),59.77(C-9),24.99(C-10);99.24(glcC-1′),74.73(glcC-2′),78.26(glcC-3′),71.66(glcC-4′),78.04(glcC-5′),63.03(glcC-6′)。根据以上核磁的波谱资料与相关参考文献的波谱资料基本一致,确定为哈巴苷[15]。
化合物5(C12H22O11,D-(+)-sucrose),无色结晶,mp 169~172 ℃,1H-NMR(D2O,500 MHz)δ ppm:5.41(1H,d,J=3.9 Hz,H-1),4.22(1H,dd,J=3.5,9.8 Hz,H-3′),4.06(1H,m,H-4′),3.90(1H,H-5′),3.49(1H,m,J=5 Hz,H-4),3.58(1H,dd,J=l.5 Hz,H-2),3.68(2H,s,H-l′),3.83(2H,H-6′),3.82(2H,H-6),3.86(1H,H-5),3.76(1H,H-3),13C-NMR(D2O,500 MHz)δ ppm:103.64(C-2′),92.13(C-1),81.33(C-5′),76.36(C-3′),73.95(C-4′),72.52(C-3),72.36(C-5),71.03(C-2),69.18(C-4),62.32(C-6′),61.30(C-1′),60.07(C-6),以上资料与文献报导的蔗糖资料一致[16]。
化合物6(C9H8O2,Cinnamic acid),白色粉末,mp 133~135 ℃。1H-NMR(CDCl3,500 MHz)δ ppm:7.82(1H,dd,H-2),7.57(2H,m,H-6),7.41(1H,m,H-4),7.40(2H,m,H-5),6.48(1H,dd,H-1);13C-NMR(CDCl3,500 MHz)δ ppm:172.74(C-1),147.30(C-2),134.22(C-3),130.94(C-4),129.15(C-5),128.57(C-6),117.51(C-7)。根据以上核磁的波谱资料与相关参考文献的波谱资料基本一致,确定为肉桂酸[17]。
化合物7(Harpagoside,哈巴俄苷)和化合物8(Angroside C,安格洛苷C),已另文发表[18]。
化合物9(C27H56,Twenty-Seven alkane),白色蜡状固体,mp 68.2 ℃,不溶于水、乙醇,易溶于石油醚、氯仿,可溶于苯、乙醚等有机溶剂中。无旋光性,无紫外吸收。1H-NMR(CD3OD,500 MHz):δ0.89(3H,t,J=7.0 Hz,Me),1.33-1.20(2H,α,β-CH2);13C-NMR(CD3OD,500 MHz):δ 14.31(C-1),22.89(C-2),32.13(C-3),29.57(C-4),29.90(C-5),29.90(C-6),29.90(C-7),29.90(C-8),29.90(C-9),29.90(C-10),29.90(C-11),29.90(C-12),29.90(C-13),29.90(C-14),29.90(C-15),29.90(C-16),29.90(C-17),29.90(C-18),29.90(C-19),29.90(C-20),29.90(C-21),29.90(C-22),29.90(C-23),29.57(C-24),32.13(C-25),22.89(C-26),14.31(C-27)。根据以上核磁的波谱资料与相关参考文献的波谱资料基本一致,确定为二十七烷[19]。
2.2 玄参提取物及单体对HepG2细胞降糖活性的影响
实验中用HepG2细胞进行细胞降糖活性部位筛选,结果见图1。各分离组分的GC/MTT均有剂量依赖关系,且在同一剂量下,各分离组分的葡萄糖消耗能力为:二甲双胍>过大孔树脂分离后的60%乙醇组分>玄参的渗滤浸膏>过大孔树脂分离后的30%乙醇组分>过大孔树脂分离后的90%乙醇组分。其中以过大孔树脂分离的60%乙醇组分为玄参降糖活性的主要活性部位,而过大孔树脂分离的30%乙醇组分和过大孔树脂分离的90%乙醇组分的降糖活性较差。
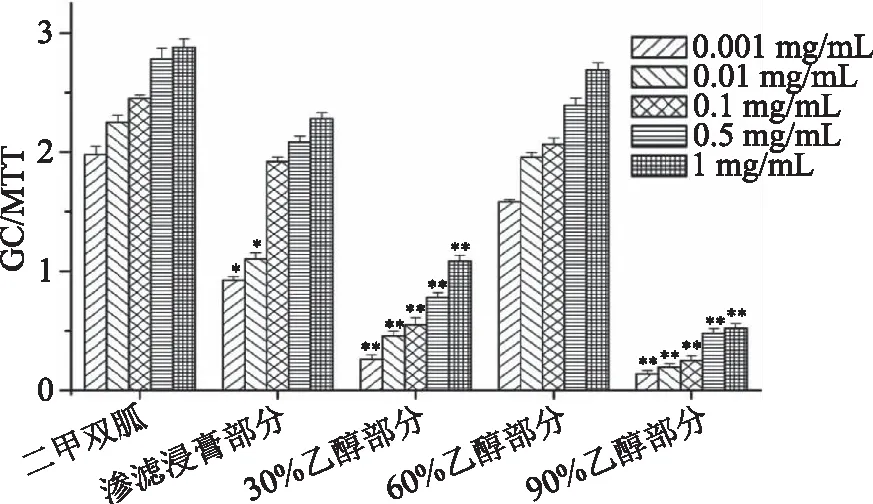
图1 玄参中粗提物对HepG2 细胞降糖活性的影响±s,n=3)Fig.1 Effect of different parts from Scrophularia ningpoensis Hemsley extracts on glucose consumption).注:30%、60%、90%乙醇部分是过大孔树脂分离中 各洗脱的组分,与二甲双胍相比,*p<0.05,**p<0.01。
在对各组分进行了系统分离,而得到的9个化合物,其中蔗糖和二十七烷未用于细胞实验的比较。从图2可知,在0.1~2.5 μg/mL浓度下,各化合物对促进HepG2细胞降糖的活性具有一定的剂量依赖关系,且在同一浓度时,各化合物的葡萄糖消耗能力为:化合物7(哈巴俄苷)的活性最强,其次为化合物4、1、8,而3、2和6的活性较弱。
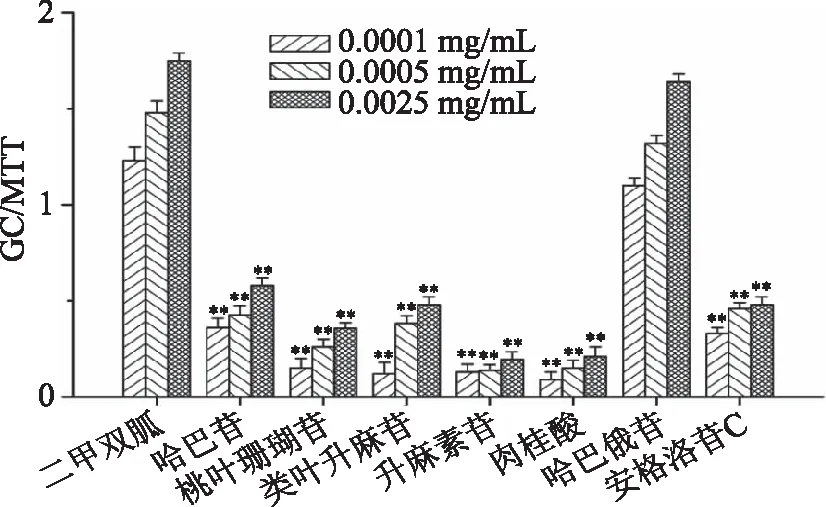
图2 玄参中不同化合物对HepG2细胞 促进葡萄糖消耗的影响±s,n=3)Fig.2 Effect of compounds from Scrophularia ningpoensis Hemsley ethanol extracts on glucose consumption注:与二甲双胍组相比,*p<0.05,**p<0.01。
2.3 玄参提取物及单体对HepG2细胞增殖的影响
MTT法测定玄参中各组分和化合物对HepG2细胞增殖的影响,结果见图3和图4。图3结果表明,当浓度大于0.1 mg/mL时,除过大孔树脂分离的90%乙醇组分外,其余各药物组均对细胞增殖有一定抑制作用,且作用显著(p<0.05),这说明当浓度超出一定范围时,玄参中各组分对HepG2细胞消耗葡萄糖的促进作用均受到抑制,其细胞毒性较大,会抑制细胞的增殖。而结合图1可知,对于90%乙醇组分,虽细胞毒性较小,但葡萄糖消耗能力较差,其组分的降糖效果最不明显。当浓度小于0.1 mg/mL时,60%乙醇组分的细胞存活率较好,而图1中其葡萄糖消耗能力较高,再次说明了该组分为玄参降糖活性的主要活性部位。
图3 玄参的浸膏中不同部分 对HepG2细胞增殖的影响Fig.3 Dose dependent cytotoxicity of different fractions of Scrophularia ningpoensis Hemsley extracts注:与空白对照组相比,*p<0.05,**p<0.01。
图4结果表明,在0.1~2.5 μg/mL浓度下,化合物1~4,6~8的细胞存活率均较高。而从图2和图4可知,哈巴俄苷的葡萄糖消耗能力最高,对促进HepG2细胞降糖的活性具有一定的剂量依赖关系。
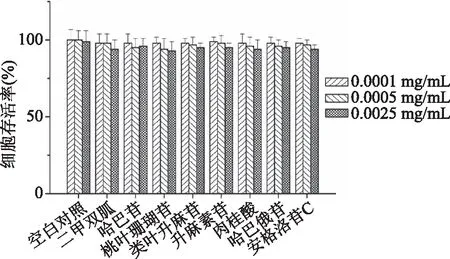
图4 玄参中不同化合物对HepG2 细胞增殖的影响Fig.4 Dose dependent cytotoxicity of different compound
哈巴俄苷在HepG2细胞中降糖活性为玄参中首次发现,为进一步研究玄参的物质基础奠定了基础,但是单一某种细胞模型实验并不能完全确定玄参中化学成分的降糖作用的影响,还需要结合体外的多种细胞实验和体内高糖动物实验等来进一步研究分子机制,同时,玄参中其它未分离的成分是否有较好的降糖作用也需进一步的探讨。
3 结论
本实验对玄参70%乙醇提取物的化学成分进行了系统研究,从中分离得到9个化合物,分别鉴定为类叶升麻苷、升麻素苷、桃叶珊瑚苷、哈巴苷、蔗糖、肉桂酸、哈巴俄苷、安格洛苷C、二十七烷。同时,采用人肝癌细胞HepG2建立了高糖细胞模型,分离的化合物对降糖的活性均具有不同程度的促进作用,且在0.1~2.5 μg/mL浓度范围内,哈巴俄苷在HepG2细胞中降糖活性最好。其中,二十七烷为首次从该属植物中分离得到,哈巴俄苷是一个潜在的降糖化合物,值得进一步研究和开发。
[1]张刘强,李医明. 近10年玄参属植物化学成分和药理作用研究进展[J]. 中草药,2011,42(11):2360-2368.
[2]谢小艳,夏春森. 中药玄参的化学成分及药理研究进展[J]. 亚太传统医药,2010,6(5):121-125.
[3]钱荣立. 糖尿病临床指南[M]. 北京医科大学出版社,2000.
[4]王芬,何华亮,刘铜华. 抗糖尿病中药活性成分及其作用机制的研究进展[J]. 时珍国医国药,2008,19(3):766-767.
[5]朱芸,刘金荣,张伟. 降血糖药用植物资源概述[J]. 中西医结合学报,2004,2(1):67-68.
[6]Kim H M,Han S,Lee Y S,et al. Aldose reductase inhibitory activity of Scrophularia species[J]. Natural Product Sciences,2010,16(1):54-57.
[7]张宁,李自辉,于卉,等. 玄参及其各组分的降血糖作用[J]. 中药药理与临床,2016,32(5):55-60.
[8]薛刚强,杜婧,潘新艳,等. 玄参化学成分研究[J]. 中药材,2014,37(9):1597-1599.
[9]齐峰,邱昌龙,杨晓溪,等. 加味桂枝人参汤对胰岛素抵抗 HepG2 细胞葡萄糖消耗量的影响[J]. 中国中医基础医学杂志,2012,18(4):373-375.
[10]苏瑾,焦钧,于莲,等. 山药多糖对人肝癌 HepG2细胞葡萄糖消耗能力及胰岛素抵抗的影响[J]. 中国药房,2015,26(4):458-460.
[11]Zheng X K,Li Y J,Zhang L,et al. Antihyperglycemic activity of Selaginella tamariscina(Beauv.)Spring[J]. Journal of Ethnopharmacology,2011,133(2)531-537.
[12]Li L,Tsao R,Liu Z,et al. Isolation and purification of acteoside and isoacteoside from Plantago psyllium L. by high-speed counter-current chromatography[J]. Journal of Chromatography A,2005,1063(1-2):161-169.
[13]韩忠明,王云贺,韩梅,等. 高速逆流色谱分离纯化防风中升麻素苷和5-O-甲基维斯阿米醇苷[J]. 分析化学,2009,37(11):1679-1682.
[14]李发荣,杨建雄,李宝林,等. 太白参中桃叶珊瑚苷的分离鉴定和提取工艺研究[J]. 中草药,2003,34(9):802-803.
[15]邹臣亭,杨秀伟. 玄参中一个新的环烯醚萜糖苷化合物[J]. 中草药,2000,31(4):241-243.
[16]宋兆辉,王保德,巴杭,等. 新疆芍药化学成分的研究[J].中国中药杂志,2004,29(8):748-751.
[17]姜守刚,蒋建勤,祖元刚. 玄参的化学成分研究[J]. 植物研究,2008,28(2):254-256.
[18]Tian J F,Ye X L,Shang Y H,et al. Preparative isolation and purification of harpagoside and angroside C from the root of Scrophularia ningpoensis Hemsley by high-speed counter-current chromatography[J]. Journal of Separation Science,2012,35(19):2659-2664.
[19]张艮红. 马蹄莲中烷烃的分离与结构鉴定[J]. 怀化医专学报,2009,7(2):19-21.
Study on the separation of chemical componentsand hypoglycemic activity ofScrophularianingpoensisHemsl.
TIAN Jin-feng1,2,SHANG Yuan-hong1,LI Xue-gang2,*
(1. Key Laboratory of Dry-hot Valley Characteristic Bio-Resources Development at university ofSichuan Province,Panzhihua University,Panzhihua 617000,China;2.College of Pharmacetical Sciences,Southwest University,Chongqing EngineeringResearch Center for Pharmacodynamics Evaluation,Chongqing 400716,China)
This paper investigated the action of hydrophilic constituents fromScrophularianingpoensisHemsl. on glucose-lowering effect metabolism in HepG2 cells. The crude extract by diacolating with 70% ethanol was redissolved in water and was loaded on a glass column containing D101 macroporous resin,and was separated by silica gel column and HSCCC to obtain compounds. The structures of compounds were identified by1H and13C-NMR spectroscopic data,and cell assay was performed by MTT and Kit methods in high glucose model. Compounds were identified as acteoside(1),prim-O-glucosylcimifugin(2),aucubin(3),harpagide(4),D-(+)-sucrose(5),cinnamic acid(6),harpagoside(7),angroside C(8)and twenty-seven alkane(9). Antihyperglycemic activity of each compounds in 0.1~2.5 μg/mL concentration range was selected,and glucose consumption ability of harpagoside was the highest. Twenty-seven alkane was isolated from the genus ofScrophularianingpoensisHemsl. for the first time. Antihyperglycemic activity of compound 7 ofScrophularianingpoensiswould be potentialand rich resources for drug development.
ScrophularianingpoensisHemsl.;separation and identification;antihyperglycemic activity;harpagoside
2016-12-08
田金凤(1981-),女,博士,研究方向:天然产物化学,E-mail:tjfasyh@163.com。
*通讯作者:李学刚(1964-),男,博士,教授,研究方向:中药,E-mail:shyh611@126.com。
四川省教育厅重点基金项目(14ZA0345,15ZA0370);四川省高校重点实验室开放基金项目(GR-2015-E-01,szjj2017-110);攀枝花市社会发展科技计划项目(2014TX-10-3,2016CY-S-10);攀枝花学院博士科研启动经费项目(bkqj2015026,bkqj2015023)。
TS201.1
A
1002-0306(2017)13-0025-05
10.13386/j.issn1002-0306.2017.13.005

