不同处理诱导新海16号体细胞胚胎同步化发生
郭家雁,张霞,丁喜莲,李娟,邓莉,陈全家,孙国清,曲延英*
(1.新疆农业大学农学院/农业生物技术重点实验室,乌鲁木齐830052;2.中国农业科学院生物技术研究所,北京100081)
不同处理诱导新海16号体细胞胚胎同步化发生
郭家雁1,张霞1,丁喜莲1,李娟1,邓莉1,陈全家1,孙国清2*,曲延英1*
(1.新疆农业大学农学院/农业生物技术重点实验室,乌鲁木齐830052;2.中国农业科学院生物技术研究所,北京100081)
【目的】旨在探索诱导海岛棉体细胞胚胎同步化发生的有效方法。【方法】以海岛棉品种新海16号的胚性愈伤组织为材料,研究了低温、饥饿和渗透处理诱导体细胞胚胎同步化发生的效果。【结果】在低温处理组中,4℃诱导时体细胞胚胎发生的数量随着低温诱导时间的延长而显著增加;10℃诱导时,不同诱导时间下各处理体细胞胚胎发生的数量差异不显著,但都显著高于对照(28℃);缺磷、缺氮、缺肌醇3种饥饿处理的体细胞胚胎的数量都随着处理时间的延长而减少;渗透处理组中,在含40 g·L-1葡萄糖的培养基上诱导7 d的效果最佳。【结论】4℃处理3 d、缺磷处理5 d、缺氮处理5 d以及40 g·L-1葡萄糖诱导7 d可以显著促进新海16号的体细胞胚胎同步化发生,其中4℃处理3 d的诱导效果最佳。
海岛棉;体细胞胚胎;诱导;同步化
农杆菌介导法是在棉花的遗传转化研究中应用较多的方法,但是这种方法需要1套高效稳定的组织培养(简称“组培”)再生体系作支撑,以便为遗传转化提供大量优质的受体材料[1]。
棉花组培再生的相关报道始见于20世纪70年代[2],至今已经有多个种类的棉属植物通过组培途径获得了再生植株,其中以陆地棉品种居多[3];海岛棉品种仅占20%左右[4],属于较难组培再生的棉花种类[5]。新疆农业大学农业生物技术重点实验室研究建立了包括新海16号在内的多个海岛棉品种的组培再生体系和遗传转化体系,为后续开展海岛棉转基因工作打下了良好基础[4,6-8]。但是在已经建立的海岛棉再生体系中仍然存在诸多亟待改良的技术难点,体细胞胚胎发生的不同步就是其中之一。
体细胞胚胎(又叫体胚、胚状体等)发生是海岛棉组培再生的重要环节[9],建立1套高频、同步化的体胚发生体系对于深入研究海岛棉体胚的发育机理、获得生长整齐的转基因植株、扩大生产规模等均有重要意义[10]。
目前,已有关于铺垫滤纸[11]、肌醇饥饿[12]对陆地棉体胚同步化发生影响的研究,但关于海岛棉体胚同步化诱导的研究鲜有报道。在其他植物的相关研究中,已报道的方法有蔗糖梯度密度离心、饥饿培养、添加植物生长调节剂以及使用药物短暂阻断细胞分裂周期[13-19]等。这些方法各有利弊:有的诱导效率较低;有的则步骤繁琐,容易造成污染;还有的则可能毒害细胞,引起遗传变异甚至致死[20]。因此,本试验考虑降低材料突变概率、批量处理的可操作性以及保证操作人员安全等方面的因素,选择通过低温、饥饿和改变培养基渗透压这3种方法诱导海岛棉的体胚同步化发生,为今后开展海岛棉转基因工作以及海岛棉体胚发育机理研究打下一定基础。
1 材料与方法
1.1 试验材料
试验所用新海16号胚性愈伤组织由新海16号的下胚轴诱导获得,诱导方法参见文献[8]。材料由新疆农业大学农业生物技术重点实验室提供。
1.2 培养条件
组织培养间温度为(28±2)℃,光照周期为光照16 h、黑暗8 h。
用于诱导体胚的胚性愈伤组织初时接种于固体MSB培养基上,MSB的配制参考贺雅婷[7]的方法,其中各成分质量浓度分别为葡萄糖30g·L-1,硝酸钾3.8 g·L-1,硝酸铵1.65 g·L-1,磷酸二氢钾0.17 g·L-1,肌醇0.1 g·L-1。
1.3 试验方法
1.3.1预处理。为了获得体积相近、受诱导程度相似的胚性愈伤组织,在同步化诱导之前先进行悬浮预处理:取生长旺盛,色泽淡黄、疏松的胚性愈伤组织作为材料于28℃,105 r·min-1摇床上培养2 d,使团块充分分散[21]。之后将含有胚性愈伤组织的培养液分别过10目(孔径2 mm)和18目(孔径1 mm)的细胞筛,选取10目筛下、18目筛上的、体积相近的胚性愈伤组织做诱导处理。
取(0.10±0.05)g(鲜物质质量)经过预处理的胚性愈伤组织,接种到1个培养瓶中,作为1次重复,用电子天平称取初始接种量(g)并记录。
1.3.2低温诱导。为了观察不同的低温水平以及低温诱导的时间对体胚同步化发生的影响,试验设4℃和10℃两个低温水平,将经过预处理并称量后的胚性愈伤组织在相应的低温水平下分别诱导处理1、2、3 d,每处理设8次重复,诱导完成后转回正常条件下培养。对照培养温度为28℃。
1.3.3饥饿诱导。饥饿诱导分为培养基中缺磷、缺氮和缺肌醇3个处理,诱导培养基组分变化如下:(1)缺磷培养基:除去固体MSB培养基中的磷酸盐(磷酸二氢钾),以氯化钾补足磷酸二氢钾中的钾离子(以物质的量计),防止造成钾缺乏;(2)缺氮培养基:除去固体MSB培养基中的硝酸铵和硝酸钾,并以氯化钾补足硝酸钾中的钾离子(以物质的量计),防止缺钾;(3)缺肌醇培养基:除去固体MSB培养基中的肌醇。
将预处理和称量后的胚性愈伤组织接种于不同的饥饿诱导培养基上,在每种培养基上分别诱导5、7、9、11 d,以观察不同诱导时间对体胚同步化发生的影响,每处理8次重复,诱导完成后转回正常条件下培养。对照组在正常固体MSB上培养。
1.3.4渗透诱导。试验以葡萄糖作为渗透调节剂,通过改变培养基中葡萄糖的质量浓度从而调节培养基的渗透压。试验设置20 g·L-1、40 g·L-1、50 g·L-1共3个葡萄糖质量浓度水平,胚性愈伤组织在每种培养基上分别进行5、7、9、11 d的诱导处理,以观察不同诱导时间对同步化的影响,每处理8次重复,完成诱导的胚性愈伤组织转回正常条件下培养。对照在正常的固体MSB上培养。
1.3.5数据统计。经观察发现,在诱导处理完成后转回正常条件下培养的第1个继代周期(20 d)中,经过诱导处理的胚性愈伤组织中没有可辨认的体胚出现;而在第2个继代周期,经过诱导处理的胚性愈伤组织集中分化出体胚,表现出同步化效应。由于同步化的目的在于一段时间内集中收获体胚,因此,本试验采用第2个继代周期的体胚数量作为研究同步化效应的依据,所列处理结果均为诱导处理后第2次继代培养20 d时统计的数据。
在1个培养周期(20 d)结束时,统计诱导产生的体胚的数量(胚性愈伤组织和体胚的形态区分参见曹景林[11]),结合对应的初始接种量,计算出单位质量(g)胚性愈伤组织发生的体胚的数量。
应用Microsoft Excel 2010软件分析数据及绘图。利用SPSS 20.0软件对结果进行方差分析,并用Duncan's新复极差法进行多重比较,检验诱导效果之间的差异。对于出现0.00值的处理组,先做对数转换,然后再进行方差分析和多重比较。
2 结果与分析
2.1 低温处理
低温诱导时间为1 d时,4℃诱导产生的体胚数量与对照(28℃)没有显著差异,10℃诱导产生的体胚数量则显著多于前两者(图1)。当诱导时间为2 d时,4℃、10℃诱导产生的体胚数量没有显著差异,但二者的诱导结果均显著高于对照。诱导时间达到3 d时,4℃诱导产生的体胚数量显著高于10℃处理和对照组。
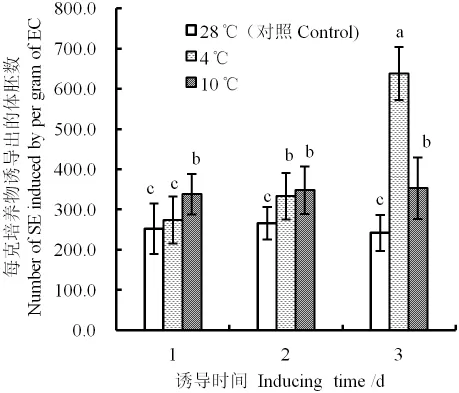
图1 低温诱导新海16号体胚同步化发生的效应比较Fig.1 Comparison of the synchronization effects induced by low temperature
从同一温度水平来看,4℃条件下,随着处理时间的延长,体胚的数量显著增加;而10℃处理1、2、3 d的体胚数量差异并不显著,但都显著高于对照。
总体来看,4℃诱导3 d得到的体胚数量显著多于其他处理,是低温处理组中的最佳组合。
2.2 饥饿处理
饥饿诱导时间为5 d时,缺磷诱导产生的体胚数量比其他条件下的更多,且差异显著;缺氮诱导产生的体胚数量也显著地多于对照和缺肌醇处理组(图2)。饥饿诱导7 d时,缺磷和缺氮处理的体胚数量与对照均没有显著差异,而缺肌醇处理的结果显著低于对照。饥饿诱导9 d时,缺磷、缺氮和缺肌醇诱导出的体胚显著少于对照。当饥饿诱导时间达到11 d时,缺磷和缺氮处理后的胚性愈伤组织在转回正常培养基进行后续培养时,组织颜色逐渐变灰白,长势较弱,在统计时没有体胚出现并且有少量愈伤组织褐化死亡;缺肌醇处理尚有少量体胚出现,但其数量显著少于对照。
从相同的饥饿处理、不同诱导时间来看,缺磷、缺氮、缺肌醇3种处理诱导产生的体胚数量都随着处理时间的延长而减少。
总体来看,缺磷诱导5 d、缺氮诱导5 d产生的体胚数量显著高于对照和其他处理,是饥饿处理组内较好的组合,其中缺磷诱导5 d是本组处理中的最佳组合。
2.3 渗透处理
统计分析显示,当诱导时间为5 d时,处理B诱导产生的体胚数量显著多于对照和其他处理,处理C的与对照差异不显著,处理D的显著低于对照(图3)。当诱导时间为7 d时,处理C诱导产生的体胚数量比其他处理都多,且差异显著;处理B和D的显著少于对照。诱导时间为9 d时,与对照相比,其他3个处理的体胚数量都显著减少,三者间的差异也都达到了显著水平。当诱导时间延长至11 d时,处理B和D都没有体胚出现,处理C诱导出的体胚也比对照显著减少。
在含20 g·L-1葡萄糖的培养基上诱导11 d以及在含50 g·L-1葡萄糖的培养基上诱导9 d后的胚性愈伤组织,在转回正常培养基后均生长缓慢,颜色逐渐转为灰白,到统计时没有观察到体胚,部分愈伤组织褐化死亡。在50 g·L-1葡萄糖条件下诱导11 d的胚性愈伤组织,转回到正常培养基后1周左右,即出现大量胚性愈伤组织褐化的情况,到第1次继代时即完全死亡(图4-f)。
从相同葡萄糖浓度水平来看,当葡萄糖质量浓度为20和50 g·L-1时,诱导出的体胚的数量随着诱导时间的延长而减少。
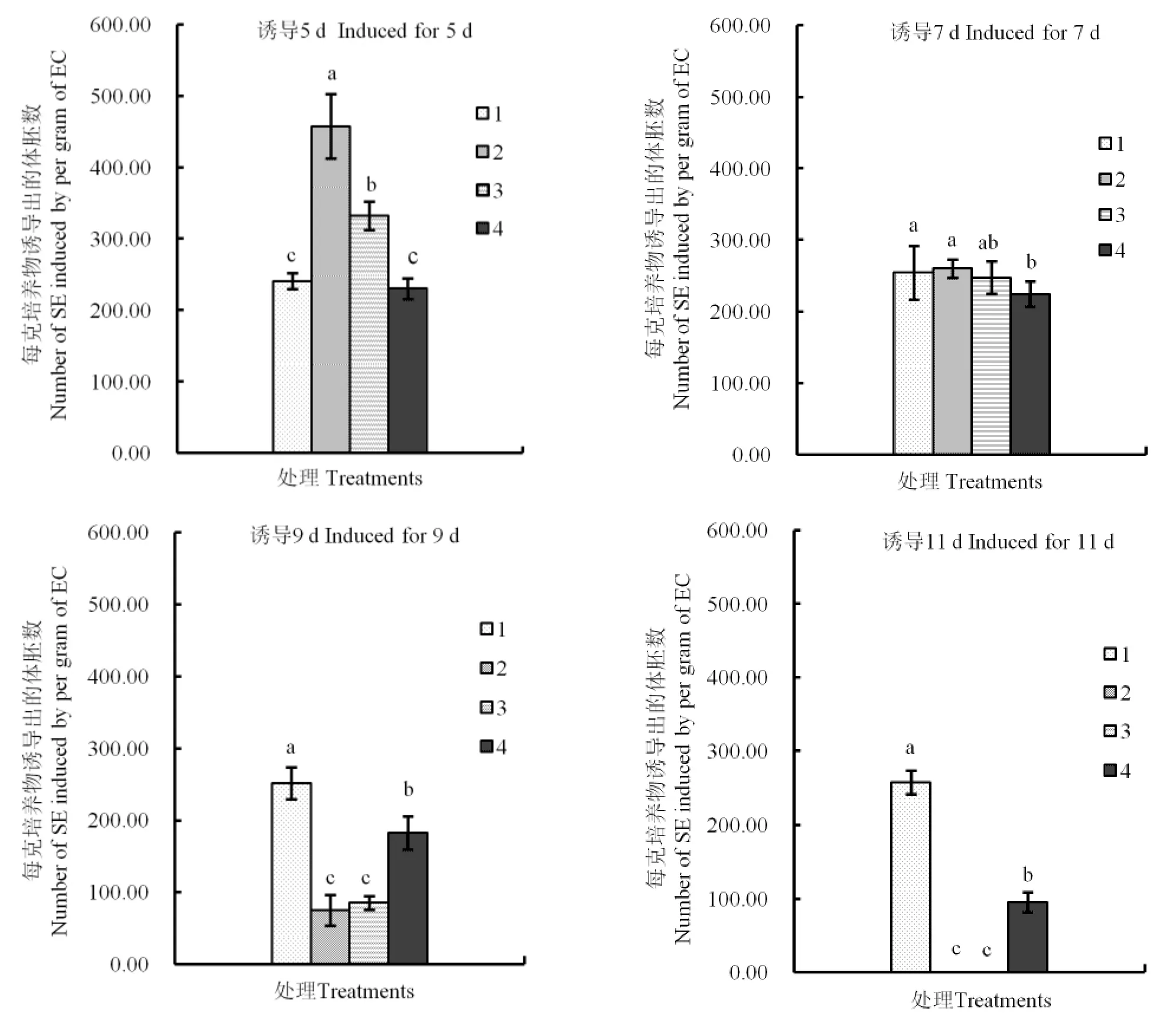
图2 饥饿处理诱导新海16号体胚同步化发生的效果Fig.2 Synchronization of Xinhai 16 somatic embryogenesis induced by starvation
总体来看,在40 g·L-1葡萄糖培养基上诱导7 d是本处理组中的最佳组合。
2.4 各种处理最佳组合诱导体胚同步化发生的效果比较
如图5所示,4℃诱导3 d的体胚数量显著高于其他处理,为本研究的最佳组合。
3 讨论
为解决体胚发生的不同步问题,研究者尝试了多种方法。曹景林[11]报道了在培养基表面铺垫滤纸,可以显著促进陆地棉体胚的同步化发生。本实验室在海岛棉的体胚诱导阶段也一直采用在培养基表面铺垫滤纸的方式进行培养,以改善胚性愈伤组织的通气情况[22]。本研究所有处理的固体培养基都铺垫了滤纸,结果表明一定的低温、饥饿或者渗透处理诱导海岛棉体胚同步化发生的效应显著优于仅在培养基表面铺垫滤纸的效应。
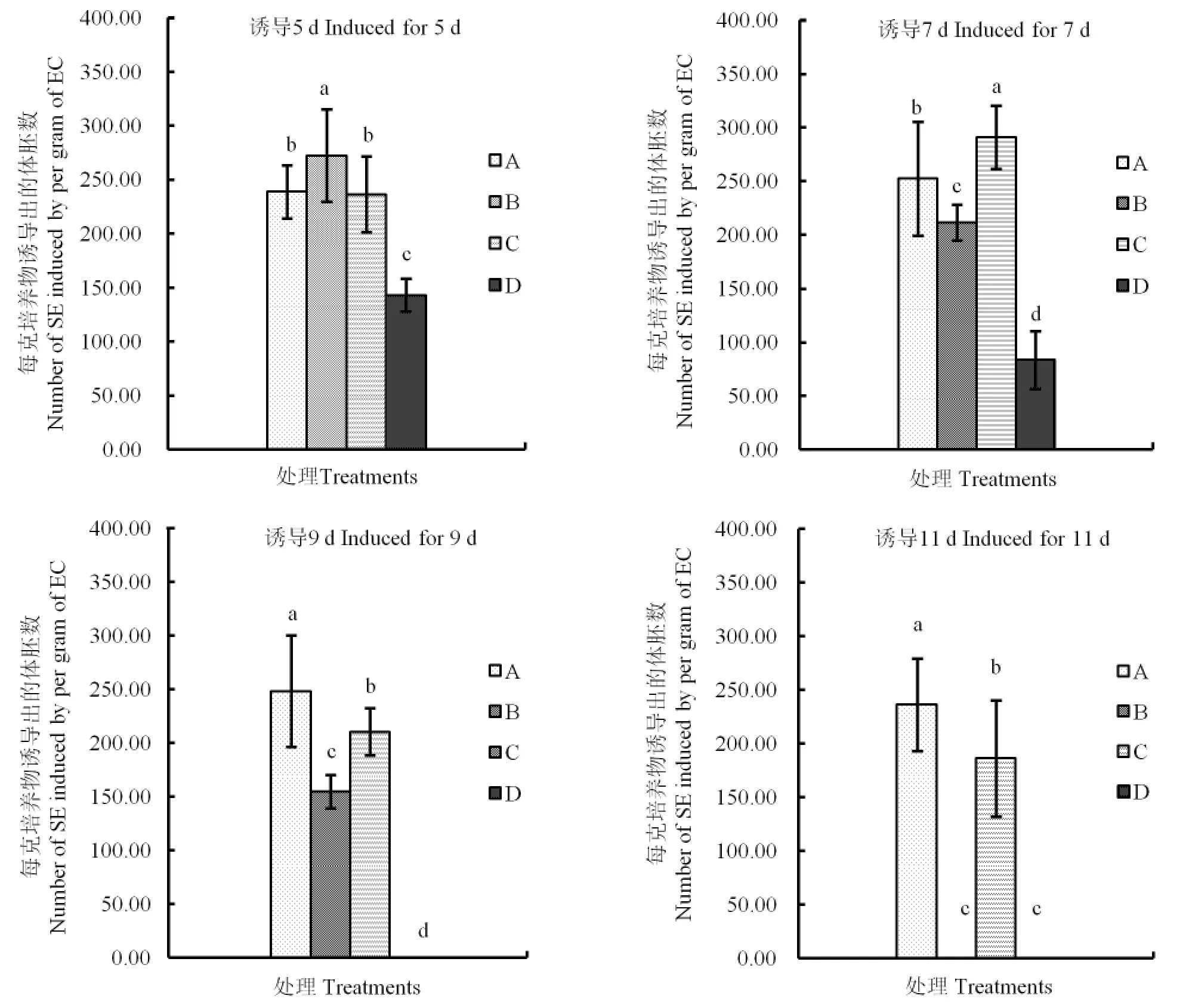
图3 渗透处理诱导新海16号体胚同步化发生的效果Fig.3 Synchronization of Xinhai 16 somatic embryogenesis induced by different osmotic pressure
本研究结果表明,适度低温处理对诱导新海16号的体胚同步化发生有显著的促进效应,这与许多研究的结果相同,如针对红豆杉、枸杞、半夏、蚕豆和小麦[16-18,23-24]的研究均发现低温胁迫有提高细胞同步分裂及体胚同步化发生的效果。低温促进体胚同步化发生的原因可能是低温使细胞的分裂进程被阻滞在一定时期,在恢复正常培养温度后,大量细胞从相近的阶段开始继续细胞分裂,从而达到同步化的目的[25]。
饥饿诱导促使细胞分裂趋于同步化的原理与低温诱导相似,当细胞处于氮素饥饿时,可获得G1期的同步化细胞,而处于磷和碳饥饿时,常可获得G1和G2期的同步化细胞[26]。Kumar等[12]报道了肌醇饥饿可以促进陆地棉的体胚同步化发生,其作用可能与抑制了植物体内磷酸肌醇的合成有关。本研究中,磷和氮饥饿诱导5 d都表现出了促进体胚同步化发生的效应,但肌醇饥饿没有表现出该效应。渗透胁迫诱导植物体胚发生已在多种植物培养中有报道[27],但其机理不明确。本研究以葡萄糖作为渗透调节剂进行胁迫,对新海16号体胚同步化发生的诱导效应不如其他2组处理显著。今后可以尝试更换渗透调节剂。
作者经观察发现,胚性愈伤组织在同步化诱导处理后的第1次继代培养期间没有分化出可见的体胚,而对照组则始终有体胚发生。这可能是由于诱导处理对胚性愈伤组织的生长形成胁迫,暂时抑制了其发育所致;而到第2个继代周期,随着抑制效应逐渐解除,体胚开始集中形成,表现出同步化诱导效应。
图4 不同处理诱导新海16号体胚同步化发生Fig.4 Synchronization of somatic embryogenesis of Xinhai 16 induced by different treatments
4 结论
4℃诱导3 d、缺磷诱导5 d、缺氮诱导5 d和40 g·L-1葡萄糖诱导7 d在各自的处理组中表现出较好的诱导效应,其中4℃诱导3 d后产生的体胚数量最多,对于新海16号的体胚同步化发生有最佳诱导效果。
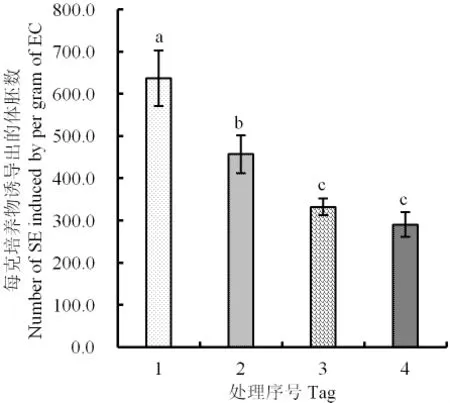
图5 诱导新海16号体胚同步化发生的最佳处理效应Fig.5 Effects comparison of four treatments on inducing synchronization of somatic embryogenesis of Xinhai 16
[1]刘传亮,武芝霞,张朝军,等.农杆菌介导棉花大规模高效转化体系的研究[J].西北植物学报,2004,24(5):768-775.Liu Chuanliang,Wu Zhixia,Zhang Chaojun,et al.Study on large-scale and high efficient transformation system mediated byAgrobacterium tumefaciensof cotton[J].Acta Botanica Boreali-Occidentalia Sinica,2004,24(5):768-775.
[2]Beasley C A.in vitroculture fertilized cotton ovules[J].Bio-Science,1971,21(17):906-907.
[3]刘传亮,田瑞平,孔德培,等.棉花规模化转基因技术体系构建及其应用[J].中国农业科学,2014,47(21):4183-4197.Liu Chuanliang,Tian Ruiping,Kong Depei,et al.Establishment and application of efficient transformation system for cotton[J].Scientia Agricultura Sinica,2014,47(21):4183-4197.
[4]丁喜莲.农杆菌介导的海岛棉转Bt基因遗传转化研究[D].乌鲁木齐:新疆农业大学,2015.Ding Xilian.Study onAgrobacterium tumefaciens-mediated transformation of Bt gene into sea island cotton(Gossypium barbadenseL.)[D].Urumqi:Xinjiang Agricultural University,2015.
[5]董合忠.不同基因型棉花下胚轴离体培养胚状体发生的研究[J].莱阳农学院学报,1991,8(2):97-101.Dong Hezhong.Cotton somatic embryogenesis of different genotypes[J].Journal of Laiyang Agricultural College,1991,8(2):97-101.
[6]翁琴.海岛棉(G.barbadenseL.)茎尖再生体系的建立及农杆菌介导抗虫基因(Bt;SATI)转化研究[D].乌鲁木齐:新疆农业大学,2007.Weng Qin.Studies on the establishment of cotton(G.barbadenseL.)shoot apexes regeneration system and the transformation of resistant pest gene(Bt;SATI)byAgrobacterium-mediated[D].Urumqi:Xinjiang Agricultural University,2007.
[7]贺雅婷.海岛棉再生体系的建立及SATI基因遗传转化初步研究[D].乌鲁木齐:新疆农业大学,2008.He Yating.Establishment of the regeneration system of sea island cotton(Gossypium barbadenseL.)and the genetic transformation ofSATIgene[D].Urumqi:Xinjiang Agricultural University,2008.
[8]阿依夏木姑丽·司马依力.棉花再生体系建立及CarNAC5基因的遗传转化[D].乌鲁木齐:新疆农业大学,2013.Ayxamguli Semayili.Study on plant regeneration system of cotton and genetic transformation ofCarNAC5 gene[D].Urumqi: Xinjiang Agricultural University,2013.
[9]陈莉萍.海岛棉再生体系的建立及遗传转化[D].武汉:华中农业大学,2007.Chen Liping.Regeneration of sea island cotton(Gossypium barbadenseL.)and genetic transformation[D].Wuhan:Huazhong Agricultural University,2007.
[10]张宇,沈海龙.植物体细胞胚同步化发生的控制[J].植物生理学通讯,2007(3):583-587.Zhang Yu,Shen Hailong.Control of synchronization for plant somatic embryogenesis[J].Plant Physiology Communications, 2007(3):583-587.
[11]曹景林.棉花体胚同步发生及相关基因表达和蛋白磷酸化分析[D].武汉:华中农业大学,2008.Cao Jinglin.Synchronization control of somatic embryogenesis and gene expression and protein phosphorylation analysis during somatic embryogenesis in cotton[D].Wuhan:Huazhong A-gricultural University,2008.
[12]Kumar M,Tuli R.Plant regeneration in cotton:a short-term inositol starvation promotes developmental synchrony in somatic embryogenesis[J].invitroCellularandDevelopment-Plant,2004, 40(3):294-298.
[13]Tonon G,Berardi G,Rossl C,et al.Synchronized somatic embryo development in embryogenic suspensions ofFraxinus angustifolia[J].in vitroCellular and Developmental Biology-Plant, 2001,37(4):462-465.
[14]Osuga K,Komamine A.Synchronization of somatic embryogenesis from carrot cells at high frequency as a basis for the massproduction of embryos[J].Plant Cell,Tissue and Organ Culture, 1994,39(2):125-135.
[15]陈春玲,赖钟雄.龙眼胚性愈伤组织体胚发生同步化调控及组织细胞学观察[J].福建农林大学学报(自然科学版),2002, 31(2):192-194.Chen Chunling,Lai Zhongxiong.Synchronization regulation of embryogenesis of embryogenic calli and their histological observations in longan(Dimocarpus longanLour.)[J].Journal of Fujian Agriculture and Forestry University(Natural Science Edition),2002,31(2):192-194.
[16]梅兴国,周爱文.红豆杉细胞同步化的研究[J].生物技术,2001, 11(3):9-10.Mei Xingguo,Zhou Aiwen.Studies on synchronization ofTaxuscells[J].Biotechnology,2001,11(3):9-10.
[17]马和平,李毅,邸利,等.枸杞体细胞胚胎发生及植株再生的研究[J].甘肃农业大学学报,2005,40(1):26-30.Ma Heping,Li Yi,Di Li,et al.Somatic embryogenesis ofLycium barbarumand plantlet regeneration[J].Journal of Gansu A-gricultural University,2005,40(1):26-30.
[18]毛春娜,张爱民,薛建平,等.低温处理对半夏悬浮培养细胞同步化的影响[J].中国中药杂志,2011,36(8):959-962.Mao Chunna,Zhang Aimin,Xue Jianping,et al.Effect of low temperature on cell synchronization division in suspension culture cells ofPinellia ternata[J].China Journal of Chinese Materia Medica,2011,36(8):959-962.
[19]陈成彬,宋文芹.利用HU和APM双阻断法诱导高频率植物根尖细胞有丝分裂同步化的研究[J].南开大学学报(自然科学),1999,32(1):28-31.Chen Chengbin,Song Wenqin.Studies on highly frequent mitotic synchronization induced by hydroxyurea and amiprophosmethyl in plant roots[J].Acta Scientiarum Naturalium Universitatis Nankaiensis,1999,32(1):28-31.
[20]李婷婷,施季森,陈金慧,等.悬浮培养条件下体细胞胚发育的同步化控制[J].分子植物育种,2007,5(3):436-442.Li Tingting,Shi Jisen,Chen Jinhui,et al.Developmental synchronization of somatic embryogenesis under suspension culture condition[J].MolecularPlantBreeding,2007,5(3):436-442.
[21]魏良民.海岛棉悬浮培养体细胞胚胎发生[J].生物技术,1996, 6(3):11-14.Wei Liangmin.The suspension culture and somatic embryogenesis ofGossypium barbadenseL.[J].Biotechnology,1996,6(3): 11-14.
[22]Kumria R,Sunnichan V G,Das D K,et al.High-frequency somatic embryo production and maturation into normal plants in cotton(Gossypium hirsutum)through metabolic stress[J].Plant Cell Reports,2003,21(7):635-639.
[23]李凤荣,张自立.蚕豆根尖细胞分裂同步化的方法[J].遗传, 1990,12(2):40-42.Li Fengrong,Zhang Zili.Studies on synchronized division ofVicia fabaroot tip cells[J].Hereditas,1990,12(2):40-42.
[24]陈凡国,张华,支大英,等.普通小麦的体细胞胚发生、发育相关蛋白质的毛细管电泳法鉴定[J].山东大学学报,2004,39 (3):99-103.Chen Fanguo,Zhang Hua,Zhi Daying,et al.Identification of specific proteins related to somatic embryogenesis and embryo development of wheat by capillary electrophoresis[J].Journal of Shandong University,2004,39(3):99-103.
[25]冯立新,肖桂芝,岳雪玲.低温对人外周血淋巴细胞的同步化作用[J].承德医学院学报,2005,22(2):96-98.Feng Lixin,Xiao Guizhi,Yue Xueling.Effect of low temperature on cell synchronized division in peripheral blood lymphocytes[J].Journal of Chengde Medical College,2005,22(2):96-98.
[26]张宇.水曲柳体细胞胚胎发生的同步化调控[D].哈尔滨:东北林业大学,2007.Zhang Yu.Synchronization ofFraxinus mandshuricasomatic embryogenesis[D].Harbin:Northeast Forestry University,2007.
[27]由香玲,谭啸,戴金玲,等.胁迫诱导植物体细胞胚发生的研究进展[J].西北植物学报,2010,30(9):1929-1934.You Xiangling,Tan Xiao,Dai Jinling,et al.Progress on the stress-induction of plant somatic embryogenesis[J].Acta Botanica Boreali-Occidentalia Sinica,2010,30(9):1929-1934.
Synchronized Somatic Embryogenesis of'Xinhai 16'Induced by Different Treatments
Guo Jiayan1,Zhang Xia1,Ding Xilian1,Li Juan1,Deng Li1,Chen Quanjia1,Sun Guoqing2*,Qu Yanying1*
(1.College of Agriculture/Key Laboratory of Agricultural Biotechnology,Xinjiang Agricultural University,Urumqi830052,China;2.Biotechnology Research Institute,Chinese Academy of Agricultural Sciences,Beijing100081,China)
[Objective]The aim of this study was to develop an efficient method for synchronizing the somatic embryogenesis ofGossypium barbadenseL.[Method]We attempted to synchronize the somatic embryogenesis ofG.barbadenseL.cv.'Xinhai 16' embryonic calli.The somatic embryos induced by low temperature,starvation,and osmotic pressure were counted and analyzed.[Result]In the low-temperature treatment group,the number of somatic embryos increased significantly at 4℃.While,there were no significant differences in the number of somatic embryos between treatment times at 10℃.Nevertheless,more somatic embryos were produced at 10℃than at 28℃ (control temperature).Somatic embryogenesis was inhibited by the nutrient starvation treatment(i.e.,phosphate,nitrogen,or inositol deficiency).In the osmotic stress group,the best results were observed following a 7-day culture in medium containing 40 g·L-1glucose.[Conclusion]'Xinhai 16'somatic embryogenesis can be synchronized by incubating calli at 4℃for 3 days,simulating phosphate or nitrogen starvation conditions for 5 days,or maintaining calli in a medium containing 40 g·L-1glucose for 7 days.The low-temperature treatment may provide optimal synchronization conditions.
Gossypium barbadenseL.;somatic embryogenesis;inducement;synchronization
S562.01
A
1002-7807(2017)04-0385-08
10.11963/1002-7807.gjyqyy.20170531
2017-01-19
郭家雁(1983―),女,硕士研究生,gjy1311@126.com。*通信作者:孙国清,sunguoqing1120@126.com;曲延英,xjyyq5322@126.com
国家自然科学基金(31660078);棉花生物学国家重点实验室开放课题基金(CB2015A24)

