培门冬酶辅助治疗血管免疫母细胞T淋巴瘤的临床观察
任羽,贺爱军
(延安大学附属医院,1.血液科;2.普外科,陕西 延安 716000)
培门冬酶辅助治疗血管免疫母细胞T淋巴瘤的临床观察
任羽1,贺爱军2
(延安大学附属医院,1.血液科;2.普外科,陕西 延安 716000)
目的:探讨培门冬酶辅助治疗血管免疫母细胞T淋巴瘤(angioimmunoblasticT-celllymphoma,AITL)的临床疗效。方法:将本院82例AITL患者纳入研究对象,随机分成两组:观察组41例,采用“培门冬酶+CHOP方案”治疗;对照组41例,仅用CHOP方案。比较两组的近期疗效、毒副反应及相关检测指标水平。结果:观察组的完全缓解率高于对照组(41.46% vs. 9.51%,P<0.05);两组总有效率、组间毒副反应发生率比较,差异均无统计学意义(P>0.05);观察组治疗后乳酸脱氢酶、β2-微球蛋白、D-二聚体均低于对照组(P<0.05)。结论:临床应用培门冬酶辅助治疗AITL能提高肿瘤完全缓解率,且不增加毒副反应,安全可靠。
血管免疫母细胞T淋巴瘤;培门冬酶;缓解率;毒副反应
血管免疫母细胞T淋巴瘤(angioimmunoblastic T-cell lymphoma,AITL)是T细胞淋巴瘤的独特亚型,主要以异形T淋巴细胞增生、血管增生、滤泡树突状细胞增生为临床表现[1]。由于AITL的发病率较低,目前暂无大样本临床对照研究,也无明确的标准治疗方案。依据美国国立综合癌症网络对非霍奇金淋巴瘤的治疗指南,CHOP(环磷酰胺+多柔比星+长春新碱+泼尼松)化疗是该类淋巴瘤的推荐治疗方案[2]。然而,临床实践证明,采用CHOP方案治疗AITL的疗效持续时间较短[3],预后难以达到满意效果。为加强对淋巴瘤细胞的杀灭作用,减少复发及远处转移,在CHOP方案的基础上给予其它药物辅助治疗获得关注。本研究应用培门冬酶辅助治疗AITL,通过分析该药对肿瘤的缓解效果及用药安全,探讨培门冬酶的临床优越性。
1 资料与方法
1.1 一般资料
将2015年10月至2017年2月在延安大学附属医院治疗的82例AITL患者纳入研究,均经病理形态学、免疫组化染色检查确诊[4],至少有1个客观可评价病灶,未接受过放、化疗的初治者,预计生存期≥6个月,年龄18~65岁,排除中枢神经系统有侵犯、肝肾功能不全、凝血异常、严重感染或者其他危重症患者。经本院医学伦理委员会的审批及家属签订知情同意书,随机分成两组:(1)观察组41例,男性23例,女性18例;平均年龄(40.8±11.5)岁;发病至确诊时间1~12个月(5.6±3.2)个月;Ⅰ~Ⅱ期24例,Ⅲ~Ⅳ期17例;贫血21例、血沉增快23例、β2-微球蛋白(β2-MG)升高30例、乳酸脱氢酶(lactate dehydrogenase,LDH)升高36例、D-二聚体(D-D)升高32例;国际预后指数评分<3分者34例,≥3分者7例。(2)对照组41例,男性25例,女性16例;平均年龄(40.7±11.6)岁;发病至确诊时间2~12个月(5.7±3.1)个月;Ⅰ~Ⅱ期26例,Ⅲ~Ⅳ期15例;贫血22例、血沉增快21例、β2-MG升高31例、LDH升高35例、D-D升高30例;国际预后指数评分<3分者35例,≥3分者6例。两组一般资料比较无统计学意义(P>0.05),具有可比性。
1.2 治疗方法
观察组,采用“培门冬酶+CHOP方案”治疗。CHOP方案:环磷酰胺(通化茂祥制药有限公司,国药准字H22022233)750 mg/m2,静脉滴注,第1天;吡柔比星(浙江海正药业股份有限公司,国药准字H20045983)50 mg/m2,静脉滴注,第1天;长春新碱(扬州制药有限公司,国药准字H32026431)1.4mg/m2,静脉注射,第1天,泼尼松(河南科伦药业有限公司,国药准字H41021489)100 mg/m2,口服,第1~5天,每个疗程3周,总共6~8个疗程;再联用培门冬酶(江苏恒瑞医药股份有限公司,国药准字H20153215)2 500 IU/m2,肌肉注射,每两周1次,连用4周。对照组,仅采用“CHOP方案”治疗,用法用量与观察组一致,两组均由同1个治疗小组负责。
1.3 观察指标
化疗期间,应当密切监测患者的血常规、心电图、肝肾功能及凝血五项,化疗两个周期之后,行CT复查肿瘤的缓解情况,比较两组的近期疗效,根据恶性淋巴瘤的Cheson疗效判定标准[4]:完全缓解(CR),化疗前检查的所有病灶消失且无新病灶出现,超过1个月;部分缓解(PR),6个最大病灶直径乘积之和缩小≥50%,其余病灶无增大且无新病灶出现,肝脾未增大;病情稳定(SD),未达到PR和PD极限;病情进展(PD),病灶最大径之和增大≥50%,有新病灶出现。总有效率=(CR+PR)/总例数×100%。同时,统计各组毒副作用的发生情况,评估用药安全性。此外,所有患者治疗前后均采集空腹静脉血,离心抽取血清备用,采用L-P连续监测法测定LDH、酶联免疫吸附试验测定β2-MG、免疫比浊法测定D-D,试剂盒均由Beckman公司提供,操作步骤按照说明书指示进行。
1.4 统计学分析
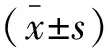
2 结果
2.1 两组患者近期疗效比较
观察组的CR率41.46%高于对照组的19.51%(P<0.05),两组总有效率比较,差异无统计学意义(P>0.05),两组间PR、SD和PD比较,差异亦无统计学意义(P>0.05)。见表1。
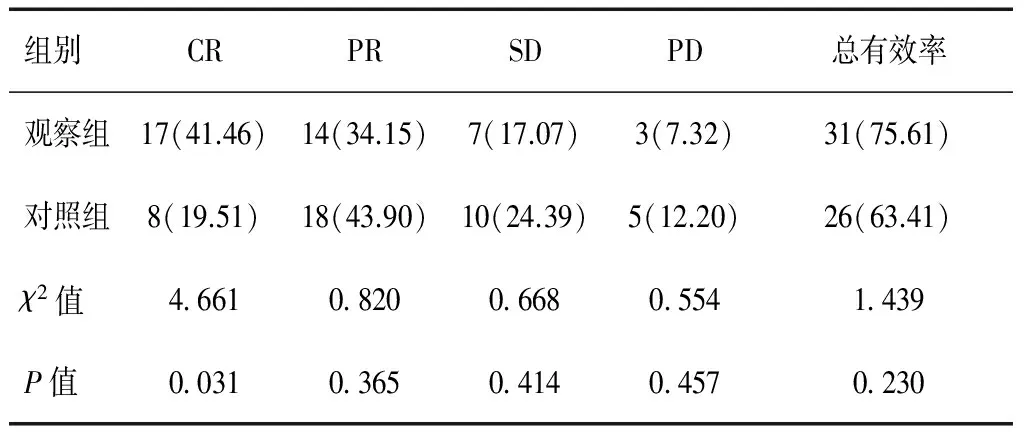
表1 两组的近期疗效比较[n=41,n(%)]
2.2 两组患者毒副反应比较
两组的主要毒副反应是恶心呕吐、骨髓抑制、肝功能异常等,两组组间毒副反应发生率比较,差异无统计学意义(P>0.05),见表2。

表2 两组的毒副反应发生情况比较[n=41,n(%)]
2.3 两组患者治疗前后LDH、β2-MG、D-D水平比较
两组治疗后的LDH、β2-MG、D-D水平均下降(P<0.05),观察组治疗后的LDH、β2-MG、D-D均低于对照组(P<0.05),见表3。
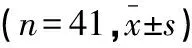
表3 两组治疗前后的LDH、β2-MG、D-D水平变化比较
3 讨论
AITL是全身系统性疾病,具有较高的侵袭性[5],病情进展快,预后较差。针对AITL,临床上主要采取药物治疗措施,其中CHOP化疗方案是最常用的AITL治疗方法,该方案通过多药协同抗癌作用[6],减少癌细胞增殖,控制癌症的发展。CHOP化疗方案中的环磷酰胺是双功能烷化剂,通过肝微粒体酶催化成磷酰胺氮芥[7],对癌细胞发挥细胞毒活性。吡柔比星是多柔比星的异构体,主要分布于细胞核内,通过嵌入DNA双螺旋链,阻碍癌细胞分裂[8],诱导癌细胞死亡。长春新碱是双吲哚型生物碱,抗癌活性强,抗癌效应约为长春碱的10倍,广泛应于癌症化疗,但其骨髓抑制副作用较严重,具有一定局限性。泼尼松一种肾上腺皮质激素类药物,既可以抑制淋巴结缔组织异常增生[9],又可以抑制组胺及其他毒物生成和释放,与上述药物合用,可延长AITL患者的存活期。由于淋巴瘤细胞缺乏L-天冬酰胺合成能力[10],必须靠借外源性L-天冬酰胺供给以满足蛋白质合成,倘若淋巴瘤细胞缺乏L-天冬酰胺即容易因蛋白质合成受阻而凋亡。培门冬酶是一种惰性、水溶性的新型门冬酰胺酶制剂,它能消耗血清内L-天冬酰胺[11],抑制癌细胞蛋白质合成,诱导癌细胞死亡。本研究结果显示:观察组的肿瘤完全缓解率明显高于对照组,肿瘤缓解总有效率高于对照组,提示培门冬酶辅助治疗AITL能促进肿瘤缩小、降期[12],比单纯CHOP化疗的抗肿瘤效果更好。两组均存在恶心呕吐、骨髓抑制、肝功能异常等毒副反应,但各项毒副反应的发生率比较均无明显差异,提示培门冬酶辅助治疗AITL不明显增加毒副反应,其用药安全性较好。
LDH是一种糖酵解酶,是糖无氧酵解及糖异生的关键酶系。LDH广泛存在于体细胞中,正常情况下其在血液中的含量很低。当人体组织损伤恶变后,癌细胞基因调控失调,LDH合成增多,并从癌细胞内大量释放,导致血液LDH活性增高。因此,血清LDH的表达可反映肿瘤增殖活性,若其水平大幅升高则肿瘤恶性程度高且存在肿瘤结外转移风险,预后不良。本研究观察组治疗后的LDH水平明显低于对照组,提示培门冬酶辅助治疗AITL能够有效减轻组织恶变坏死,减少癌细胞释放LDH,控制LDH水平。β2-MG是由淋巴细胞及其他核细胞分泌的小分子球蛋白,丰富存在于淋巴瘤细胞表面,淋巴瘤细胞增殖时,血清β2-MG表达水平将随之升高,肿瘤临床分期越晚,β2-MG水平越高。因此,血清β2-MG的表达可作为淋巴瘤病情诊断的重要指标。AITL患者入院时检查β2-MG水平均有不同程度升高,但经治疗后明显下降,本研究观察组治疗后的β2-MG水平明显低于对照组,提示培门冬酶辅助治疗AITL能有效缩小淋巴瘤负荷[13],进而降低β2-MG的表达水平。D-D是交联纤维蛋白水解产生的特异性降解物,是凝血及纤溶活化的标记物。由于AITL患者的淋巴瘤细胞会释放癌性促凝物,且因其浸润血管内皮造成血管基底膜损伤,最终会导致机体凝血及纤溶异常,表现为凝血酶增加、纤溶亢进,D-D水平明显升高。本研究中观察组治疗后的D-D水平明显低于对照组,提示培门冬酶有助于纠正机体纤溶亢进和高凝状态,改善凝血和纤溶系统功能。
综上所述,培门冬酶可通过选择性耗竭血液中的L-天冬酰胺而淋巴癌细胞,临床辅助CHOP化疗AITL能有效促进肿瘤缩小、降期,纠正LDH、β2-MG、D-D表达水平异常升高,控制肿瘤进展,改善预后。
[1] 许亚凤.20例血管免疫母细胞性T细胞淋巴瘤的临床、病理及预后分析[J].东南大学学报(医学版),2013,32(1):7-9.
[2] 张硕,刘爱春.血管免疫母细胞T淋巴瘤的特点及治疗进展[J].现代肿瘤医学,2016,24(6):988-992.
[3] 胡云飞,黄韵红,黄潞,等.含培门冬酶或左旋门冬酰胺酶的化疗方案用于早期鼻腔NK/T细胞淋巴瘤的临床观察[J].中国药房,2015,26(17):2384-2387.
[4] 康愫意,孙剑笠,陶云霞,等.血管免疫母细胞性T细胞淋巴瘤25例临床特征及预后分析[J].疑难病杂志,2013,12(7):513-516.
[5] 祁秀敏,张熔熔,丁祺.血管免疫母细胞性T细胞淋巴瘤免疫表型及临床病理分析[J].现代肿瘤医学,2014,22(7):1678-1681.
[6] 沈建箴.血管免疫母T细胞淋巴瘤诊治的进展[J].临床血液学杂志,2016,29(5):708-710.
[7] Foss FM,Sjak-Shie N,Goy A,etal.A multicenter phase II trial to determine the safety and efficacy of combination therapy with denileukin diftitox and cyclophosphamide,doxorubicin,vincristine and prednisone in untreated peripheral T-cell lymphoma: the CONCEPT study[J].Leukemia & Lymphoma,2013,54(7):1373-1379.
[8] Sakata-Yanagimoto M,Enami T,Toshida K,etal.Somatic RHOA mutation in angioimmunoblastic T cell lymphoma [J].Nature Genetics,2014,46(2):171-175.
[9] 王轶楠,刘卫东,马守东,等.EPOCH方案和CHOP方案一线治疗非特殊性外周T细胞淋巴瘤回顾性临床对照研究[J].现代肿瘤医学,2014,22(2):420-422.
[10]罗会芹,何义富.血管免疫母细胞性T细胞淋巴瘤的治疗进展[J].肿瘤预防与治疗,2013,26(6):355-360.
[11]Federico M,Rudiger T,Bellei M,etal.Clinicopathologic characteristics of angioimmunoblastic T-Cell lymphoma:analysis of the international peripheral T-Cell lymphoma project[J].J Clin Oncol,2013,31(2):240-246.
[12]万纯黔.培门冬酰胺酶联合吉西他滨治疗结外NK/T细胞淋巴瘤的安全性和疗效观察[J].实用临床医药杂志,2015,19(11):19-22.
[13]史沛杰,方建培.门冬酰胺酶治疗急性淋巴细胞白血病应用现状[J].中国实用儿科杂志,2016,31(4):268-274.
(学术编辑:谢传美)
Clinical study on pegaspargase in adjucant therapy of angioimmunoblastic T-cell lymphoma
REN Yu1,HE Ai-jun2
(1.DepartmentofHematology;2.DepartmentofGeneralSurgery,AffiliatedHospitalofYan’anUniversity,Yan’an716000,Shaanxi,China)
Objective:To investigate the clinical efficacy of pegaspargase in adjucant therapy of angioimmunoblastic T-cell lymphoma(AITL).Methods:82 cases of patients with AITL in hospital were included in the study,and randomly divided into two groups: the observation group of 41 cases were given pegaspargase +CHOP treatment;the control group of 41 cases were only given CHOP treatment.The short-term efficacy,toxicity reaction and the level of the related indicators in the two groups were observed and compared.Results:The complete remission rate in the observation group was significantly higher than the control group (41.46%vs. 19.51%,P<0.05),there was no significant difference in the short-term effects and incidence of toxicity reaction between the two groups (P>0.05),the levels of lactate dehydrogenase,2-MG,and D-D after treatment in the observation group were significantly lower than the control grou(P<0.05).Conclusion:Pegaspargase used in adjucant therapy of AITL can improve complete remission rate,without significant toxicity reaction,which is safe and reliable for clinical application.
Angioimmunoblastic T-cell lymphoma;Pegaspargase;Remission rate;Toxicity reaction
10.3969/j.issn.1005-3697.2017.03.032
2017-01-20
任羽(1980-),女,主治医师。E-mail:735690074@qq.com
时间:2017-6-21 18∶10 网络出版地址:http://kns.cnki.net/kcms/detail/51.1254.R.20170621.1810.064.html
R
A

