线粒体自噬在百草枯中毒大鼠模型肺纤维化中的作用研究
刘开翔,占志朋,谢席胜
(川北医学院第二临床学院·南充市中心医院肾内科,四川 南充 637001)
线粒体自噬在百草枯中毒大鼠模型肺纤维化中的作用研究
刘开翔,占志朋,谢席胜
(川北医学院第二临床学院·南充市中心医院肾内科,四川 南充 637001)
目的:建立百草枯(paraquat,PQ)中毒大鼠模型,观察不同阶段肺线粒体膜电位(JC-1染色)、调控线粒体自噬关键性蛋白PINK1、Parkin及活性氧(reactive oxygen species,ROS)的变化,探讨线粒体自噬是否参与PQ中毒肺纤维化的发生。方法:成年雄性SD大鼠42只,随机分为正常对照组(n=6)、模型组(n=36),模型组下设2 h、12 h、1 d、3 d、7 d和14 d共6个时间点,每个时间点各6只大鼠。使用20%PQ溶液50 mg/kg一次性灌胃大鼠建立PQ中毒模型。通过流式细胞仪检测血红细胞ROS浓度;HE染色和Masson染色观察PQ中毒后肺组织病理损害;JC-1染色检测肺组织线粒体膜电位变化;Western blot检测PINK1、Parkin蛋白变化。结果:与对照组相比,随着PQ中毒时间的延长,肺纤维化病理评分较对照组升高,差异有统计学意义(P<0.05);PQ组ROS荧光阳性强度率比值在中毒后2 h显著升高,中毒后12 h达高峰后逐渐下降(P<0.05),中毒后14 d与对照组相比差异无统计学意义(P>0.05);PQ组肺组织JC-1红绿荧光比均较对照组降低,Western blot提示随中毒时间延长,PINK1及Parkin蛋白表达均升高,差异有统计学意义(P<0.01)。PQ组肺组织JC-1红绿荧光比与PINK1及Parkin、肺纤维化病理评分均呈负相关(r=-0.890,P<0.01;r=-0.845,P<0.01;r=-0.794,P<0.01)。在PQ中毒12 h内,血红细胞ROS荧光强度阳性率与JC-1红绿荧光比呈负相关(r=-0.712,P<0.01),与PINK1及Parkin、肺纤维化病理评分呈正相关(r=0.571,P<0.01;r=0.484,P<0.01;r=0.602,P<0.05)。结论:PQ中毒导致大鼠产生了明显氧化应激,诱发了线粒体自噬。ROS的产生与线粒体自噬的发生密切相关,共同参与了PQ大鼠肺纤维化的发生发展。
百草枯;肺纤维化;线粒体自噬;PINK1;Parkin;氧化应激
百草枯(paraquat,PQ)又名“对草快”、“克无踪”,是我国广大农村地区广泛应用的季胺类高效能除草剂,同时也是目前致人类中毒死亡率最高的除草剂。PQ中毒后可造成体内肺、肾上腺和脑等器官损伤。其特征性病变是肺损伤,致死率极高。PQ导致的肺损伤主要表现为肺泡炎、急性肺水肿,以及进行性肺间质纤维化[1]。
当PQ进入体内被肺泡上皮细胞主动摄取后,PQ通过一系列连锁反应产生大量的自由基,构成活性氧类(reactive oxygen species,ROS)系统[2-3]。研究发现,ROS不仅通过脂质过氧化参与肺泡上皮细胞的凋亡[4],还能通过DNA损伤、线粒体功能障碍、炎症因子活化、细胞因子激活、蛋白酶失衡等途径参与肺纤维化的发生[2,5-6]。
通常机体在各种因素(如低氧、饥饿、光致福照、氧化应激等)刺激下,细胞内会发生去极化损伤以及老化的线粒体被特异性地包裹进自噬体中,并通过溶酶体被降解,这个过程称为线粒体自噬。百草枯诱导自由基产生的过程中,线粒体既是主要场所,又是自由基损伤的首要细胞器。当PQ进入线粒体后,经过一系列氧化还原反应,细胞功能受损,甚至出现凋亡/坏死。PQ中毒时产生的大量ROS能否诱导肺发生线粒体自噬,进而导致肺纤维化呢?目前对此问题的研究未见文献报道,其潜在的分子机制更是未阐明。
本研究通过建立PQ中毒大鼠模型,观察PQ中毒大鼠不同阶段肺线粒体膜电位及在线粒体自噬这一特殊过程中, 具有关键性调控作用的细胞线粒体外膜蛋白PINK1及胞质蛋白Parkin的变化,初步探讨线粒体自噬是否参与PQ中毒诱导大鼠发生肺纤维化。
1 材料与方法
1.1 动物与材料
6周龄雄性清洁、健康SD大鼠42只,体重(200±20)g(川北医学院实验动物中心提供)。20%的PQ溶液(先正达-中国投资有限公司)。戊巴比妥钠 (分析纯,苏州瑞和),活性氧检测试剂盒(碧云天生物技术研究所);线粒体JC-1荧光探针试剂盒(上海贝博生物试剂公司)、线粒体蛋白提取试剂盒(上海贝博生物试剂公司)。anti-PINK1(Santa Cruz Biotechnology)、anti-Parkin(Santa Cruz Biotechnology),鼠抗β-actin 单克隆抗体(上海生工生物工程股份有限公司)。25%戊二醛、HE染色试剂盒、MASSON染色试剂盒(索莱宝生物科技有限公司)。流式细胞仪(FC500,Beckman公司)。正置显微镜(Nikon 80i,Nikon公司)。
1.2 动物分组及处理
将健康成年雄性SD大鼠42只,随机分为对照组(生理盐水灌胃)6只,染毒组(PQ 50 mg/kg,灌胃)36只。各组分别于灌胃后2 h、12 h、24 h、72 h、7 d和14 d各取6只,2%戊巴比妥钠按40 mg/kg注射麻醉,腹主动脉采血,于-4 ℃冰箱中保存。取部分新鲜肺组织于洁净试管中保存;部分肺组织用%戊二醛溶液浸泡,-4 ℃冰箱中保存;余肺组-80 ℃冰箱中保存。
1.3 动物模型建立
及根据预实验结果,中毒组用20%PQ溶液按50 mL/kg一次性灌胃建立PQ中毒模型,对照组用生理盐水按50 mL/kg一次性灌胃。灌胃后以无呕吐、抽搐、呼吸困难、呼吸频率改变等情况视为灌胃成功[7]。实验过程中严密观察并记录动物的行为改变,以出现食欲降低、反应迟钝、毛发蓬松、鼠尾发绀、呼吸困难、易捕捉等标准选择中毒组模型动物。
1.4 血标本采集和活性氧检测
腹腔注射20%戊巴比妥(40 mg/kg)麻醉实验对象,开腹分离结蹄组织暴露腹主动脉,以5 mL空针迅速抽取1 mL血液置于血常规管中保存于4 ℃冰箱,按照活性氧检测试剂盒操作。
1.5 线粒体膜电位的检测
取新鲜肺组织使用玻璃匀浆器将肺组织制成细胞悬液,采用JC-1绿色荧光探针检测线粒体膜电位,具体步骤按JC-1荧光探针试剂盒说明操作。
1.6 肺组织HE、Masson染色
将大鼠右肺取下,以肺门为中心,水平切断肺组织,留取大小约1 cm3的肺组织,用10%中性福尔马林固定,肺组织常规脱水、石蜡包埋,用于制备石蜡切片。3 mm切片,行HE、Masson染色后,光学显微镜下观察肺组织病理变化。参照Szapiel[8]方法确定肺泡炎和肺纤维化程度。具体方法如下:(1)肺泡炎,分为4级:无肺泡炎0分;轻度肺泡炎1分,单核细胞浸润使肺泡隔增宽,仅限于局部和近胸膜部,面积小于全肺的20%,肺泡结构正常;中度肺泡炎2分,受累面积占全肺的20%~50%,近胸膜部较重;重度肺泡炎3分,面积大于50%,偶见肺泡腔内有单核细胞及出血造成的实变。(2)肺纤维化:无肺纤维化0分;轻度肺纤维化1分,受累面积<20%;中度肺纤维化2分,受累面积20%~50%;重度肺纤维化3分,受累面积>50%,肺泡结构紊乱。
1.7 Western blot印迹
取新鲜肺组织使用玻璃匀浆器将肺组织进行匀浆,镜下观察细胞破碎率80%以上,按线粒体蛋白提取试剂盒说明提取线粒体蛋白。参考文献方法,采用BCA法定量蛋白浓度[9]。每个上样孔上样15 μg蛋白,经SDS-聚丙烯酰胺凝胶中电泳,电转至PVDF膜。用2%牛血清白蛋白(bovine serum albumin,BSA)室温孵育2 h,然后加兔抗鼠PINK1抗体(1∶500),兔抗鼠Parkin抗体(1∶500),和β-actin(1∶1 000)脱脂牛奶封闭4 ℃过夜;加HRP标记羊抗兔IgG (1∶20 000),室温孵育2 h;TBST(含0.1% Tween-20 的Tris 盐缓冲液,pH7.4)中洗涤5 min,3次。DAB试剂显色。采用β-actin为内参照,Image J软件分析蛋白条带平均光密度,以β-actin平均光密度值进行内标准校正。实验重复3次。
1.8 统计学分析
2 结果
2.1 一般情况
3只PQ组大鼠分别于灌胃后72 h、5 d、9 d死亡,2只PQ组大鼠于灌胃后36 h出现消化道出血。PQ组大鼠2 h后即出现倦怠,烦躁;12 h出现毛发成缕、嗜睡,进食饮水减少,呼吸急促;24 h开始出现口周、鼠尾及脚趾发绀、呼吸困难、稀便,体重下降;72 h后体重明显下降;7 d大鼠明显活动减少,呼吸急促;14 d大鼠基本无活动,极度呼吸困难。
2.2 各组大鼠肺组织病理结果及统计
光学显微镜下,对照组(图1A、图2A)肺组织无明显病理学改变,PQ 2 h组肺组织开始出现肺泡炎症,少量胶原纤维形成。随时间的增加,炎性细胞浸润、红细胞渗出以及胶原纤维不断增加,至14 d时,大量胶原纤维形成,肺泡结构紊乱。与对照组比较,染毒组大鼠肺组织HE染色肺泡炎半定量病理评分、Masson染色肺纤维化半定量病理评分较正常组明显升高,差异具有统计学意义(P<0.05)。结果见图1-图3。



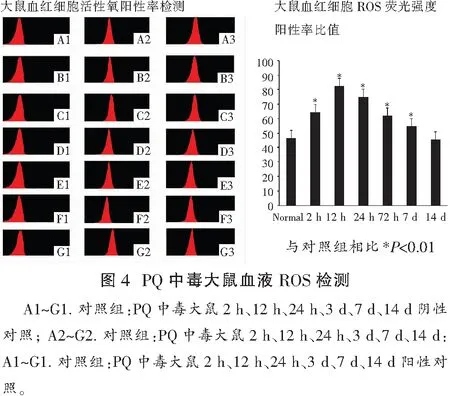
2.3 各组大鼠血红细胞ROS
与正常对照组相比,模型组大鼠血红细胞ROS的荧光阳性率比值在2 h即出现明显升高,持续至中毒7 d后,差异均有统计学意义(P<0.05)。结果见图4。
2.4 各组大鼠肺组织JC-1检测结果
与正常对照组相比,正常组红绿荧光比为(1.83±0.53),2 h、12 h、24 h、3 d、7 d、14 d染毒组大鼠比值红绿荧光比分别为(1.63±0.56)、(1.40±0.79)、(1.11±0.71)、(0.96±0.80)、(0.78±0.88)、(0.59±0.34),较正常组均降低,差异均有统计学意义(P<0.05)。结果见图5-图6。
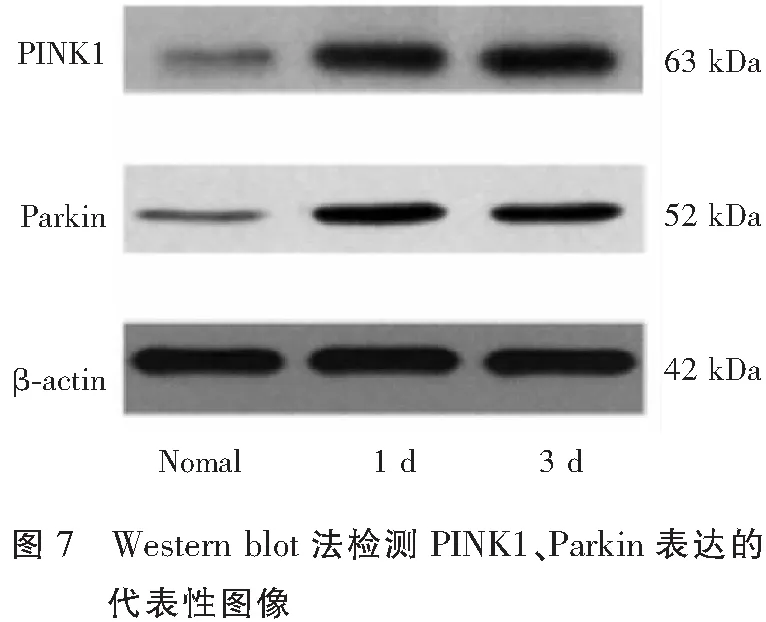
2.5 Western blot结果
与正常对照组相比,PQ组大鼠肺组织中PINK1、Parkin蛋白的表达显著增加,差异具有统计学意义(P<0.01)。不同时间组间肺组织PINK1、Parkin水平变化不明显,差异无统计学意义(P>0.05)。结果见图7-图8。



2.6 相关性分析
Pearson相关性分析结果显示,PQ中毒大鼠肺组织JC-1红绿荧光比与PINK1及Parkin、肺纤维化病理评分均呈负相关(r=-0.890,P<0.01;r=-0.845,P<0.01;r=-0.794,P<0.01;r=-0.573,P<0.01)。在PQ中毒12 h内,血红细胞ROS荧光强度阳性率与JC-1呈负相关(r=-0.712,P<0.01),与PINK1及Parkin、肺纤维化病理评分呈正相关(r=0.571,P<0.01;r=0.484,P<0.01;r=0.602,P<0.05)。
3 讨论
PQ急性中毒者可迅速出现各脏器功能衰竭,死亡率极高,即使度过急性期,后期也多发展为肺纤维化引起呼吸衰竭而死亡[10]。本次研究结果显示,PQ2 h组肺组织开始出现大量炎性细胞浸润,肺泡上皮水肿,毛细血管扩张,红细胞漏出,以及胶原纤维形成。随着时间的延长,PQ组肺组织的肺泡炎逐渐减轻、纤维化不断加重,呈肺纤维化改变,与Yang等[11]的研究结果一致,说明本研究使用20%PQ溶液按50 mL/kg一次性灌胃成功建立了PQ肺纤维化模型。
既往研究表明,当PQ进入线粒体后,与递氢体NADH-Q发生反应,进而抑制呼吸链中的NADH-Q还原酶的活性,导致有氧代谢减弱,无氧代谢增强,同时产生大量的乳酸和过量的含氧自由基,攻击线粒体膜,使线粒体内膜通透性增加,线粒体功能发生障碍,以致大量含氧自由基释放入细胞质,甚至进入细胞核,经过一系列氧化还原反应,细胞功能受损,甚至出现凋亡/坏死[12-13]。
ROS可反映体内氧化应激状态,故本研究使用流式细胞仪检测了PQ中毒大鼠血红细胞ROS的浓度,发现ROS浓度在PQ中毒后2 h即出现显著升高,随着中毒时间延长,其浓度持续升高,直到7 d后逐渐降低,再次证实PQ中毒导致大鼠体内发生了明显的氧化应激。
目前认为,线粒体膜电位降低可以导致线粒体自噬,故检测线粒体膜电位可以间接反映线粒体自噬的发生[14]。在线粒体自噬这一特殊过程中,哺乳动物细胞线粒体外膜蛋白PINK1具有关键性的调控作用。线粒体膜电位崩解是线粒体自噬的早期事件,当线粒体膜电位崩解时,全长型的PINK1将会稳定蓄积在线粒体外膜上,诱导Parkin选择性转位到受损的线粒体,最终介导线粒体自噬的发生选择性清除受损的线粒体[15]。故本课题使用Western blot检测了PINK1及Parkin蛋白的变化,进一步观察百草枯中毒后线粒体自噬的现象。
本研究结果发现,PQ组大鼠肺组织细胞JC-1红绿荧光比随着时间的延长,与正常对照组比较明显降低,而PINK1及Parkin蛋白与正常对照组比较不断升高,相关性分析表明,JC-1红绿荧光比与PINK1及Parkin呈负相关。我们的研究初步证实,PQ中毒导致了大鼠肺线粒体自噬的发生,且JC-1红绿荧光比与PINK1及Parkin有很好的参照性,共同反映了线粒体自噬的现象。
本研究相关性分析还发现,线粒体自噬指标与肺泡炎症及纤维化密切相关,故线粒体自噬可能参与了PQ导致的肺纤维化的发病机制。我们的结果还提示,ROS与JC-1呈负相关,与PINK1及Parkin、肺纤维化病理评分呈正相关,进一步说明,线粒体自噬可能参与了PQ导致的肺纤维化过程,且此过程可能通过ROS的作用,经过一系列氧化还原反应,引发细胞功能受损实现的。
综合以上结果,我们初步证实,PQ中毒诱导大鼠体内发生了氧化应激,产生大量ROS。同时,PQ中毒诱发了肺线粒体自噬,并参与了肺纤维化的发生发展。但线粒体自噬在PQ中毒发生肺纤维化的过程中发挥的具体作用及分子细胞机制还有待进一步研究明确。
参考文献
[1] 任艺,聂时南,许宝华.雌激素在百草枯中毒致急性肺损伤及肺纤维化中的作用[J]. 中国急救医学,2011,31(3):269-271.
[2] Shao X,Chen JH.Progress on pathgenesis and treatment of paraquat-induced pulmonary fibrosis[J].Zhejiang Da Xue Xue Bao Yi Xue Ban,2014,43(6):717-727.
[3] Taetzsch T,Block ML.Pesticides, microglial NOX2, and Parkinson’s disease[J].J Biochem Mol Toxicol,2013,27(2):137-149.
[4] Gray JP,Heck DE,Mishin V,etal.Paraquat increases cyanide-insensitive respiration in murine lung epithelial cells by activating an NAD(P)H:paraquat oxidoreductase:identification of the enzyme as thioredoxin reductase[J].J Biol Chem,2007,282(11):7939-7949.
[5] 邵雪,陈江华.急性百草枯中毒导致肺纤维化的发生机制及治疗进展[J].浙江大学学报(医学版),2014,43(6):717-727.
[6] Xu L,Xu J,Wang Z.Molecular mechanisms of paraquat-induced acute lung injury:a current review[J].Drug Chem Toxicol,2014,37(2):130-134.
[7] 孟潇潇,刘刊,谈玖婷,等.百草枯中毒大鼠肺纤维化与内质网应激的关系[J].中华危重病急救医学,2013,25(6):331-334.
[8] Huang K,Kang X,Wang X,etal.Conversion of bone marrow mesenchymal stem cells into type II alveolar epithelial cells reduces pulmonary fibrosis by decreasing oxidative stress in rats[J],Mol Med Rep,2015,11(3):1685-1692.
[9] Sambrook J,Russell D.Molecular Cloning:A Laboratory Manual[M].New York:Cold Spring Harbor Laboratory Press,2001:463-470.
[10]Dinis-Oliveira RJ,Duarte JA,Sánchez-Navarro A,etal.Paraquat poisonings:mechanisms of lung toxicity,clinical features, and treatment[J].Crit Rev Toxicol,2008,38(1):13-71.
[11]Yang Z,Sun Z,Liu H,etal.Connective tissue growth factor stimulates the proliferation,migration and differentiation of lung fibroblasts during paraquat-induced pulmonary fibrosis[J].Mol Med Rep,2015,12(1):1091-1097.
[12]Tomita M,Okuyama T,Katsuyama H,etal.Paraquat-induced gene expression in rat kidney[J].Arch Toxicol,2006,80(10):687-693.
[13]陈丽,陆晓晔,朱长清,等.百草枯致线粒体损伤关系的研究进展[J].中华急诊医学杂志,2011,20(9):1002-1004.
[14]Rodriguez-Enriquez S,Kim I,Currin RT,etal.Tracker dyes to probe mitochondrial autophagy (mitophagy) in rat hepatocytes[J].Autophagy,2006,2(1):39-46.
[15]Qi Y,Qiu Q,Gu X,etal.ATM mediates spermidine-induced mitophagy via PINK1 and Parkin regulation in human fibroblasts[J].Sci Rep,2016,6(6):24700.
(学术编辑:杜飞)
本刊网址:http://www.nsmc.edu.cn
作者投稿系统:http://noth.cbpt.cnki.net
邮箱:xuebao@nsmc.edu.cn
To evaluate the effects of mitophagy in paraquat-induced rat pulmonary fibrosis model
LIU Kai-xiang,ZHAN Zhi-peng,XIE Xi-sheng
(DepartmentofNephrology,TheSecondClinicalMedicalSchoolofNorthSichuanMedicalCollege,NanchongCentralHospital,Nanchong637001,Sichuan,China)
Objective:To investigate the effect of mitophagy on the occurrence of pulmonary fibrosis in paraquat poisoning by observe the changes of JC-1, PINK1,Parkin and the reactive oxygen species(ROS)in different stages of paraquat-induced rat pulmonary fibrosis model.Methods:42 adult male sprague-dawley (SD) rats were randomly divided into normal group(n=6) and PQ group(n=36).PQ group rats were divided into six time points:2 h,12 h,24 h,72 h,7 d,14 d,each time point includes 6 rats.20% PQ solution with adose of 50 mg/kg were selected for once administration gavage to establish PQ poisoning model,through the detection of red blood cell ROS concentration by flow cytometry,HE staining and Masson staining of lung tissue damage was observed after PQ poisoning,JC-1 staining was used to detect the changes of mitochondrial membrane potential changes in lung tissue,PINK1,Parkin protein was detected by Western blot.Results:Compared with normal group,the degrees of pulmonary fibrosis was gradually increased with the increase of PQ poisoning time,the difference was significant (P<0.05).In the PQ groups, the positive rate of ROS fluorescence intensity increased significantly at 2h after poisoning,and peaked at 12 h after poisoning, and then decrease gradually(P<0.05),the difference between normal group and 14 d after poisoning has no statistical significance (P>0.05).The ratio of JC-1,red green fluorescence in lung tissue of PQ group was lower than that of control group,and Western and blot indicated that the expression of PINK1 and Parkin protein increased with the duration of poisoning, and the difference was statistically significant (P<0.01).Pearson test shows there is a negative correlation between the red green fluorescence ratio and PINK1,Parkin and the pathology score of pulmonary fibrosis.(r=-0.890,P<0.01;r=-0.845,P<0.01;r=-0.794,P<0.01).In 12 h after PQ poisoning,there is a negative correlation between the ratio of the positive rate of ROS fluorescence intensity in erythrocyte and the red green fluorescence (r=-0.712,P<0.01),and a positive correlation between the positive rate of ROS fluorescence intensity and PINK1,Parkin and the pathology score of pulmonary fibrosis(r=0.571,P<0.01;r=0.484,P<0.01;r=0.602,P<0.05).Conclusion:The mitophagy and oxidative stress were induced by PQ poisoning. The generation of ROS closely related to the development of autophagy in mitochondria and is involved in the development of pulmonary fibrosis in PQ rats.
Paraquat;Pulmonary fibrosis;Mitophagy; PINK1;Parkin;Oxidative stress
10.3969/j.issn.1005-3697.2017.03.003
四川省科技厅基金项目(2011JTD0014);南充市科技局基金项目(2015-855)
2016-08-26
刘开翔(1990-),男,硕士研究生。E-mail:254442802@qq.com
谢席胜,E-mail:xishengx@163.com
时间:2017-6-21 18∶09 网络出版地址:http://kns.cnki.net/kcms/detail/51.1254.R.20170621.1809.006.html
1005-3697(2017)03-0324-05
R595.4
A

