SPARC表达水平与乳腺癌的发生、发展、侵袭和转移的关系
崔 凯,李佰营
(1. 陕西省第四人民医院病理科,西安 710043;2. 陕西省第四人民医院胸外科,西安 710043)
SPARC表达水平与乳腺癌的发生、发展、侵袭和转移的关系
崔 凯1,李佰营2
(1. 陕西省第四人民医院病理科,西安 710043;2. 陕西省第四人民医院胸外科,西安 710043)
目的:分析SPARC表达水平与乳腺癌的发生、发展、侵袭和转移的关系。方法:以2007年6月~2014年3月在我院接受乳腺手术治疗的137例女性为观察对象,根据其检查结果,乳腺癌者65例,乳腺良性病变者72例。观察两组乳腺SPARC表达水平,比较不同临床病理特征的乳腺癌患者SPARC表达情况的差异,分析SPARC表达水平与患者预后的关系。结果:两组患者的SPARC表达情况存在显著差异:SPARC阳性表达率由高到低分别为乳腺癌组、良性病变组,差异具有统计学意义;分化程度低、出现淋巴结转移、浸润深度为T3+T4、TNM分期为Ⅲ+Ⅳ期的乳腺癌患者其SPARC阳性表达率较高,而不同年龄、月经状况的乳腺癌患者SPARC阳性表达率无明显差别;恶化组SPARC阳性表达率明显高于好转组,差异具有统计学意义。结论:SPARC表达水平与乳腺癌的发生、发展、侵袭和转移均密切相关,且预后越差的乳腺癌患者SPARC阳性表达率越高。
SPARC;乳腺癌;预后;病理
据世界卫生组织(WHO)统计资料显示,乳腺癌在女性恶性肿瘤发病率中居首位,每年全球新发病例超过100万,占因恶性肿瘤死亡患者的16%[1]。富含半胱氨酸的酸性分泌蛋白(secreted protein acidicand rich in cysteine,SPARC)又称骨连接素,是一种与细胞外基质相关的小分子糖蛋白,它可由心、脑、肾、胰腺、骨骼肌等组织分泌,可参与新生血管的形成、修复组织创伤的过程[2],既往研究发现SPARC与肿瘤[3]的发生、发展、浸润和转移有关。目前SPARC在乳腺癌中的研究尚处于起步阶段,在乳腺癌中的表达及具体作用少见报道。本研究通过免疫组化检测SPARC在不同病理情况的乳腺组织中的表达情况,旨在探讨SPARC在乳腺癌中的表达及临床意义,为临床及病理医师提供有用价值。
1 资料与方法
1.1 研究对象选取2007年6月~2014年3月在我院接受乳腺手术治疗的女性患者为研究对象。纳入标准:(1)年龄≥18周岁;(2)临床资料完整,接受病理检查者;(3)全部病例经病理确诊。排除标准:不符合纳入标准者。根据纳入排除标准共纳入研究对象137例,其中乳腺癌者65例,年龄25~59岁,平均45.93± 12.54岁;乳腺良性病变者72例,年龄26~58岁,平均45.75±11.42岁。两组患者的年龄分布无明显差别,具有可比性。
1.2 方法
1.2.1 芯片制作纳入的137例病例的组织石蜡病理标本进行组织芯片制作,XXXX公司完成组织芯片的制备。
1.2.2 试剂鼠抗人SPARC单克隆抗体(工作浓度为1∶500);免疫组化SP试剂盒、生物素标记的羊抗鼠/兔IgG(二抗)、DAB试剂盒及柠檬酸修复液(100倍);二甲苯、无水乙醇、0.01 mol/L磷酸盐缓冲液、蒸馏水、苏木素、中性树脂等。
1.2.3 检测方法采用SP免疫组化法。实验步骤严格按照说明书进行操作,用PBS代替一抗作阴性对照,用标准SPARC阳性片作阳性对照。
1.2.4 结果判定标准采用半定量积分法判定结果,胞质和间质呈黄色视为SPARC阳性。先按染色强度计分:0分,无色;1分,浅黄色;2分,棕黄色;3分,棕褐色。在高倍镜下(×40)取5个不同视野,各计数100个细胞,再按阳性细胞所占百分比计分:0分,阴性;1分,阳性细胞≤10%;2分,11%~50%;3分,51%~75%;4分,>75%。染色强度与阳性细胞百分比的乘积≥3分,为免疫反应阳性,否则为阴性[4]。
1.3 评价指标观察两组患者乳腺SPARC表达水平,比较不同临床病理特征的乳腺癌患者SPARC表达情况的差异,分析SPARC表达水平与患者预后的关系。其中好转:TNM分期无进展,且无新发病灶,肿瘤标志物无明显升高,恶化组反之。
1.4 统计学处理所有数据经双人录入后,采用SPSS 11.5统计软件进行统计学处理。计数资料采用例或百分率表示,计量资料采用均数±标准差表示。一般资料根据资料类型采用t检验或卡方检验进行分析,两组患者乳腺SPARC表达情况的比较采用卡方检验进行处理,不同临床病理特征的乳腺癌患者SPARC表达情况采用卡方检验进行统计学分析。P<0.05记为差异具有统计学意义。
2 结果
2.1 两组患者SPARC表达情况的比较由表1可知,两组患者的SPARC表达情况存在显著差异:SPARC阳性表达率由高到低分别为乳腺癌组、良性病变组,差异具有统计学意义(P<0.05)。
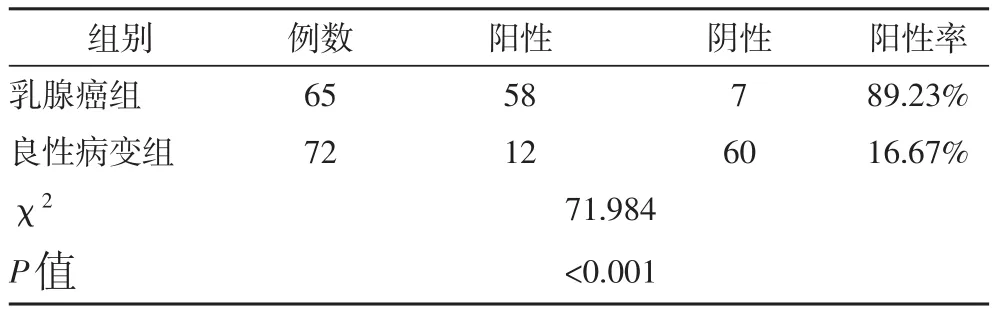
表1 两组患者SPARC表达情况的比较
2.2 不同临床病理特征的乳腺癌患者SPARC表达情况的比较由表2可知,分化程度低、出现淋巴结转移、浸润深度为T3+T4、TNM分期为Ⅲ+Ⅳ期的乳腺癌患者其SPARC阳性表达率较高(P<0.05),而不同年龄、月经状况的乳腺癌患者SPARC阳性表达率无明显差别。
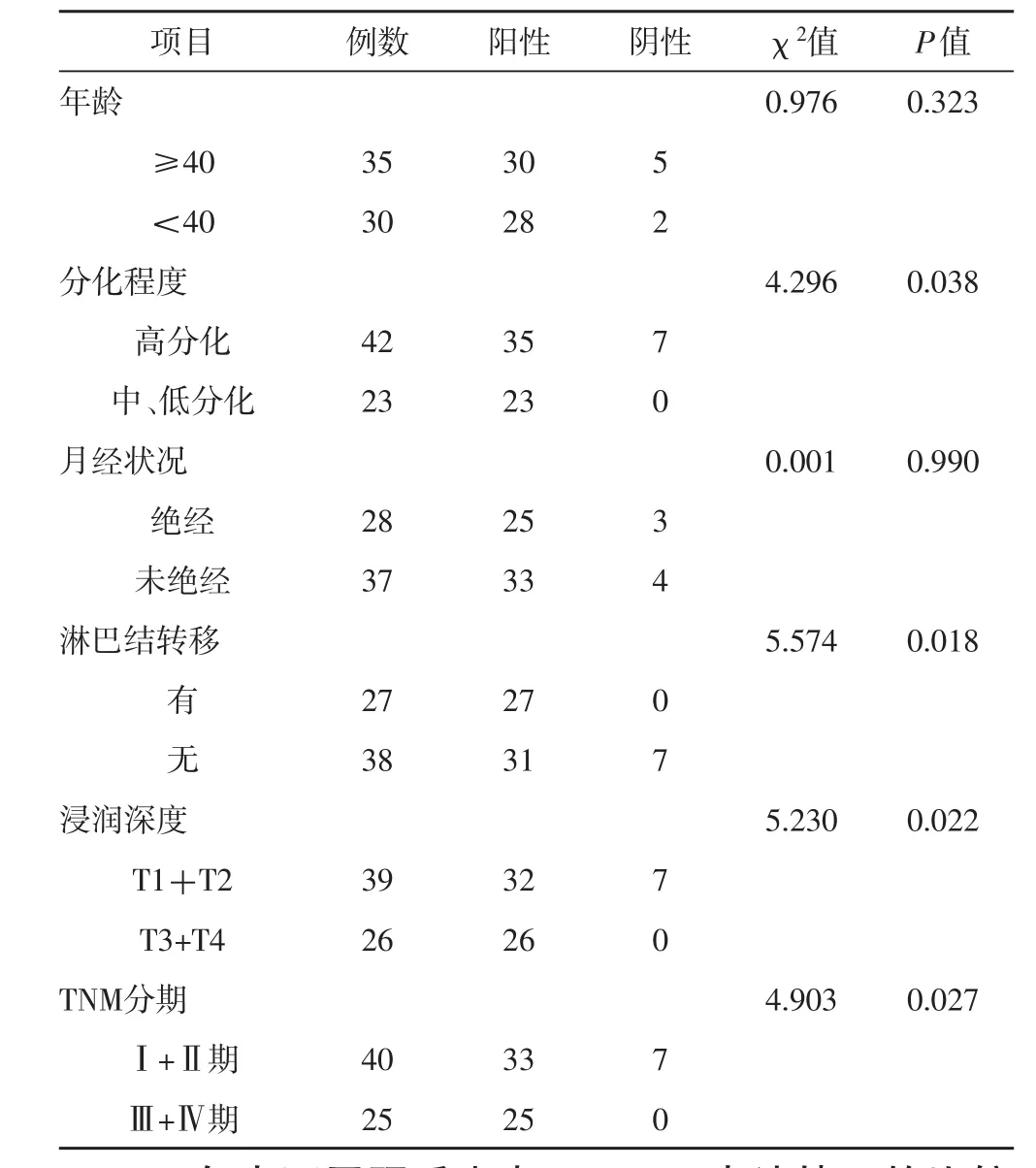
表2 不同临床病理特征的乳腺癌患者SPARC表达情况的比较(例)
2.3 1年内不同预后患者SPARC表达情况的比较
由表3可知,1年的随访结果显示:恶化组SPARC阳性表达率明显高于好转组,差异具有统计学意义(P<0.05)。
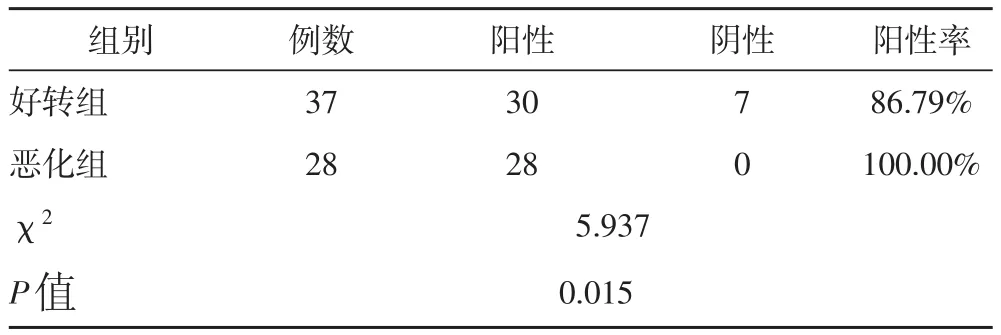
表3 1年内不同预后患者SPARC表达情况的比较(例)
3 讨论
SPARC是一种32 kDa分泌糖蛋白,其编码基因位于人类染色体5q31.3~q32,包含10 个外显子,全长25.9 kb[5]。与细胞外基质(extracellu lar matrix,ECM)蛋白相互作用,促进细胞黏附,诱导细胞迁移[6]。SPARC蛋白也被认为在组织重塑、血管生成、胚胎形成及肿瘤形成中起重要作用[7]。已有研究表明,SPARC 在转移性黑色素瘤中呈现高表达,在绝大多数异常痣中呈现中等表达[8];在前列腺癌的部分原发灶中呈现低表达或中等表达,在大部分前列腺癌转移灶中高表达[9]。陈万青等[10]研究表明,SPARC在结肠癌组织中呈现高表达。而W itkiewicz AK等[11]研究表明,SPARC在结直肠癌肿瘤细胞中低表达者往往预后较差。无论怎样的结果,上述研究都说明SPARC 具有明显的组织特异性。同样在本研究中可以发现,SPARC在乳腺癌组织和乳腺良性疾病组织以及正常乳腺组织中表达同样存在着差异性,在乳腺癌组织中的表达率(89.23%)高于其在乳腺良性疾病中以及正常乳腺组织中的表达(分别为16.67%和3.54%),三者间的差异有统计学意义,同样TABR NER O J[12]的研究得到了类似的结果。
淋巴结转移情况、组织分化程度以及肿瘤的临床分期对于恶性肿瘤病人的预后有重要意义。当出现淋巴结转移、肿瘤组织分化程度低以及患者临床分期较高时,预后较差、总生存率较低。已有SPARC 在恶性肿瘤中的表达与淋巴结转移有关。ZHANG D S等[13]研究认为在有淋巴结转移的食管鳞癌患者中,SPARC 蛋白阳性表达率较无淋巴结转移组升高;另有学者研究表明,在肺癌组织[14]及子宫内膜癌组织[15]中,SPARC的表达与淋巴结转移呈负相关。但关于 SPARC 蛋白与乳腺癌预后关系的研究目前尚有争论。有研究认为乳腺癌上皮细胞中 SPARC 蛋白表达增加与生存率降低有关[16]。本组实验发现临床病理结果较差的乳腺癌患者SPARC阳性表达率明显增高。且经过一年的随访,发现出现恶化的病人SPARC阳性表达率明显高于病情好转的患者,提示SPARC蛋白的上调与乳腺癌临床病理特征以及预后有着密切的相关,其机制可能与Liu Y等[17]研究认为的SPARC蛋白通过降低细胞侵袭活性及肿瘤血管内血小板聚集阻止肿瘤细胞的转移有关。Zhang L等[18]评价了253例乳腺浸润性导管癌术后肿瘤组织中SPARC蛋白的表达,未得出SPARC蛋白对浸润性乳腺癌有预测价值的结论。但Kohli AG等[19]研究结果与本研究一致。
结合上述研究发现SPARC在乳腺癌组织中呈现高表达且预示不良的预后,其参与了乳腺癌的发生、发展和转移过程。对SPARC的深入研究有助于揭示乳腺癌侵袭和转移的机制,为预防和治疗提供新的思路和依据。在乳腺癌组织中的高表达预示着肿瘤的恶性程度,有可能成为判断肿瘤侵袭力和患者预后的标志物,且通过对SPARC基因的抑制可能是治疗乳腺癌的一个潜在靶点。
[1] Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013[J]. CA Cancer J Clin, 2013, 63(1): 11-30.
[2] Bradshaw AD. Diverse biological functions of the SPARC family of proteins [J]. Int J Biochem Cell Biol, 2012, 44(3): 480-488.
[3] Nagaraju GP, E1-Rayes BF. SPARC and DNA methylation: possible diagnostic and therapeutic implications in gastrointestinal cancers [J]. Cancer Letters, 2013, 328(1): 10-7.
[4] 刘晓梅, 于国华, 张居民, 等. 乳腺癌组织SPARC和VEGF表达临床意义的探讨[J]. 中华肿瘤防治杂志, 2012, 19(14): 1061-1065.
[5] 徐东旭, 徐璐, 李彦君, 等. SPARC 蛋白在乳腺癌组织中的表达及临床意义[J]. 中国医科大学学报, 2014, 43(6): 493-498.
[6] 孙孝媛, 于国华, 张居民, 等. 乳腺癌组织中SPARC和Her-2 的表达[J]. 中国医药科学, 2014, 4(12): 18-21.
[7] SIEGEL R, MA J, ZOU Z et al. Cancer statistics, 2014. CA: a cancer journal for clinicians[J], 2014, 64(1): 9-29.
[8] Thomas R, True LD, Bassuk JA, et al. Different expression of osteonectin/SPARC during human prostate cancer progression [J]. Clin Cancer Res, 2014, 6: 1140-1149.
[9] 郑英娟, 汤建华, 张志林, 等. 肺癌中SPARC 和TGFβ1的表达及意义[J]. 肿瘤防治研究, 2014, 41(6): 593-597.
[10] 陈万青, 张思维, 曾红梅, 等. 中国2010年恶性肿瘤发病与死亡[J].国肿瘤, 2014, 23(1): 1-10.
[11] Witkiewicz AK, Freydin B, Chervoneva I, et al. Stromal CD10 and-SPARC expression in ductal carcinoma in situ (DCIS) patientspredicts disease recurrence[J]. Cancer Biolo Ther, 2014, 10(4): 391-396.
[12] TABRNER O J, CHIOREAN E G, INFATE J R, et al. Prognosticfactors of survival in a randomized phase III trial (MPACT) Of weekly nabpaclitaxel plus gemcitabine versus gemcitabine alone inpatients with metastatic pancreatic cancer[J]. Oncologist, 2015, 20(2): 143-150.
[13] Zhang D S, Wang D S, Wang Z Q et al. PhaseⅠ /Ⅱ study ofalbuminbound nab-paclitaxelplus gemcitabine administered to Chi-nese patients with advanced pancreatic cancer[J]. Cancer Che-mother Pharmacol, 2014, 71(4): 1065-1072. .
[14] 牛艳清, 肖 鹏, 王云峰, 等. 非小细胞肺癌中 SOX2 的表达及其临床意义[J]. 临床与实验病理学杂志, 2014, 30(6): 681- 683.
[15] Brewer CA, Setterdahl J, Li M J, et al. Endoglin expression as ameasure of microvessel density in cervical cancer[J]. ObsetGynecol, 2015, 96(2): 224 -228.
[16] 杨迷玲, 翟丽丽, 马丽华, 等. SPARC 和 VEGF 在胃癌组织中的表达及与血管生成的关系[J]. 诊断病理学杂志, 2012, 19(1): 52-55.
[17] Liu Y, Zhijin Chen Z, Liu C, et al. Gadolinium-loade polymeric nanoparticles modified with Anti-VEGF as multifunction MRI constrast agents for the diagnosis of liver cancer[J]. Biomaterials, 2014, 32(22): 5167-5176.
[18] Zhang L, Wang J N, Tang J M, et al. VEGF is essential for the growth and migration of human hepatocelluar carcinoma cells[J]. Mol Biol Rep, 2014, 39(5): 5085-5093.
[19] Kohli AG, Kivimäe S, Tiffany MR, et al. Improving the distribution of Doxil in the tumor matrix by depletion of tumor hyaluronan [J]. J Control Release, 2014, 191: 105-114.
The relationship between the expression level of SPARC and the occurrence, development, invasion and metastasis of breast cancer
Cui Kai1, Li Bai-ying2
(1. Department of Pathology; The Fourth People’s Hospital of Shaanxi Province, Xi'an 710043, China; 2. Department of Thoracic Surgery, The Fourth People’s Hospital of Shaanxi Province, Xi'an 710043, China)
[Abstract] Objective To analyze the relationship between the expression level of SPARC and the occurrence, development, invasion and metastasis of breast cancer. M ethods 137 cases of women to accept breast surgical operation in our hospital from June 2007 to March 2014 were selected as the observation object, according to the results of the examination, which were divided into breast cancer group (65 cases), benign breast lesions group (72 cases). The expression levels of SPARC in the two groups were observed. To compare the difference of SPARC expression in breast cancer patients with different clinicopathological features. Analyzed the relationship between SPARC expression and prognosis of patients. Results There were significant differences in the expression of SPARC in the three groups: SPARC positive expression rate from high to low were breast cancer group, benign lesion group, the difference was statistically significant; The SPARC positive expression rate of breast cancer patients with Low degree of differentiation, lymph node metastasis, depth of invasion, T3, T4, TNM stage III and IV was higher , and the positive expression of SPARC in breast cancer patients of different age and menstrual status rate had no significant difference; The positive expression rate of SPARC in deterioration group was significantly higher than that in the improvement group, and the difference was statistically significant. Conclusion The level of SPARC expression is closely related to the occurrence, development, invasion and metastasis of breast cancer, and the higher the rate of SPARC positive expression in breast cancer patients with worse prognosis.
SPARC; breast cancer; prognosis; pathology
R737.9
A
1673-016X(2017)03-0057-04
2017-01-05
崔凯,E-mail:CKAI004@163.com

