人脱落乳牙牙髓干细胞与牙髓干细胞生物学功能差异研究
庞真贞 王 良 高 磊 刘钦赞 李 晔
人脱落乳牙牙髓干细胞与牙髓干细胞生物学功能差异研究
庞真贞 王 良 高 磊 刘钦赞 李 晔
目的:从不同角度对人乳牙牙髓干细胞(SHED)与恒牙牙髓干细胞(DPSCs)的生物学功能进行对比研究,探讨对骨改建的影响。方法:有限稀释法分离培养SHED和DPSCs,成脂诱导14d进行油红O染色、成骨诱导21d进行茜素红染色;ELISA法检测IL-6、TNF-α分泌水平;两种干细胞常规培养及成骨诱导7d后进行ALP染色、实时定量PCR检测Runx2、RANKL、OPG基因表达。结果:分离获得的SHED和DPSCs具有成骨、成脂分化能力,符合干细胞特点。SHED的炎性细胞因子IL-6、TNF-α的表达均高于DPSCs(P<0.01);成骨诱导7d后SHED的ALP活性强于DPSCs(P<0.05);且经成骨诱导后两种干细胞均表达Runx2、OPG和RANKL,但SHED的表达水平明显高于DPSCs(P<0.05)。结论:SHED与DPSCs相比不仅具有较强的成骨分化能力,而且还兼具较强的破骨能力,提示SHED可能参与骨改建调控机制。
人脱落乳牙牙髓干细胞;牙髓干细胞;TL-6;Runx2
干细胞是指有克隆形成能力的未分化细胞,具有自我更新和多向分化的特点。目前,用于组织修复和再生的间充质干细胞(mesenchymal stem cells, MSC)多采用成体多能干细胞[1]。近年来,牙源性干细胞逐渐成为学者关注的热点,Gronthos[2]等于2000年成功分离了人恒牙牙髓干细胞(Dental Pulp Stem Cells,DPSCs),随后,M iura[3]等从正常脱落的儿童乳牙中分离得到一种间充质干细胞[4],并命名为人脱落乳牙牙髓干细胞(stem cells from human ex foliated deciduous teeth,SHED)。二者皆具有成体干细胞的特性,细胞表面表达多种间充质干细胞特异性标记物且具有较强的增殖能力和多向分化潜能[5]。乳牙与恒牙在来源和成牙特性上相近,然而,在结构和组织学上有一定差异,近期有研究证实与DPSCs相比SHED增殖能力强,倍增时间短,且具有较高克隆形成能力及成骨分化能力[6],但具体作用机制不清。本研究通过对比SHED和DPSCs的功能差异关键因子的分泌表达,为探讨SHED可能参与骨改建调控机制提供实验依据。
1.材料和方法
1.1 主要试剂和仪器 α-MEM培养基、胎牛血清(fetal bovine serum,FBS)、青链霉素、链霉素(Gibco,美国)、0.25%胰蛋白酶;RNA提取试剂盒、逆转录试剂盒(Fermentas,美国);TRIzol Reagent(Life Technologies,NY);超净工作台(苏净集团苏州安泰空气技术有限公司,中国);实时定量PCR仪(Applied Biosystems 7500,美国Life Technologies公司);IL-6、TNF-αElisa试剂盒(上海通蔚生);ALP试剂盒(上海碧云天)。
1.2 样本收集 收集2014年12月至2015年2月保定市第一中心医院口腔科5-7岁儿童正常乳恒牙替换期自然脱落乳牙样本。脱落乳牙无明显龋坏,无牙髓病变及根尖周炎,牙根吸收达牙根1/2-2/3,且所有纳入个体无系统疾病。同期于口腔外科收集18-25岁青年因正畸治疗拔除的前磨牙或因埋伏阻生而拔除的第三磨牙样本。所取得恒牙均无明显龋坏,无牙髓病变及根尖周病变,且所有纳入个体无系统疾病。本研究经保定市第一中心医院伦理委员会批准,取得患者知情同意。
1.3 SHED和DPSCs的分离、培养 充分消毒乳、恒牙牙体周围组织后拔牙,立即放入预冷含高倍双抗α-MEM培养基中,2小时内原代取材。参照Gronthos[2]等的方法,在超净台中,PBS液反复冲洗,乳牙直接用拔髓针拔取牙髓组织;而恒牙则通过牙钻从牙冠打开牙髓腔,再用拔髓针拔取牙髓,用含有青、链霉素双抗的0.1m L/L PBS反复冲洗,剪碎,约1mm×1mm×1mm的组织块。4%Ⅰ型胶原酶消化45m in,加入含150m L/L胎牛血清和青、链霉素双抗的DMEM培养液终止消化,1000r/m in离心5m in,弃上清,加入含20% FBS的α-MEM培养液接种于35mm培养皿,培养2d半量换液,之后每2-3d半量换液,细胞达到80%-90%汇合时,用胰酶消化传代,按1∶3比例传代。采用有限稀释法对SHED进行克隆分离:将第一代处于对数期的SHED计数,有限稀释至密度为约10个/m L,以100μl/孔接种于96孔培养板内,培养24h后,挑出单个细胞的孔,继续培养,每隔3d半量换液(α-MEM,15%FBS);待单克隆面积至孔底60%以上时,消化法移至24孔板、6孔板中扩大培养,逐步扩增至107数量级,以P3代用于细胞实验。
1.4 成脂成骨分化 取第3代的SHED和DPSCs,细胞计数后,以1×105个/孔的密度接种于6孔板中,随机分为实验组和对照组,每组3孔。待细胞密度生长至60%-70%将细胞进行成脂、成骨诱导。成脂诱导:用含有地塞米松1μmol/L,吲哚美辛200μmol/L、IBMX 0.5μmol/L,胰岛素10mg/L、胎牛血清100mg/L的DMEM诱导液诱导培养14d后,镜下观察胞浆内出现圆形空泡后,弃成脂诱导液,PBS漂洗3遍后将细胞用40g/L的多聚甲醛室温固定30 m in。PBS漂洗3遍,置油红O工作液中浸15-20 m in,蒸馏水冲洗5遍,显微镜下观察。成骨分化:用含有地塞米松10μmol/L,vitC 50μmol/L,β磷酸甘油钠10mmol/L、胎牛血清100 m L/L的DMEM诱导液诱导培养,每周换液3次,21d后,40g/L的多聚甲醛固定1.5h,PBS漂洗3遍,加入茜素红37℃染色30-45m in,PBS冲洗后镜下观察。
1.5 细胞因子检测 将P3代SHED及DPSCs按1×105个/m l的密度接种到24孔板中,设置4个副孔。待细胞贴壁后,弃原培养液,PBS冲洗3遍,将SHED及DPSCs加入常规培养液(含15% FBS、100μmol/L抗坏血酸、0.292m g/m l谷氨酰胺、100U/m l青霉素/链霉素的α-MEM培养基),24h后收集各个培养孔内的培养液,离心后取上清液进行酶联免疫吸附试验(enzyme-linked immunosorbent assay, ELISA)。 按 照 IL-6、TNF-α ELISA检测试剂盒说明建立标准曲线后每孔加入待测样品100μl,洗板,每孔加入一抗工作液50μl,反应板充分混匀后置于37℃60m in,洗板后加入底物液100μl,置于37℃,避光保存10m in,最后每孔加入50μl终止液混匀,在450nm处测吸光值。本实验进行3次重复。
1.6 碱性磷酸酶染色 第3代SHED和DPSCs以1×104个/孔的密度接种于12孔板中并随机分为实验组和对照组,每组3孔。正常及成骨诱导,每3d换液培养至7d,弃原培养液,按照碱性磷酸酶试剂盒说明书配制染液,将细胞用PBS洗3次,加4%多聚甲醛固定液,固定30m in。PBS洗3次,加ALP染液37℃孵育45m in。蒸馏水轻轻冲洗,洗去染液,照相。显微镜下观察染色结果,蓝色为阳性。
1.7 实时定量PCR 将P3代SHED和DPSCs低密度接种T25培养瓶,常规培养条件及成骨诱导条件下培养7d,后用Trizol裂解并提取成骨总RNA,逆转录为cDNA。采用SYBR Green试剂盒进行荧光定量PCR检测,目的基因及管家基因在不同的反应管中进行扩增,反应体系20μl。反应条件:95℃变性 20m in,95℃ 30s,60℃1m in,40个循环。采用实时荧光定量PCR仪监测记录数据,结果根据标准曲线,软件自动计算后得出。试验重复3次。引物序列见表1。

表1 引物序列
1.8 统计学分析 采用SPSS 19.0软件对数据处理,两组数据间的比较采用独立样本t检验。设P<0.05表示差异有统计学意义。
2.结果
2.1 SHED和DPSCs均具有成脂、成骨分化能力 经过低密度接种培养获取的SHED和DPSCs具有干细胞的基本形态,细胞均成长梭形、胞浆均匀、核圆、核仁清晰,呈旋涡状生长。SHED及DPSCs向成骨方向诱导过程中,细胞形态发生明显变化,突触消失,胞体增大,形态近方形或多边形,成骨诱导培养21d后茜素红染色阳性,可见矿化结节。SHED及DPSCs成脂诱导14d后,胞浆内出现圆形空泡,并逐渐融合,油红O染色可见呈红色的脂滴颗粒(图1)。这说明我们所分离培养的细胞符合SHED及DPSCs特性,为下步实验打下了基础。

图1 SHED和DPSCs成脂、成骨诱导分化(200倍)
2.2 SHED和DPSCs TNF-α、IL-6分泌量及基因表达水平检测 TNF-α、IL-6在干细胞参与的骨改建过程中发挥一定作用,本研究首先采用Elisa方法检测SHED及DPSCs TNF-α、IL-6分泌量,结果显示常规培养条件下SHED TNF-α、IL-6分泌量显著高于DPSCs(P<0.01,图2A)。实时定量PCR对TNF-α、IL-6在两组细胞中表达的检测结果与Elisa结果一致,SHED TNF-α、IL-6分泌量显著高于DPSCs,其中SHED TNFα的表达水平是DPSCs的3.11倍(P<0.01,图2B)。
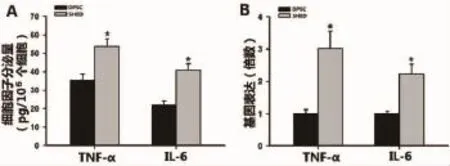
图2 A:ELISA检测细胞因子分泌水平;B:SHED和DPSCs常规培养3天后提取RNA检测炎症相关基因表达
2.3 SHED和DPSCs成骨诱导7天后ALP染色 将SHED和DPSCs成骨诱导7天后进行ALP染色,大体观察见SHED和DPSCs成骨诱导后ALP染色较常规对照组增强。倒置显微镜下观察,多数细胞质有蓝紫色颗粒沉淀,且SHED染色较DPSCs深,可见SHED比DPSCs ALP阳性表达率高(图3)。

图3 SHED和DPSCs成骨诱导7d后ALP染色(100倍)
2.4 SHED和DPSCs成骨诱导7d后关键基因表达检测 实时定量PCR检测结果显示,SHED和DPSCs均表达成骨早期关键的转录因子基因Runx2。常规培养条件下SHED Runx2表达水平显著高于DPSCs,成骨诱导7d后两组细胞Runx2表达水平均显著升高(P<0.05),SHED成骨诱导组表达值最高(图4A)。常规条件下SHED和DPSCs OPG表达无显著差异,成骨诱导后均显著上调,成骨诱导后SHED OPG表达水平显著高于DPSCs成骨诱导组(P<0.05,图4B)。在RANKL表达上,成骨诱导7d后DPSCs较对SHED组降低,SHED增高4.37倍(P<0.05,图4C)。

图4 SHED和DPSCs成骨、破骨相关基因表达
3.讨论
乳牙生理性根吸收是儿童乳恒牙替换期的一种自然生理现象,关于机制乳牙生理性根吸收,有学者指出可能与炎症环境、继承恒牙萌出时的压力或咬合创伤有关,但都尚处于探索阶段。目前对根吸收的研究多倾向于乳牙自身相关组织,因此乳牙牙髓干细胞是当前的研究热点。
有研究表明乳牙生理性根吸收的过程与骨重塑的过程相似。本实验选用Runx2和OPG两种成骨向分化相关特异性基因视作向成骨细胞分化的检测指标[7],结果显示,成骨诱导后,SHED和DPSCs的成骨相关基因Runx2和OPG表达量均较正常培养组有所提高,且SHED的Runx2和OPG表达增加水平均明显高于DPSCs,该结果也再次验证SHED较DPSCs具有更强成骨分化能力[8-9]。
TNF-α为TNF家族重要成员之一,是目前公认的最重要的一个内源性诱生型促炎细胞因子,现有研究结果显示炎性因子能够影响成骨细胞特异性基因的表达、细胞外基质的分泌以及成骨细胞的凋亡,且对破骨细胞的形成和活性具有重要的调节作用[10、11]。有实验表明,TNF也可以刺激基质成骨样细胞合成IL-6、PTH rp以及RANKL表达促进破骨细胞发育。本实验的研究结果显示常规培养的DPSCs炎症因子TNF-α和IL-6的分泌量明显小于SHED,且在炎症相关基因的表达倍数上更是小于 SHED。在骨的重塑过程中涉及经典的RANK/RANKL/OPG(核因子κB受体活化剂/ RANK配体/骨保护素)受体配体系统,在骨质代谢中发挥重要作用,且OPG和RANKL分别是破骨发生的抑制因子和促进因子,RANKL与OPG者的比值在破骨细胞分化成熟中有重要作用[12]。RANK作为RANKL的受体,当RANKL与RANK结合后,启动传递破骨细胞分化信号,使破骨细胞前体细胞开始增殖、分化以及细胞融合,形成破骨细胞,从而促进骨质的吸收;而当RANKL的另一种受体OPG与RANKL结合后,会抑制破骨细胞的功能,也会抑制破骨细胞前体细胞的进一步发育,从而抑制骨质的吸收。在本实验中,SHED和DPSCs均表达RANKL和OPG,但SHED在破骨相关基因RANKL的表达呈上调趋势,明显高于DPSCs。结果提示SHED相对于DPSCs具有更强的破骨能力。因此,本实验结果表明,与DPSCs相比,SHED不仅具有更强的成骨分化能力,还兼有一定的破骨能力。但其具体的调节机制尚不清楚,还需进一步研究。
[1] Gregorio Laino,Antonio Graziano,et al.An app roachab le human adult stem cell source for hard-tissue engineering[J]. J Cell Physio,2005,206(3):693-701
[2] Gronthos S,Mankani M,Brahim J,et al.Postnatal human dental pu lp stem cells(DPSCs)in vitro and in vivo[J].Proc Natl Acad Sci USA,2000,97(25):13625-13630
[3]M iura M,Gronthos S,Zhao M,et al.SHED:stem cells from human ex foliated deciduous teeth[J].Proc Natl Acad Sci USA,2003,100(10):5807-5812
[4] Junjun Liu,Fang Yu,Yao Sun,et al.Concise Review s: Characteristics and Potential Applications of Hum an Dental Tissue-Derived Mesenchymal Stem Cells[J].Stem Cells, 2015,33(3):627-638
[5] Vishw anath VR,Nadig RR,Nadig R,et al.Differentiation ofisolated and characterized hum an dental pu lp stem cells and stem cells from hum an ex foliated deciduous teeth:An in vitro study[J].J Conserv Dent,2013,16(5):423-428
[6]Heng BC,Zhu S,Xu J,et al.Effects of decellularized matrices derived from periodontal ligament stem cells and SHED on the adhesion,proliferation and osteogenic differentiation of hum an dental pulp stem cells in vitro[J].Tissue Cell,2016,48 (2):133-143
[7] Francesca Paino,Marcella Noce,Virginia Tirino,et al.H istone Deacety lase Inhibition w ith Valproic Acid Dow nregulates Osteocalcin Gene Expression in Human Dental Pulp Stem Cells and Osteoblasts:Evidence for HDAC2 Involvem ent[J]. Stem Cells,2014,32(1):279-289
[8] Zhu Y,Shang L,Chen X,et al.Deciduous dental pulp stem cells are involved in osteoclastogenesis during physiologic root resorption[J].J Cell Physiol,2013 Jan;228(1):207-215
[9] Bei Li,Yu Zhang,Qingchao W ang,et al.Periodontal Ligament Stem Cells Modulate Root Resorption of Human Primary Teeth via Runx2 Regulating RANKL/OPG System[J].Stem cells and development,2014,23(20):2524-2534
[10]de A raújo Júnior RF,Souza TO,de Medeiros CA,et al. Carvedilol decrease IL-1β and TNF-α,inhibits MMP-2, MMP-9,COX-2,and RANKL expression,and up-regu lates OPG in a rat model of periodontitis[J].Plos One,2013,8(7): e66391-e66391
[11]吴莹莹,刘洪臣.TNF-α、IL-1β及IL-6与糖尿病及牙周炎之间的关系[J].中华老年口腔医学杂志,2011,9(2):117-121
[12]Martin TJ.H istorically significant eventsin the discovery of RANK/RANKL/OPG[J].W orld J Orthop,2013,4(4):186-197
Comparative study on the biological function of dental pulp stem cells and dental pulp stem cells
PANG Zhen-zhen,WangLiang,GAO Lei,LIU Qin-zan,LI Ye
(Department of Stomatology,Baoding First Central Hospital,Hebei 071000,China)
Objective:Comparative study on the biological function of human dental pulp stem cells(SHED)and permanent teeth pulp stem cells(DPSCs)from different angles,and to explore the effect of bone reconstruction.Methods:SHED and DPSCs were isolated and cultured by lim iting dilution.Oil-red O staining was induced for 14 days,and alizarin red staining was carried out for 21 days.The levels of IL-6 and TNF-α were detected by ELISA.Two kinds of stem cells were cultured in vitro and induced by ALP after 7d staining.The expression of Runx2,RANKL and OPG were detected by real-time quantitative PCR.Results:The isolated SHED and DPSCs have osteogenic and adipogenic differentiation ability,which is consistent w ith the characteristics of stem cells.SHED expression of IL-6 and TNF-α were higher than that of DPSCs (P<0.05);Both kinds of stem cells express Runx2 OPG and RANKL after osteoinductive differentiation,but the expression of SHED obviously higher than that of DPSCs(P<0.05).Conclusion:Compared w ith DPSCs,SHED has not only the ability of osteogenic differentiation but also an osteoclast capacity,rem ind that SHED may participate in the bone reconstruction.
human exfoliated deciduous dental pulp stem cells;dental pulp stem cells;TL-6;Runx2
R78
A
1672-2973(2017)03-0000-00
2017- - )
庞真贞 保定市第一中心医院口腔科 主治医师 河北071000
王 良 保定市第一中心医院手术室 护师河北 071000
高 磊 保定市第一中心医院彩超室 副主任医师 河北071000
刘钦赞 保定市第一中心医院口腔科 医师 河北 071000
李 晔 保定市第一中心医院口腔科 主任医师 河北071000

