锑/磷在膨润土和高岭土的竞争吸附①
周世伟,朱丽娜,贺京哲,徐明岗
锑/磷在膨润土和高岭土的竞争吸附①
周世伟,朱丽娜,贺京哲,徐明岗*
(中国农业科学院农业资源与农业区划研究所/耕地培育技术国家工程实验室,北京 100081)
采用批处理法研究了锑/磷 (Sb/P) 在膨润土和高岭土上的竞争吸附等温线和动力学,并考察了pH的影响。结果表明:Sb和P吸附符合Langmuir或Freundlich方程(2= 0.945 0 ~ 0.998 3,< 0.000 1),存在极强的竞争吸附:P共存时Sb吸附容量(max)显著降低,分别从0.86和10.21 mmol/kg(先Sb后P)降低到0.64和2.61 mmol/kg(先P后Sb);Sb共存时P吸附亲合性()明显降低,分别从1.47和7.47 L/mmol(先P后Sb)降低到0.68和2.34 L/mmol(先Sb后P)。Sb和P的吸附总体随pH升高而降低,但相比高岭土,膨润土上的吸附受pH影响更大,意味着高岭土有更多配位吸附、膨润土有更多电性吸附。准二级动力学方程很好地拟合它们的竞争吸附(2> 0.994,< 0.000 1),并且在Sb/P共存下,膨润土对P吸附弱而慢(q= 0.36 mmol/kg,,2= 0.064 6 kg/(mmol·min))、对Sb吸附虽弱但快(q= 0.19 mmol/kg,2= 0.076 9 kg/(mmol·min));高岭土对P吸附强更快(q= 0.66 mmol/kg,2= 0.591 kg/(mmol·min))、对Sb吸附虽强但慢[q= 0.39 mmol/kg,2= 0.052 4 kg/(mmol·min)]。因此,Sb对P吸附的抑制在膨润土上更明显(主要是静电吸附竞争),P对Sb吸附的抑制则在高岭土上更突出(主要是配位吸附竞争)。
竞争吸附;锑;磷;黏土矿物;pH影响
锑(Sb)有广泛的用途,如生产阻燃剂、合金材料、硬化剂、颜料等[1],因而带动了锑矿开采和冶炼。但是,Sb也是一种有毒类金属,对人体及生物具有慢性毒性及致癌性,在美国及欧盟都被列为“优先污染物”[2]。中国作为世界最大的Sb生产国(约占全球80%)[3],多年的开采、冶炼已造成锑矿区周边严重污染[4],如在开采时间最早、世界最大的锑矿(湖南锡矿山),土壤Sb浓度达527 ~ 11 798 mg/kg,即使在稻田,也高达1 837 mg/kg;水溶性Sb也达到6.3 ~ 748 mg/kg[5]。因此,在我国,应该高度重视Sb的环境效应。
土壤对Sb的吸附是降低其活性/毒性的主要途径,但是环境中的Sb主要以阴离子Sb(OH)– 6存在,其吸附行为不同于常见的金属离子。相比层状硅酸盐黏土矿物,铁、铝、锰氧化物应该对Sb的吸附起主导作用,因其带有一定量的正电荷。已有的研究也表明Sb吸附与土壤氧化铁含量正相关[6-9]。Sb (V)吸附随pH增加而急剧下降;Sb (III)吸附通常在较宽的pH范围内保持稳定,但伴随着同时氧化。Sb吸附机制类似于砷(As),在氧化铁表面形成Sb-Fe双齿单核络合物或双核络合物[8-11]。然而,席建红等[12]却表示蒙脱土对Sb的吸附远大于针铁矿和高岭土,他们将其归于蒙脱土具有高的比表面积(40倍高)。说明Sb在土壤及土壤组分上的吸附,可能受各种环境条件的影响,有不同的反应机制,目前由于研究较少,还没有定论。
另外,作为Sb的同族元素磷(P),与其有相似的化学性质,并且土壤中有较高的含量,那么,它对Sb吸附的影响就值得关注。大多研究表明P强烈抑制Sb的吸附,即二者之间有明显的竞争作用[13-15]。但Xi等[16]发现P促进Sb (III) 在高岭土上的吸附;Canecka等[17]显示氧化铁对Sb (V) 比P有更高的亲合性。这也暗示P-Sb相互关系比较复杂,可能并不是单纯的竞争作用,需要深入地探讨。因此,本文选取土壤中两类性质截然不同的黏土矿物(膨润土和高岭土),研究其对Sb和P的竞争吸附特性,以期为Sb的污染控制和治理提供理论依据和参考。
1 材料与方法
1.1 供试材料和仪器
1.1.1 供试材料 膨润土(Na基蒙脱石),购自Alfa Aesar;高岭土(天然的高岭石),购自Sigma-Aldrich。二者的基本性质见表1,试验前不作任何预处理。
1.1.2 主要仪器 原子荧光光度计(AFS930,北京吉天),紫外可见分光光度计(U-3900H,日本Hitachi),水浴恒温振荡器(HZS-HA,哈尔滨东联),加热控制磁力搅拌器(RET control型,德国IKA),高速离心机(3-15,德国Sigma),自动电位滴定仪(888 Titrando,瑞士Metrohm),电子分析天平(BSA224,德国Sartorius),电热恒温鼓风干燥箱(BGZ-246,上海博讯)。
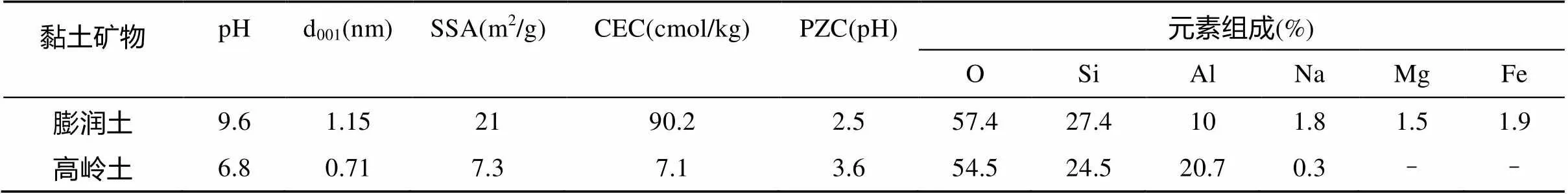
表1 黏土矿物基本性质
注:层间距(d001)以X-射线衍射仪测定(Shimadzu XRD-7000);比表面积(SSA)以自动表面积测定仪测量(Autosorb-1-MP 1530VP);元素组成以X-射线能量色散谱仪测量(Hitachi S-4800);CEC和PZC数据引自Cai等[18]数据。
1.1.3 化学试剂 六羟基锑酸钾(KSb(OH)6,Sigma-Aldrich);磷酸二氢钾(KH2PO4)、钼酸铵((NH4)6Mo7O24∙4H2O)、抗坏血酸(C6H8O6)、酒石酸锑钾(KSbC4H4O7∙0.5H2O)、二硝基酚(C6H4N2O5)、氢氧化钾(KOH)、硫脲(CH4N2S)、硼氢化钾(KBH4),皆分析纯;盐酸(HCl)、硝酸(HNO3)和硫酸(H2SO4),皆优级纯,全都购自上海国药集团。
1.2 试验方法
1.2.1 Sb/P竞争等温吸附 设置3组试验:①Sb/P同时加入,50 ml离心管中称取1 g黏土矿物(膨润土、高岭土),同时加入10 ml不同浓度KSb(OH)6(0.075、0.15、0.2、0.25、0.3、0.35 mmol/L)和10 ml不同浓度KH2PO4(0.3、0.6、0.9、1.2、1.5、1.8 mmol/L),放置水浴恒温振荡器中,在25℃、200 r/min下振荡48 h;②先Sb后P加入,先加入10 ml不同浓度KSb(OH)6,同条件下振荡24 h,再加入10 ml不同浓度KH2PO4,继续震荡24 h;③先P后Sb加入,先加入10 ml不同浓度KH2PO4,同条件下振荡24 h,再加入10 ml不同浓度KSb(OH)6,继续震荡24 h。震荡结束后,在高速离心机上离心10 min(转速9 000 r/min),取上清液测Sb和P的浓度,用差减法计算各自吸附量。所有处理均设置3次重复,取平均值用于相关模型计算;同时作空白对照(没有吸附剂),以校准初始浓度。
1.2.2 pH影响Sb/P竞争吸附 50 ml离心管中称取0.5 g黏土矿物(膨润土、高岭土),加入20 ml超纯水盖好摇匀,用HNO3和KOH调pH梯度为2.5、3.5、4.5、5.5、6.5、7.5、8.5;然后加入5 ml Sb/P混合液(2.5 ml 0.3 mmol/L KSb(OH)6+ 2.5 ml 1.5 mmol/L KH2PO4),补超纯水至30 ml;放置水浴恒温振荡器中,在25℃、200 r/min下振荡24 h。离心、取上清液测Sb、P浓度,计算吸附量。重复3次,同时作空白对照。
1.2.3 Sb/P竞争吸附动力学 500 ml三角瓶中加入300 ml Sb/P混合液(150 ml 0.1 mmol/L KSb(OH)6+ 150 ml 0.5 mmol/L KH2PO4),25℃恒温水浴下磁力搅拌(200 r/min);稳定后加入5 g黏土矿物(膨润土、高岭土),开始计时反应,分别在2、15、30、60、120、240、360、720、1440 min时,取出10 ml反应液,离心、取上清液测Sb、P浓度。重复3次,并作空白对照。
1.3 测试分析和数据处理
1.3.1 Sb和P测试分析 采用原子荧光光度计AFS930测定上清液Sb浓度,测定前加入5% 的硫脲+抗坏血酸溶液及4 mol/L HCl,室温放置30 min;测定时将2% 硼氢化钾溶于0.5% KOH作还原剂,以5% HCl作载流液。
采用钼锑抗比色法测上清液P浓度,即钼锑抗混合液显色、紫外可见分光光度计(U-3900H)660 nm波长处测定。
1.3.2 数据处理 Sb和P吸附量计算式如下:
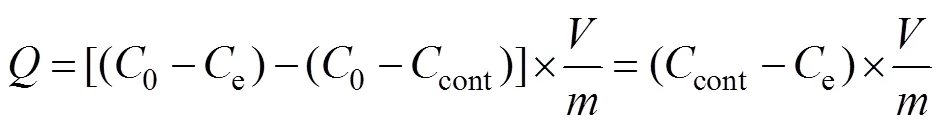
式中:为Sb或P吸附量(mmol/kg);0、cont和e分别是初始添加浓度、空白对照液浓度和吸附剂中的平衡浓度(mmol/L);为溶液体积(ml);是吸附剂质量(g)。
Microsoft Excel 2010进行数据计算,SigmaPlot 12.0进行方程拟合及作图。
2 结果与讨论
2.1 Sb和P在膨润土和高岭土上的竞争吸附等温线
含氧阴离子在土壤及土壤矿物上的吸附多遵循Langmuir或Freundlich方程,其方程式如下:
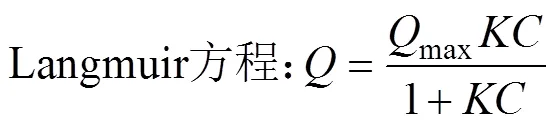
(3)
式中:为离子吸附量(mmol/kg),max是平衡吸附量(最大吸附量)(mmol/kg);为离子平衡溶液浓度(mmol/L);是与吸附能相关的常数,代表亲合性大小(L/mmol);K是与吸附容量相关的参数,单位依赖于和,而是吸附指数,无量纲,值在0 ~ 1之间,越接近0,吸附的不均匀性越大,即多层吸附发生[19]。
Sb和P的竞争吸附等温线及其模型拟合见图1和表2。在Sb、P共存下,无论是膨润土还是高岭土,对二者的吸附都较好地符合Langmuir或Freundlich方程(2= 0.945 0 ~ 0.998 3,< 0.000 1)。从2来看,两个方程间虽然没有明显差异,但P吸附的拟合度更高(平均2= 0.988),且更符合Freundlich方程;相反,Sb吸附的拟合度较低(平均2= 0.975),且更符合Langmuir方程。这暗示尽管Sb和P同属于氮族元素,但二者在土壤黏土矿物上的吸附机制有所不同,自然,将影响到二者的竞争吸附特性。
从图1和表2可看出,膨润土对Sb吸附小于高岭土,但对P吸附却大于高岭土,即两种黏土矿物对Sb和P的吸附行为正好相反。例如,Sb/P同时加入高岭土时,Sb的max= 0.77 mmol/kg,P的max= 2.38 mmol/kg;而Sb/P同时加入膨润土时,其值分别为0.49 mmol/kg(降低36%)和6.61 mmol/kg(增加177.7%)。这与席建红等[12]研究不相符,他们发现膨润土比高岭土对Sb和P都有更强吸附,源于膨润土巨大的比表面积(高岭土的40倍)。在本研究中,所用膨润土比表面积21 m2/g,仅是高岭土的3倍,而其pH高达9.6,远高于高岭土(pH 6.8)(表1),或许比表面积和pH共同作用,导致了二者对Sb和P的吸附能力存在明显差异:P吸附更强,其吸附容量更多受制于比表面积;Sb吸附较弱,其吸附容量更多受制于表面正电荷(pH)。
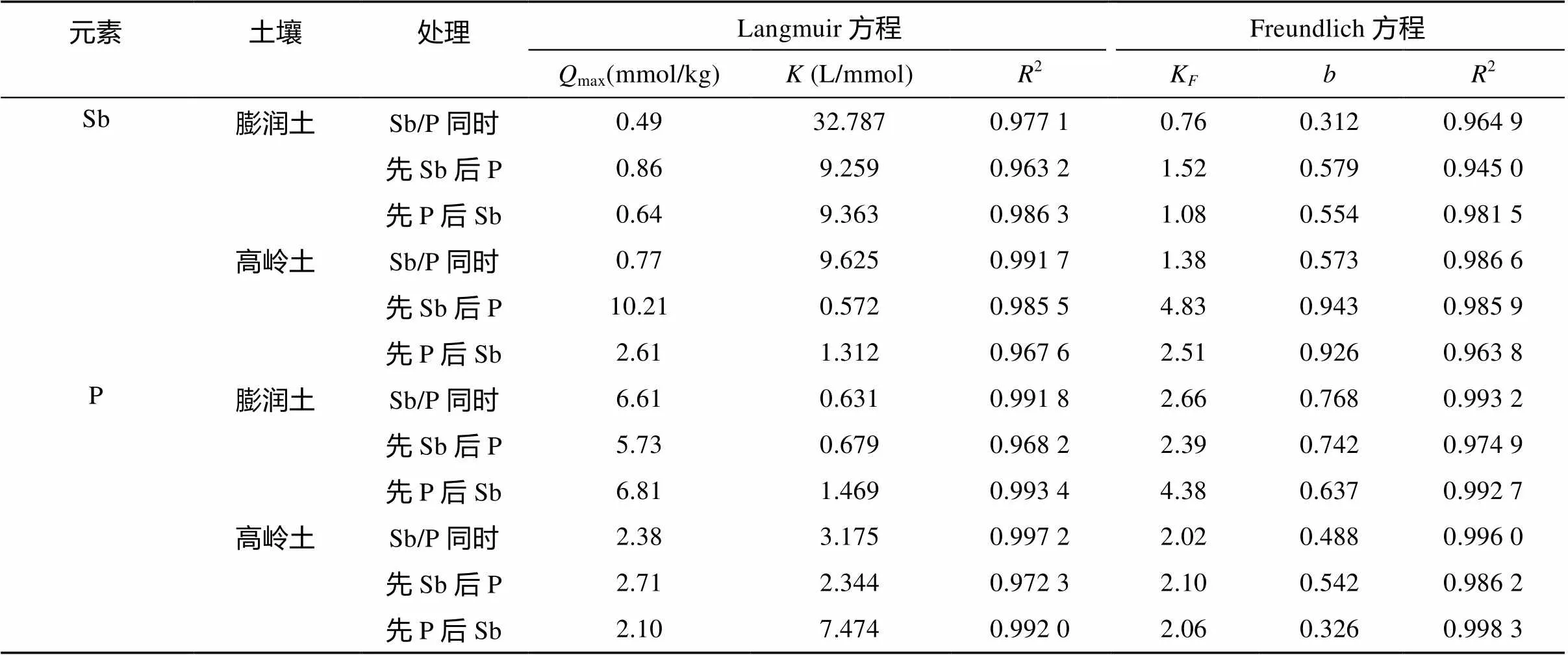
表2 等温吸附方程拟合
和多数研究结果一致,P强烈抑制Sb的吸附[13-15],不仅如此,Sb也强烈抑制P的吸附(图1和表2),即Sb-P之间存在明显竞争作用。无论Sb还是P,先加入时的吸附容量max都高于后加入与同时加入,并且P对Sb的竞争主要发生在高岭土,Sb对P的竞争主要发生在膨润土。例如,3种加入方式下,Sb在高岭土上max分别为10.21、2.61、0.77 mmol/kg;P在膨润土上max分别为6.81、5.73、6.61 mmol/kg。进一步地,根据表2,可知Sb存在下,P吸附亲合性明显降低、吸附指数明显增加,即促进了P吸附逐渐由多层向单层转变[19],其吸附能力减弱。由此,可推测Sb对P的竞争,更多的是降低P的吸附亲合力。
2.2 pH对Sb/P竞争吸附的影响
在Sb-P共存下,随pH升高(2.5 ~ 8.5),Sb吸附持续降低(指数曲线),而P吸附先增加后降低(抛物线曲线)(图2)。对Sb而言,在膨润土上,吸附量从1.77 mmol/kg下降到0.18 mmol/kg;在高岭土上则从1.19 mmol/kg降低到0.24 mmol/kg。对P而言,在膨润土上,吸附峰值出现在pH 3.5,达3.64 mmol/kg,随后快速下降到pH 8.5的0.36 mmol/kg;在高岭土上,则延迟到pH 4.5出现最大值(2.19 mmol/kg),随后缓慢下降,pH 8.5时尚有1.32 mmol/kg。这说明无论是Sb还是P,在土壤矿物上的吸附都强烈依赖于体系pH:通常低pH时吸附量大,高pH时吸附量小。因为阴离子带有负电荷,黏土矿物在低pH时拥有一定量的正电荷,将增加电性吸附比例。同时,含氧阴离子有相当数量的配位吸附(专性吸附),不依赖于表面电荷,因此,在较高pH时也有一定比例的吸附[20-21]。多数研究也都证实了Sb和P的吸附受制于土壤pH,并且也与本研究结果基本一致,即P吸附出现峰值,而Sb吸附持续下降[12, 22-26]。
无论Sb还是P,其吸附随pH升高而下降的趋势都是在膨润土上更加突出,这样就导致较低pH时膨润土上的吸附高于高岭土,但在较高pH下却逆转,即膨润土上的吸附低于高岭土。从图2可看出,Sb吸附转折点在pH 6;对P吸附则在pH 5.5。这说明膨润土对含氧阴离子吸附以电性吸附为主,受pH影响更大;而高岭土对其吸附以专性吸附为主,受pH影响较小。而且,从图2还可得出结论:P比Sb有更强的专性吸附,所以在较高pH时仍能保持较高的吸附量。由此,表2显示的Sb在高岭土上的饱和吸附量(max)远大于膨润土,是因为Sb吸附更多是受pH控制的电性吸附,而前者pH低(正电荷量多);P在膨润土上的max远大于高岭土,则是因为P吸附更多是受比表面积控制的专性吸附,而前者比表面积大。
随pH增加,磷酸根等含氧酸根离子形态发生变化(如H2PO– 4、HPO2– 4、PO3– 4,pa分别为2.12、7.20、12.36),土壤矿物表面电荷也发生变化,综合效应通常是:在pa附近出现最大吸附值或者吸附曲线发生明显转折[25, 27]。显然,这个峰值处pH不仅与磷酸盐的pa关系密切,而且与矿物的零电荷点(PZC)也紧密相关,图2显示高岭土上P吸附最大值发生在pH 4.5,高于膨润土的pH 3.5,应该主要是前者有更高的PZC之故(高岭土PZC = 3.6、膨润土PZC = 2.5)(表1)。总之,本研究结果进一步证实Sb/P等含氧阴离子竞争吸附主要受体系pH控制,但在两种黏土矿物上又有明显区别,即又受制于黏土矿物的比表面积和阴离子的吸附能力:Sb及膨润土吸附更强依赖pH,P及高岭土吸附则更强依赖于黏土矿物性质(比表面积等)。
总之,Sb/P在高岭土和膨润土上的竞争吸附差异主要源于这两类黏土矿物的性质(pH、氧化铝含量、比表面积)及含氧酸阴离子的离子形态与吸附特性。Sb和P的吸附都有较大比例的电性吸附(随pH升高而降低),同时又有相当比例的配位吸附(不依赖于表面电荷)。膨润土及Sb吸附以电性吸附为主,受正电荷(pH决定)影响大;高岭土及P吸附以专性吸附为主,受表面性质(比面积决定)影响大。因此,Sb对P的竞争主要是电性吸附竞争,在膨润土上更突出;P对Sb的竞争主要是配位吸附竞争,在高岭土上更明显。
2.3 Sb/P竞争吸附的动力学
含氧酸阴离子与重金属离子吸附通常遵循准二级动力学方程(pseudo second-order kinetic equation),意味着化学吸附(配位交换吸附)占主导[28-30],其表达式如下:
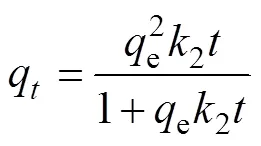
线性方程式如下:
(5)
式中:q为时间(min)时Sb或P吸附量(mmol/kg);e是平衡吸附量(mmol/kg);2为准二级反应速率常数(kg/(mmol·min));=2e2,是初始吸附速率(= 0时,mmol/(kg·min))。
以/q~线性作图,根据斜率和截距,可以计算参数e、2及值,其线性图见图3,方程参数拟合值见表3。可看出Sb/P在膨润土和高岭土上的竞争吸附很好地符合准二级动力学方程,2> 0.994,< 0.000 1。
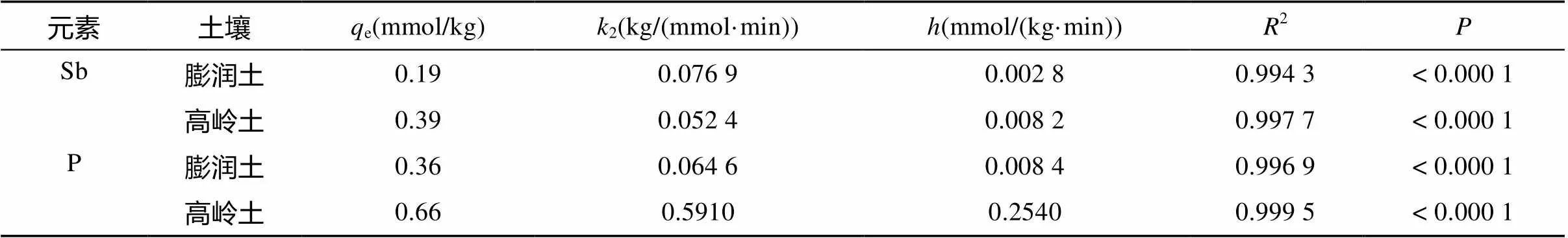
表3 准二级动力学方程拟合参数
从图3和表3明显看出,对Sb和P的吸附都是高岭土 > 膨润土,约1倍的差距,如Sb的e分别是0.39 mmol/kg和0.19 mmol/kg;P的e分别为0.66 mmol/kg和0.36 mmol/kg。另外,2也是高岭土(分别0.997 7、0.999 5)高于膨润土(分别0.994 3、0.996 9)。这些都暗示对Sb/P竞争吸附体系,在高岭土上有更高比例的化学吸附,利于这些离子固持。进而,根据表3,也看出P的吸附有更高的2,说明它更符合准二级动力学方程,在黏土矿物上有更多的化学吸附。不过,两个离子的吸附速率(2和)却截然不同:对Sb而言,高岭土上e大,但2和都明显小于膨润土;对P而言,高岭土上e、2、都明显高于膨润土(表3),说明高岭土对P的吸附不仅强而且快,对Sb的吸附虽然强但较慢;膨润土对P的吸附既弱又慢,对Sb的吸附虽弱但较快。可能,这种差异主要来自Sb、P在pH 6.8(高岭土)和pH 9.6(膨润土)两种环境下的离子形态及离子吸附特性的不同。
3 结论
1) Sb/P在膨润土和高岭土上的吸附符合Langmuir或Freundlich方程(2= 0.945 0 ~ 0.998 3,< 0.000 1),存在极强的竞争吸附:P显著降低Sb的max,Sb则主要降低P的吸附亲合性;Sb对P吸附的竞争在膨润土上更明显,而P对Sb吸附的竞争则是在高岭土上更明显。
2) 随pH升高(2.5 ~ 8.5),Sb吸附持续降低(指数曲线),而P吸附先增加后降低(抛物线曲线);Sb和P的竞争吸附符合准二级动力学方程,且高岭土上有更高的2(0.997 7、0.999 5),膨润土上R稍低(0.994 3、0.996 9),证实高岭土对两个离子有更高比例化学吸附。
3)Sb/P共存下,高岭土对P吸附强而快,对Sb吸附虽强但慢;相反,膨润土对P吸附弱而慢,对Sb吸附虽弱但快。
总之,Sb对P吸附的抑制在膨润土上更明显(主要是静电吸附竞争),P对Sb吸附的抑制则在高岭土上更突出(主要是配位吸附竞争)。
[1] Filella M, Belzile N, Chen Y W. Antimony in the environment: A review focused on natural waters: I. Occurrence[J]. Earth Science Reviews, 2002, 57(1/2): 125–176
[2] 何孟常, 万红艳. 环境中锑的分布、存在形态及毒性和生物有效性[J]. 化学进展, 2004, 16(1) : 131–135
[3] U.S. Geological Survey. Mineral commodity summaries 2015 [EB/OL]. [2016-06-21] http://dx.doi.org/10.3133/ 70140094
[4] 袁程, 张红振, 池婷, 等. 中南某锑矿及其周边农田土壤与植物重金属污染研究[J]. 土壤, 2015, 47(5): 960–964
[5] Okkenhaug G, Zhu Y G, Luo L, et al. Distribution, speciation and availability of antimony (Sb) in soils and terrestrial plants from an active Sb mining area[J]. Environmental Pollution, 2011, 159(10): 2427–2434
[6] Denys S, Tack K, Caboche J, et al. Bioaccessibility, solid phase distribution, and speciation of Sb in soils and in digestive fluids[J]. Chemosphere, 2009, 74(5): 711–716
[7] Takahashi T, Shozugawa K, Matsuo M. Contribution of amorphous iron compounds to adsorptions of pentavalent antimony by soils[J]. Water, Air, and Soil Pollution, 2010, 208 (1/2/3/4): 165–172
[8] Wilson S C, Lockwood P V, Aahley P M, et al. The chemistry and behaviour of antimony in the soil environment with comparisons to arsenic: A critical review[J]. Environmental Pollution, 2010, 158(5): 1169– 1181
[9] Filella M, Williams P A. Antimony interactions with heterogeneous complexants in waters, sediments and soils: A review of binding data for homologous compounds[J]. Chemie der Erde-Geochemistry, 2012, 72(Supplement 4): 49–65
[10] Vithanage M, Rajapaksha A U, Dou X M, et al. Surface complexation modeling and spectroscopic evidence of antimony adsorption on iron-oxide-rich red earth soils[J]. Journal of Colloid and Interface Science, 2013, 406: 217–224
[11] Guo X J, Wu Z J, He M C, et al. Adsorption of antimony onto iron oxyhydroxides: Adsorption behavior and surface structure[J]. Journal of Hazardous Materials, 2014, 276: 339–345
[12] 席建红, 何孟常, 林春野, 等. Sb (V)在三种矿物表面的吸附行为[J]. 土壤通报, 2010, 41(1): 38–42
[13] Nakamaru Y, Tagami K, Uchida S. Antimony mobility in Japanese agricultural soils and the factors affecting antimony sorption behavior[J]. Environmental Pollution, 2006, 141(2): 321–326
[14] Biver M, Krachler M, Shotyk W. The desorption of antimony (V) from sediments, hydrous oxides, and clay minerals by carbonate, phosphate, sulfate, nitrate, and chloride[J]. Journal of Environmental Quality, 2011, 40(4): 1143–1152
[15] Xi J H, He M C, Lin C Y. Adsorption of antimony (III) and antimony (V) on bentonite: Kinetics, thermodynamics and anion competition[J]. Microchemical Journal, 2011, 97 (Special 1): 85–91
[16] Xi J H, He M C, Zhang G L. Antimony adsorption on kaolinite in the presence of competitive anions[J]. Environmental Earth Sciences, 2014, 71(7): 2989–2997
[17] Canecka L, Bujdos M, Matus P, et al. Kinetic sorption study of arsenic, antimony and phosphorus onto synthetic iron oxides[J]. Fresenius Environmental Bulletin, 2011, 20(12A): 3401–3404
[18] Cai P, Huang Q Y, Zhang X W. Microcalorimetric studies of the effects of MgCl2concentrations and pH on the adsorption of DNA on montmorillonite, kaolinite and goethite[J]. Applied Clay Science, 2006, 32(1-2): 147–152
[19] Foo K Y, Hameed B H. Insights into the modeling of adsorption isotherm systems[J]. Chemical Engineering Journal, 2010, 156 (1): 2–10
[20] Parfitt R L. Anion adsorption by soils and soil materials[J]. Advances in Agronomy, 1978, 30: 1–50
[21] 于天仁, 季国亮, 丁昌璞, 等. 可变电荷土壤的电化学[M]. 北京: 科学出版社, 1996
[22] Devau N, Le Cadre E, Hinsinger P, et al. Soil pH controls the environmental availability of phosphorus: Experimental and mechanistic modelling approaches[J]. Applied Geochemistry, 2009, 24(11): 2163–2174
[23] Tighe M, Lockwood P, Wilson S. Adsorption of antimony (V) by floodplain soils, amorphous iron (III) hydroxide and humic acid[J]. Journal of Environmental Monitoring, 2005, 7(12): 1177–1185
[24] Xi J H, He M C, Lin C Y. Adsorption of antimony (V) on kaolinite as a function of pH, ionic strength and humic acid[J]. Environmental Earth Sciences, 2010, 60(4): 715–722
[25] Zhou A M, Tang H X, Wang D S. Phosphorus adsorption on natural sediments: Modeling and effects of pH and sediment composition[J]. Water Research, 2005, 39(7): 1245–1254
[26] 李璐璐, 张华, 周世伟, 等. 中国南方两类典型土壤对五价锑的吸附行为研究[J]. 土壤学报, 2014, 51(2): 278–285
[27] Hingston F J, Posner A M, Quirk J P. Anion adsorption by goethite and gibbsite: I. The role of the proton in determining adsorption envelopes[J]. Journal of Soil Science, 1972, 23(2): 177–192
[28] Sen Gupta S, Bhattacharyya K G. Kinetics of adsorption of metal ions on inorganic materials: A review[J]. Advances in Colloid and Interface Science, 2011, 162 (1/2): 39–58
[29] Li Z B, Hu J W, Duan S M, et al. A study on adsorption kinetics of antimony onto coconut shell activated carbon[J]. Advanced Materials Research, 2013, 788: 471–475
[30] Lalley J, Han C, Li X, et al. Phosphate adsorption using modified iron oxide-based sorbents in lake water: Kinetics, equilibrium, and column tests[J]. Chemical Engineering Journal, 2016, 284: 1386–1396
Competition Adsorption of Antimony (Sb) and Phosphorus (P) on Bentonite and Kaolinite
ZHOU Shiwei, ZHU Lina, HE Jingzhe, XU Minggang*
(National Engineering Laboratory for Improving Quality of Arable Land, Institute of Agricultural Resources and Regional Planning, Chinese Academy of Agricultural Sciences, Beijing 100081, China)
The competition adsorption isotherms and kinetics of antimony (Sb) and phosphorus (P) on bentonite and kaolinite were investigated by bath methods; the effects of pH on their competition adsorption were also studied. The results showed that the adsorption of Sb and P was fitted to Langmuir or Freundlich equation (2=0.945 0 – 0.998 3,<0.000 1), and strong competition adsorption occurred between them, where P decreased greatly Sb maximum adsorption capacity (max) from 0.86 and 10.21 mmol/kg (first Sb after P addition) to 0.64 and 2.61 mmol/kg (first P after Sb addition), respectively; while Sb markedly reduced P affinity constant () from 1.47 and 7.47 L/mmol (first P after Sb addition) to 0.68 and 2.34 L/mmol (first Sb after P addition), respectively. The competition adsorption of Sb and P depended strongly on solution pH where the adsorption generally decreased significantly with the increase of pH. The adsorption by bentonite was more dependent on pH than one by kaolinite, resulted in more electrostatic adsorption on the former and more specific adsorption on the latter, respectively. The competition adsorption of Sb and P could fit well pseudo second-order kinetic equation (2>0.994,<0.000 1), where P adsorption on kaolinite was stronger and rapider (e=0.66 mmol/kg,2=0.591 kg/(mmol·min)) than that on bentonite (e=0.36 mmol/kg,2=0.0646 kg/(mmol·min)); Sb adsorption on the former was stronger and slower (e=0.39 mmol/kg,2=0.0524 kg/(mmol·min)) than that on the latter (e=0.19 mmol/kg,2=0.0769 kg/(mmol·min)). So, there was more Sb inhibition for P adsorption on bentonite (mainly a competition between electrostatic adsorption), and more P inhibition for Sb adsorption on kaolinite (mainly a competition between ligand adsorption).
Competition adsorption; Antimony; Phosphorus; Clay mineral; pH effect
10.13758/j.cnki.tr.2017.03.010
X131.3;S153.3
A
国家自然科学基金项目(41271254)资助。
(xuminggang@caas.cn)
周世伟(1975—),男,博士,副研究员,主要从事土壤环境化学研究。E-mail:swzhou77@163.com

