DOX方案对比曲妥珠单抗联合DOX用于进展期胃癌新辅助治疗的疗效
周 宁,刘翠云,唐 勇
DOX方案对比曲妥珠单抗联合DOX用于进展期胃癌新辅助治疗的疗效
周 宁,刘翠云,唐 勇*
目的 观察多西他赛、奥沙利铂联合卡培他滨三药(简称DOX方案)对比曲妥珠单抗联合DOX用于进展期胃癌新辅助治疗的疗效。方法 对2013年1月至2016年1月于我院消化内科收治的80例行新辅助化疗的进展期胃癌患者进行回顾性分析。根据患者HER-2表达、经费及体质状况不同,以及接受新辅助化疗方案的不同分为2组:35例HER-2阳性患者采用曲妥珠单抗联合DOX(治疗组);45例HER-2阴性患者仅采用DOX方案(对照组)。每2周期复查影像学评估疗效,提交多学科讨论,通过讨论决定是否行手术治疗。观察记录两组患者的化疗疗效、相关不良反应及肿瘤降级情况,对比两组手术切除率、根治切除率及术后并发症。结果 80例患者全部完成完整的预定化疗,平均化疗2.58个周期。治疗组35例患者,PD 2例(5.7%),客观有效率65.7%,可手术病例33例(94.3%),其中R0切除29例(87.9%),病理反应率为75.8%;对照组45例,PD 5例(11.1%),客观有效率53.3%,可手术病例40例(88.9%),其中R0切除16例(40%),病理反应率为65%,两组近期临床疗效比较差异无统计学意义(P=0.543),手术切除率及病理反应率比较差异有统计学意义(P<0.05)。化疗期间两组共同的不良反应主要为白细胞减少和胃肠道反应,差异有统计学意义(1.0% vs. 1.35%,P=0.044)。结论 曲妥珠单抗联合化疗对比单纯化疗,在新辅助治疗后肿瘤的降级、降期更明显,且能降低化疗药的毒副反应,患者耐受性较好。
曲妥珠单抗;新辅助化疗;胃癌
0 引言
胃癌是我国最常见的恶性肿瘤之一,全球每年新发胃癌病例逾百万,其中约40%发生在中国[1],且多数患者就诊时已处于中晚期,无法直接行手术切除,在降低肿瘤的分期以争取最大可能的手术机会方面,新辅助化疗成为关注与努力的方向[2]。目前国内新辅助化疗方案多为联合用药,方案均来自胃癌辅助化疗的经验。常用方案包括ECF、DCF、FOLFIRI及其改良方案等,但毒副反应均较重。对于HER-2阳性的进展期胃癌患者,肿瘤生物学行为特殊,恶性程度较高,容易复发转移,对常规的细胞毒药物不敏感[3]。多项临床试验结果显示[4-5],可通过曲妥珠单抗联合单药或两药化疗的治疗模式来获益,且毒副反应低。曲妥珠单抗是一种重组DNA衍生的人源化单克隆抗体,能够与HER-2/neu蛋白高度亲和后调节下游细胞凋亡因子,控制肿瘤细胞的侵袭[6]。但是这种治疗模式仍集中于HER-2阳性晚期胃癌的一线治疗中,在新辅助治疗中的应用较少。另外,对于HER-2阴性、但体质状况尚可的进展期胃癌患者,临床上现已有推荐三药联合化疗的新辅助治疗模式[7-8],在短期缩小肿瘤,降低肿瘤负荷,提高手术切除率方面取得可观疗效、但两种治疗模式在抗瘤疗效、毒副反应、肿瘤降级及手术切除等方面尚无相关对比报道。
本文回顾性分析了2013年1月至2016年1月病理确诊并在本院行新辅助治疗的80例进展期胃癌患者。这些患者由于HER-2表达、经费及体质状况不同,接受新辅助化疗方案不同。DOX方案是目前临床上在胃癌化疗中应用较多的一项改良方案,本研究旨在分析和比较曲妥珠单抗联合DOX方案对比单纯DOX方案在胃癌患者新辅助治疗的临床疗效、毒副反应、肿瘤降级及手术切除等方面的影响,以期为胃癌的临床治疗寻找更多可获益的方案。
1 材料与方法
1.1 一般资料 本方案按回顾性临床研究方法设计。选择2013年1月至2016年1月新疆医科大学附属肿瘤医院消化内科收治的进展期胃癌患者80例为研究对象。其中男43例,女37例,年龄40~75岁,中位年龄58岁。根据患者HER-2表达、经费及体质状况,将HER-2阳性接受曲妥珠单抗联合DOX作为新辅助化疗方案的35例患者作为治疗组,其中男20例,女15例,平均年龄51.2岁;化疗前肿瘤分期为Ⅱ期14例,Ⅲ期21例;将HER-2阴性仅接受DOX三药联合的45例体质尚可的患者作为对照组,其中男23例,女22例,平均年龄52.3岁,化疗前肿瘤分期为Ⅱ期17例,Ⅲ期28例。两组患者性别、年龄、临床分期有均衡性。两组患者临床病理特征比较差异无统计学意义(P>0.05),具有可比性。见表1。
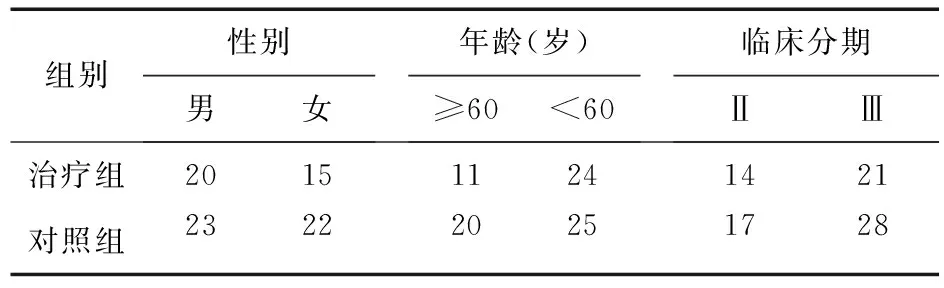
表1 两组患者临床特征(例)
1.2 入组标准 ①术前均经胃镜及活组织检查诊断为胃腺癌。②CT证实为局部进展期胃癌(肿瘤侵犯深度≥cT2或cN+、cM0)[9]。至少有1个可测量病灶;分期参照2010年国际抗癌联盟/美国癌症联合委员会(UICC/AJCC)TNM分期标准(第7版)。③HER-2阳性[免疫组织化学(IHC3+或IHC2+和FISH+)],HER-2检测染色评分标准参照2011版胃癌HER-2检测指南[10]。④患者为初治病例;心脏彩超示LVEF>50%,无充血性心力衰竭、心肌梗死病史;血常规及肝、肾功能均未见明显异常,无严重合并症。⑤一般状况评分(KPS)均≥70分;预计生存期超过3个月。本研究经本院伦理委员会批准,患者均已签署知情同意书。
1.3 药品 曲妥珠单抗(商品名:赫赛汀),规格:440 mg/瓶,上海罗氏制药;奥沙利铂注射液(商品名:艾恒),规格:50 mg/支,江苏恒瑞医药股份有限公司;多西他赛注射液(商品名:艾素),规格:20 mg;卡培他滨片(商品名:希罗达),规格:0.5 g/片,上海罗氏制药有限公司。
1.4 治疗方法 治疗组化疗方案为第1个周期曲妥珠单抗8 mg/m2,静点,d0+多西他赛60 mg/m2,静点,d1+奥沙利铂130 mg/m2,静点,d2+卡培他滨1 000 mg/m2口服bid,d1-14,q3w;第2个周期开始将曲妥珠单抗剂量改为6 mg/m2,余不变;对照组化疗方案为多西他赛60 mg/m2,静点,d1+奥沙利铂130 mg/m2,静点,d2+卡培他滨1 000 mg/m2口服bid,d1-14,q3w。每2个周期复查胃镜、CT,并依据RECIST 1.1标准评估疗效,提交多学科讨论,讨论决定患者是否接受手术,新辅助化疗最多不超过4个周期。化疗过程中注意监测血象及心功能变化。
1.5 观察指标与疗效判定 观察记录两组化疗后肿瘤客观有效率、化疗相关不良反应,手术切除率及手术根治率,对术后两组标本进行病理诊断,计算两组病理反应率。临床疗效评价标准:参照实体瘤的疗效评价标准(RECIST 1.1)客观疗效标准,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD),客观有效率(ORR)=CR%+PR%。化疗不良反应按照WHO抗癌药物常见不良反应分级标准分为0~Ⅳ级[11]。病理学评价参照日本胃癌疾病协会病理学变化标准,将肿瘤对治疗的反应分为如下等级。0级:未见肿瘤组织坏死;1a级:残留存活肿瘤细胞>67%;1b级:残留存活肿瘤细胞占33%~67%;2级:残留存活肿瘤细胞<33%;3级:肿瘤完全坏死,无存活肿瘤细胞残留。病理反应定义为≥1b级,3级即病理学完全缓解(pCR)[12]。
1.6 统计学处理 采用SPSS 20.0统计学软件。率的比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 新辅助化疗的临床疗效 入组的80例患者全部完成2~3个周期的新辅助化疗,平均2.58个周期,全部可评价疗效,治疗组客观有效率与对照组比较,差异无统计学意义(65.7% vs. 53.3%,P=0.543),见表2。
2.2 安全性评价 80例患者在化疗中均出现了不同程度的不良反应,以骨髓抑制和胃肠道反应为主。分别占总数的22%和33%,其次为腹泻(18%)、肝功能损害(17%)、四肢麻木(12%);治疗组主要为Ⅰ~Ⅱ级白细胞减少及胃肠道反应,对照组则以Ⅲ~Ⅳ级白细胞减少及胃肠道反应为主。上述不良反应经对症治疗后均好转,未影响化疗。见表3。

表3 两组患者化疗期间不良反应比较(例)
2.3 手术切除情况 治疗组35例患者中有2例因病情进展放弃手术。33例行手术切除,其中29例行R0切除术;对照组45例患者中有5例因化疗后病情进展放弃手术。40例完成化疗并接受了手术治疗,其中16例行R0切除术。治疗组R0切除率高于对照组(P<0.05),差异有统计学意义。见表4。

表4 两组患者手术切除情况比较(例,%)
注:*与对照组比较,P<0.05
2.4 两组术后病理学分级变化比较 参照日本胃癌疾病协会病理学变化标准,治疗组33例手术患者,术后病理学变化以1b级、2级为主,其中有1例达pCR;对照组40例手术患者,术后病理学变化以1a级、1b级为主;两组中均无0级患者。治疗组与对照组的病理反应率(≥1b级)分别为75.8%和65%,两组比较差异有统计学意义(P<0.05)。见表5。
2.5 两组新辅助化疗后病理分期比较 80例患者平均接受2.58个周期新辅助化疗后,7例因病情进展放弃手术,其余73例患者完成手术并取活组织行病检,据此对其进行分期。两组病理分期比较差异有统计学意义(P<0.05)。见表6。

表5 两组患者术后病理学分级比较(例,%)
注:*与对照组比较,P<0.05
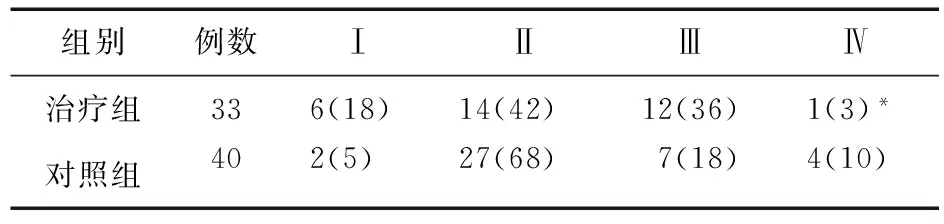
表6 两组新辅助化疗后病理分期比较(例,%)
注:*与对照组比较,P<0.05
2.6 手术患者肿瘤临床分期与病理学分期比较 对比73例手术患者新辅助化疗后的临床分期与病理分期,化疗后临床疗效评估完全缓解1例,但经病理学证实均并未达到完全缓解。提示临床分期与病理分期的不一致性。见表7。

表7 手术患者肿瘤临床分期与病理学分期比较(例)
2.7 术后并发症 两组患者术后并发症发生率比较差异无统计学意义(3.5% vs. 1.6%),其中治疗组2例十二指肠残端瘘;对照组3例切口感染,1例肺部感染。围术期均无死亡病例。
3 讨论
在我国,进展期患者仍是胃癌患者群的主体。新辅助化疗虽然能使进展期胃癌病变缩小,使肿瘤降级、降期,提高手术切除率,但联合用药的毒副反应重,患者耐受性差[13]。已有的Ⅲ期ToGA研究证实[14],抗人表皮生长因子受体2(HER2)单克隆抗体曲妥珠单抗联合化疗在HER2过表达晚期胃癌患者中的疗效比单纯化疗更高效低毒[15]。基于此,2011年,中国卫生部公布的《胃癌临床诊疗规范》推荐,对HER2阳性胃癌患者可考虑在化疗的基础上联合使用曲妥珠单抗。在此研究基础上,本研究通过对比曲妥珠单抗联合改良三药DOX与单纯DOX方案新辅助治疗进展期胃癌的疗效、安全性等,对其临床应用进行探讨。
本研究结果显示,全组80例患者均完成了术前新辅助化疗,平均化疗2.58个周期。其中73例患者完成手术治疗并送病检。45例完成D2淋巴结清扫(45/73,61.6%),28例患者(28/73,38.4%)因肿瘤较晚而仅行D1淋巴结清扫。所有手术标本均由经验丰富的病理学专家认真病检,并按照日本胃癌治疗指南对其进行病理学分期。结果显示,45例(61.6%)患者术后标本切缘阴性(R0),28例(38.4%)患者切缘阳性(R1)。其中治疗组新辅助化疗后CR 2例(5.6%),PR 21例(57.1%),SD 10例(28.6%),PD 2例(5.7%),总有效率达65.7%。R0切除率明显高于对照组(87.9% vs. 40%,P=0.042)。这与Kataokal等[16]的研究结果一致,且对比化疗前后肿瘤分期可发现TNM分期降期明显(P=0.034)。80例患者在化疗中均出现了不同程度的不良反应,以骨髓抑制和胃肠道反应为主。分别占总数的22%和33%,其次为腹泻(18%)、肝功能损害(17%)、四肢麻木(12%),治疗组主要以Ⅰ~Ⅱ级白细胞减少及胃肠道反应为主,对照组则以Ⅲ~Ⅳ级为主。两组不良反应发生率比较差异有统计学意义(1.0% vs. 1.35%,P=0.044)。上述不良反应通过及时适当调整化疗药物减量(多西他赛由70 mg/m2减为60 mg/m2)及升白细胞对症处理后均好转,未影响后续化疗。化疗过程中未出现心功能损害(LVEF>50%)。而术后相关并发症由于药物及相关预防性工作的完善,相关的不良反应基本得到很好的控制,术后并发症发生率比较差异无统计学意义(3.5% vs. 1.6%)。本研究中,我们评价分析了以含和不含曲妥珠单抗的联合新辅助化疗方案对进展期胃癌患者的临床疗效,两种方案的近期临床疗效虽无统计学差异(P=0.543),但在手术切除率、肿瘤病理降级、降期及不良反应发生率方面治疗组明显优于对照组(P<0.05)。
本研究中提及临床分期与病理分期不一致问题。1985-2009年,MSKCC的RC Fields教授针对此问题开展了5项前瞻性的研究[17],研究中入组的2 627例患者,其中714例患者行新辅助治疗,结果显示,治疗后200例临床CR的患者中仅60例(30%)获得了病理CR,而这部分患者复发率高达23%,其中脑转移(CNS)比例为36%。Biffi等[12]以多烯紫杉醇为主的TCF方案应用于局部进展期可切除胃癌的术前化疗中,术后病理提示pCR率仅为11.7%。本研究结果显示,入组的80例患者中仅治疗组有1例新辅助化疗后疗效评估达到临床CR,经术后病理分析显示,这1例患者并未达到pCR。可见,临床实际情况千变万化,CR并不等于治愈,对于CR的判读需要特别谨慎,判读后CR患者是否仍需积极手术更要仔细斟酌,获得pCR后治疗方法的探讨,目前较为统一的观点是应继续按照治疗前的分期进行手术,术后行辅助治疗,不应根据临床疗效调整甚至免除手术治疗,术后辅助治疗方面,也应追加完成所有化疗周期数[18-19]。
综上所述,胃癌新辅助化疗是一个相对较新的理念,目前在临床上应用逐渐增多,新型化疗药物为提高胃癌新辅助化疗的疗效提供了有力的手段。进展期HER-2阳性胃癌应用曲妥珠单抗联合DOX方案新辅助化疗具有较高的有效性,可以显著提高病理缓解率、D2/R0手术切除率,同时未增加手术风险;同时,单纯的DOX方案作为目前临床上应用较广的改良三药联合方案,虽毒副反应较重,但近期疗效、肿瘤切除率高,对于体质状况较佳的患者仍是不错的选择。
[1] JI JF.Recent progress in gastric cancer treatment[J].Evidence-based Med,2011,203(1):38-54.
[2] 杨洪霞,孙折玉,万海涛,等.局部进展期胃癌新辅助放化疗的疗效评价[J].医学研究杂志,2015,44(1):132-135.
[3] Yin K,Cao Y.Study on efficacy and safety of trastuzumab chemotherapy for the treatment of human epidermal growth factor receptor -2 positive breast cancer[J].Chin J Clin Pharmacol,2015,31(9):725-726.
[4] Cunningham D,Allum WH,Stenning SP,et al.Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer[J].N Engl J Med,2006,355(1):11-20.
[5] Okines AF,Cunningham D.Trastuzumab in gastric cancer[J].Eur J Cancer,2010,46(11):1949-1959.
[6] 李伟,潘燕,李学军.HER2阳性乳腺癌治疗药物曲妥珠单抗耐药机制及新一代靶向药物研究进展[J].中国临床药理学杂志,2014,30(1):48-51.
[7] 毛志远,郭晓川,苏丹,等.以多西他赛为基础的三药对比两药辅助化学疗法对胃癌根治术后临床疗效分析[J].华西医学,2013,10(2):1559-1563.
[8] 王长明,沈丕杰,卫子然,等.多西他赛、奥沙利铂联合卡培他滨新辅助化疗对进展期胃癌的疗效[J].药学服务与研究,2012,12(4):291-294.
[9] 魏尉,李东正,李刚,等.DOX新辅助化疗方案对进展期食管胃交界部癌和远端胃癌的效果评价[J].中国肿瘤外科杂志,2013,5(5):293-295.
[10]《胃癌HER-2检测指南》编写组.胃癌HER-2检测指南[J].中华病理学杂志,2011,40(8):553-557.
[11]Kanazawa K,Yokouchi H,Wang X,et al.Phase Ⅱ trial of carboplatin and pemetrexed as first-line chemotherapy for non-squamous non-small cell lung cancer and correlation between the efficacy/toxicity and genetic polymorphisms associated with pemetrexed metabolism:Hokkaido Lung Cancer Clinical Study Group Trial (HOT).0902[J].Cancer Chemother Pharmacol,2014,74(6):1149-1157.
[12]Japanese classification of gastric carcinoma--2nd English edition--response assessment of chemotherapy and radiotherapy for gastric carcinoma:clinical criteria[J].Gastric Cancer,2001,4(1):1-8.
[13]何耀明,马娟.应用铂类药物的新辅助化疗联合腹腔镜切除治疗T1期胃癌的临床效果观察[J].中国医药,2015,10(12):1783-1785.
[14]Bang YJ,Van Cutsem E,Feyereislova A,et al.Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA):a phase 3,open-label,randomised controlled trial[J].Lancet,2010,376(9742):687-697.
[15]王鑫昊,李云龙.靶向药物在进展期胃癌中的研究进展[J].中国医药,2017,12(2):316-320.
[16]Kataoka K,Tokunaga M,Mizusawa J,et al.A randomized Phase II trial of systemic chemotherapy with and without trastuzumab followed by surgery in HER2-positive advanced gastric or esophagogastric junction adenocarcinoma with extensive lymph node metastasis:Japan Clinical Oncology Group study JCOG1301 (Trigger Study)[J].Jpn J Clin Oncol,2015,45(11):1082-1086.
[17]Fields RC,Strong VE,Gönen M,et al.Recurrence and survival after pathologic complete response to preoperative therapy followed by surgery for gastric or gastrooesophageal adenocarcinoma[J].Br J Cancer,2011,104(12):1840-1087.
[18]Biffi R,Fazio N,Luca F,et al.Surgical outcome after docetaxel-based neoadjuvant chemotherapy in locally-advanced gastric cancer[J].World J Gastroenterol,2010,16(7):868-874.
[19]许哲,曹勤洪,王志勇,等.胃癌术前辅助治疗原发灶病理完全缓解16例病例报告[J].南京医科大学学报(自然科学版),2013,33(7):921-922.
Comparison of the clinical efficacy of DOX plan and trastuzumab plus DOX plan in the neo-adjuvant chemotherapy for gastric cancer
ZHOU Ning,LIU Cui-yun,TANG Yong*
(Department of Gastroenterology,Affiliated Tumor Hospital of Xinjiang Medical University,Urumqi 830011,China)
Objective To compare the efficacy of docetaxel,oxaliplatin plus capecitabine(called DOX) with that of trastuzumab plus DOX as neo-adjuvant chemotherapies in the treatment of advanced gastric cancer.Methods Eighty patients with advanced gastric cancer treated with neoadjuvant chemotherapy in our hospital from January 2013 to January 2016 were retrospectively analyzed.According to the HER2 expression,funding,and physical condition,the patients were divided into two groups:treatment group (HER-2-positive in 35 patients) and control group (HER-2-negative in 45 patients).Treatment group was given trastuzumab combined with DOX chemotherapy.Control group was given DOX chemotherapy.Assess efficacy by imaging every two periods,and submit multidisciplinary discussion,by which it was decided whether to conduct surgical treatment.The objective response rate,adverse reaction rate during chemotherapy,and the rate of tumor resection were observed,and the rate of laparotomy,pathological downgrading and postoperative complications were compared.Results All patients finished the neo-adjuvant chemotherapy.The average was 2.58 cycles.There were 35 cases in treatment group,PD 2 (5.7%),the objective response rate was 65.7%;there were 33 surgical cases (94.3%),in which R0 resection was performed in 29 cases (87.9%),and the pathological response rate was 75.8%;there were 45 cases in control group,PD 5 (11.1%),objective response rate was 53.3%;there were 40 surgical cases (88.9%),in which R0 resection was done in 16 cases (40%),and the pathological response rate was 65%.The two groups had no statistically significant difference in the recent clinical efficacy (P=0.543),but the rate of surgical resection and pathological response was statistically significant (P<0.05).The main common adverse effects during chemotherapy were neutropenia and gastrointestinal reactions,which had significant difference between the two groups (1.0% vs.1.35%,P=0.044).Conclusion Trastuzumab combined with DOX has a higher rate of laparotomy and pathological downgrading and a lower adverse reaction rate than chemotherapy alone.
Trastuzumab;Neo-adjuvant chemotherapy;Gastric cancer
2016-10-20
新疆医科大学附属肿瘤医院消化内科,乌鲁木齐 830011
新疆维吾尔自治区自然科学基金(2016D01C373)
10.14053/j.cnki.ppcr.201705006
*通信作者

