三明野生蕉和天宝蕉对Foc TR4侵染早期应答的差异
程春振, 马文昇, 刘炜婳, 张梓浩, 齐 全, 孙雪丽, 张永艳, 赖钟雄
(福建农林大学园艺植物生物工程研究所,福建 福州 350002)
三明野生蕉和天宝蕉对FocTR4侵染早期应答的差异
程春振, 马文昇, 刘炜婳, 张梓浩, 齐 全, 孙雪丽, 张永艳, 赖钟雄
(福建农林大学园艺植物生物工程研究所,福建 福州 350002)
以GFP标记的香蕉枯萎病菌FocTR4作为病原菌,比较了水培条件下FocTR4对“天宝蕉”和三明野生蕉的早期侵染情况.研究表明,FocTR4在“天宝蕉”韧皮部的定殖明显早于三明野生蕉.枯萎病菌感染香蕉后会诱发香蕉细胞内活性氧爆发和激活寄主抗氧化系统.通过研究水培和土培条件下两种香蕉种质接种枯萎病菌后根系超氧化物歧化酶(SOD)变化情况,发现三明野生蕉根系SOD活性高于“天宝蕉”,三明野生蕉感染枯萎病后根系SOD活性增强,而“天宝蕉”根系SOD活性下降,说明三明野生蕉的耐枯萎病能力可能与其根系较高和早期上调的SOD活性有关.
香蕉; 枯萎病; 绿色荧光蛋白; 超氧化物歧化酶; 早期应答
香蕉(Musaspp.)是全球重要的经济作物,是仅次于柑橘的第二大水果,同时也是仅次于水稻、小麦和玉米的第四大粮食作物[1].我国是香蕉的重要原产地,种植面积达41.3×104hm2,年产1 000多万吨,是世界上第二大香蕉生产国[2].香蕉产业已成为我国华南地区重要的农业支柱产业,然而近年来香蕉正遭受香蕉枯萎病的严重危害[3].Molina[4]研究表明,香蕉枯萎病是世界农业史上记载的分布最广、最具毁灭性的植物病害,是香蕉产业最大的威胁.目前该病害已发生在全球几乎所有的香蕉产区,并有迅速蔓延的趋势.
香蕉枯萎病是由尖孢镰刀菌古巴专化型(Fusariumoxyporumf. sp.cubense,Foc)引起的土传真菌病害.该病原菌根据寄主范围,可分为1号(Focrace 1),2号(Focrace 2)和4号(Focrace 4)生理小种.其中,4号小种根据其温度适应性的不同又可分为亚热带4号小种(Subtropical race 4,FocSTR4)和热带4号小种(Tropical race 4,FocTR4).FocTR4的致病寄主范围最广,致病能力也最强.国际香蕉和大蕉改良网络组织主席Emile Frison于2003年甚至发出警告:香蕉可能会因为FocTR4的危害在十年内灭绝!2013年,以香蕉作为粮食作物的非洲首次发现了FocTR4,引起了国际上的强烈关注[3].
Foc进入土壤后,在没有香蕉寄主的情况下仍可生存长达30年之久,使得香蕉枯萎病的防治难度极大[5,6].目前,香蕉枯萎病的防治办法主要有化学防治、农业防治、生物防治等.尽管做了很多探索,到目前为止仍未找到有效的化学试剂和农业、生物防治方法[7].抗病品种的选育是应对香蕉枯萎病的最根本、最有效、最持久的方法[8].栽培香蕉抗性较差,野生蕉在长期自然进化过程中保留了大量优良基因,在抗病、抗寒和抗逆等方面均表现出良好特性,为香蕉育种提供了重要的遗传资源[9,10].因此,有学者提出可以在栽培蕉选育中适当引入野生蕉基因(主要是B基因组基因)进而提高香蕉抗逆能力.
福建野生蕉资源丰富,已有研究表明,三明野生蕉在自然条件下很少出现枯萎病染病症状,枯萎病检出率也很低,说明其可能是研究野生蕉抗/耐枯萎病机理的理想材料.本研究拟以三明野生蕉和福建地区大量种植的“天宝蕉”为材料,比较分析枯萎病菌在二者根系中的定殖情况.枯萎病菌感染香蕉后会诱发香蕉细胞内活性氧爆发,活性氧的清除需要抗氧化活性物质的参与,因此香蕉感染枯萎病后细胞抗氧化物质活性可作为研究香蕉-枯萎病菌互作机制的重要指标[7,11].超氧化物歧化酶(superoxide dismutase, SOD)是普遍存在于植物中的一类抗氧化活性物质,有研究指出SOD活性越高,植物的抗逆性越强,发病程度越低[12,13].因此进一步研究了三明野生蕉和“天宝蕉”感染枯萎病后根系SOD活性的变化情况,以期为揭示野生蕉抗/耐病机理奠定基础.
1 材料与方法
1.1 试验材料
本试验所用“天宝蕉”和三明野生蕉组培苗均由福建农林大学园艺植物生物工程研究所提供,组培苗经生根炼苗后移栽至基质中.待香蕉苗长至四叶一心时将其分成2组,一组培养于改良Hoagland培养液中,另一组继续种植于基质中,水培1周后用于枯萎病菌侵染.接种所用GFP标记的FocTR4病原菌由福建农林大学植物保护学院云英子老师提供.
1.2 枯萎病菌孢子悬浮液的制备及孢子萌发情况观察
取出-20 ℃保存于斜面培养基的GFP标记的FocTR4,室温复苏1~2 h.取边缘菌丝接种于PDA培养基中部,于28 ℃生化培养箱中倒置培养1周后用无菌水洗下菌体,经6层无菌纱布过滤,获得枯萎病菌孢子悬浮液.
为确保孢子活性,将部分孢子悬浮液4 000 r·min-1离心5 min,用液体PDA培养基重悬孢子.在28 ℃,150 r·min-1的摇床中培养.每隔4 h取1 mL菌液于激光共聚焦显微镜(Olympus,型号:FV1200)下观察孢子活性及萌发能力,具体步骤参照Li et al[14]的方法.
1.3 枯萎病菌侵染试验
在光学显微镜下,用细胞计数器计算孢子浓度.分别向培养液和基质中倒入终浓度为5×106个·mL-1的孢子悬浮液.分别于接种病原菌后0、5、10、20和25 h取水培的“天宝蕉”和三明野生蕉根系,用无菌水冲洗根系,然后置于激光共聚焦显微镜(Olympus,型号:FV1200)下观察侵染情况.
1.4 SOD活性测定
接种病原菌后0、5、10、20和25 h分别取水培和土培的“天宝蕉”和三明野生蕉根系,用于SOD活性测定,具体步骤参照邓贵明的方法[7].
2 结果与分析
2.1 枯萎病菌孢子活力及萌发情况
为观察早期香蕉枯萎病菌孢子的萌发情况,在制备好孢子悬浮液后0、4、8、12 h进行取样,并在激光共聚焦显微镜下进行观察,4个不同时段孢子的形态结构如图1所示.在0 h时,孢子成圆球形,GFP荧光较强,说明孢子活力较好;4 h时,孢子伸长,说明此时孢子已经开始萌发;8 h时,已经可以观察到较为细长的菌丝;12 h时,在荧光共聚焦显微镜下可以观察到完整的菌丝体.通过GFP荧光的观察,说明实验室保存的GFP标记的FocTR4菌株活性较高,可用于后续枯萎病菌接种试验.

A-D分别为在PDA液体培养基中培养了0(A)、4(B)、8(C)和12 h(D)的GFP标记的Foc TR4孢子.
2.2 枯萎病菌侵染情况
在激光共聚焦显微镜下观察香蕉枯萎病菌侵染香蕉材料过程.如图2所示,0 h时“天宝蕉”和三明野生蕉根上均没有发现绿色荧光;5 h时“天宝蕉”和三明野生蕉根表皮层开始观察到GFP,说明已有孢子开始附着于根部;10 h时,可以观察到有枯萎病菌入侵到“天宝蕉”根系维管束,且枯萎病菌萌发管进一步延伸,而此时三明野生蕉根系中并没有发现枯萎病菌入侵到维管束的情况;20 h时,在“天宝蕉”根系维管束内发现了伸长的枯萎病菌菌丝,而此时,在三明野生蕉中仅发现菌丝附着于根表皮附近;25 h时,“天宝蕉”根系维管束内部发现了大量GFP标记的枯萎病菌菌丝,在三明野生蕉根系维管束中也开始发现枯萎病菌定殖,但三明野生蕉维管束中发现的枯萎病菌菌丝明显短于“天宝蕉”中发现的菌丝,说明三明野生蕉根系可能是通过分泌一些抗菌物质进而阻止枯萎病菌的入侵和抑制枯萎病菌的生长.

图2 枯萎病菌在“天宝蕉”(上图)和三明野生蕉(下图)根系中的侵染情况
2.3 枯萎病菌侵染对三明野生蕉和“天宝蕉”根系SOD活性的影响
根据枯萎病菌侵染情况,确定0、5、10、20和25 h为取样时间点.分别在这5个时间点取样,用于SOD酶活性的测定.如图3所示,水培条件下的“天宝蕉”、三明野生蕉的根系SOD活性分别高于各自土培材料的SOD活性;三明野生蕉根系SOD活性也高于“天宝蕉”.枯萎病敏感品种“天宝蕉”在水培环境或土培环境下,其SOD活性都是是呈缓慢下降趋势,这可能与它的感病性有关;而三明野生蕉在水培环境或土培环境下,其SOD活性总是略微下降后,又开始升高,直至达到峰值,说明三明野生蕉在感染枯萎病菌后抗氧化能力上升,这可能与它的耐病性有关.
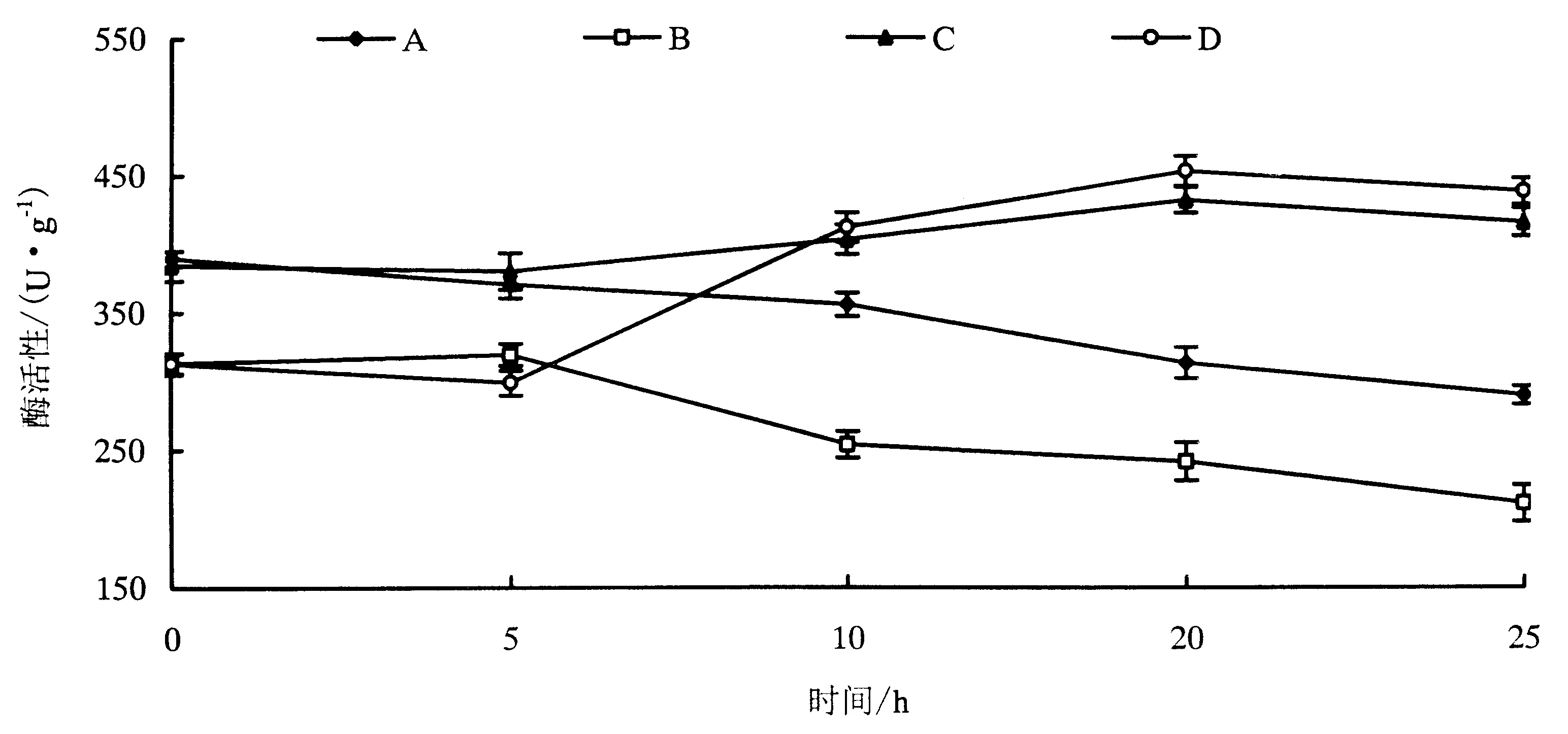
图3 水培和土培“天宝蕉”(A和B)及三明野生蕉(C和D)接种枯萎病菌后根系SOD活性变化情况
3 讨论
耐病性是植物与其病原生物在长期的互作过程中协同进化、相互选择、相互适应的结果[5,15].植物抗病、耐病生理生化机制复杂,防御酶在这个过程中发挥着重要的作用.病原侵入植物体后,植物会产生化学物质,如超氧阴离子自由基、过氧化氢等来抵御病原的入侵,而这些物质的产生又会对植物细胞造成危害[16-18].这时候植物就会提高相应清除这些有害物质的防御酶(如SOD等)活性,使植物体免受毒害或减轻伤害.因而,正常植株酶活性的高低、侵染后植株防御酶的活性变化可作为耐病品种筛选的指标之一[19].
本试验中敏感品种“天宝蕉”在水培和土培条件下SOD活性都是缓慢下降;而三明野生蕉SOD活性都是先下降后上升.说明三明野生蕉能更好地清除体内由枯萎病菌入侵产生的活性氧,减轻植株受到的毒害[20].另外,本研究还发现:在水培条件下,枯萎病菌入侵三明野生蕉维管束的速率要慢于“天宝蕉”,且入侵后菌丝的生长、伸长情况弱于“天宝蕉”,这说明三明野生蕉根系启动了抗逆防御机制,在病原菌侵染早期便表现出了更强的抗病性.这种抗病性能力可能与其根系中较高的SOD活性有关.
[1] MOFFAT A S. Crop engineering goes south[J]. Science, 1999,285,5426:370.
[2] 陆英.香蕉枯萎病抗性基因克隆及与抗性相关的差异蛋白分析[D].广州:华南农业大学,2012.
[4] MOLINA A B. Banana fusarium wilt management: towards sustainable cultivation: proceedings of the international workshop on the banana fusarium wilt disease: Genting Highlands Resort, Malaysia, 18-20 October 1999[M]. INIBAP, 2001.
[5] LI C, SHAO J, WANG Y, et al. Analysis of banana transcriptome and global gene expression profiles in banana roots in response to infection by race 1 and tropical race 4 ofFusariumoxysporumf. sp.cubense[J]. BMC Genomics, 2013,14(1):851.
[6] 左存武,李斌,李春雨,等.香蕉对尖孢镰刀菌热带4号小种的抗性评价方法的建立[J].园艺学报,2016,43(5):876-884.
[7] 邓贵明.尖孢镰刀菌(FocTR4)早期发育及其与香蕉互作的分子机理研究[D].广州:华南农业大学,2014.
[8] NEL B, STEINBERG C, LABYSCHAGNE N, et al. Evaluation of fungicides and sterilants for potential application in the management of Fusarium wilt of banana[J]. Crop Protection, 2007,26(4):697-705.
[9] D′HONT A, DENOEUD F, AURY J M, et al. The banana (Musaacuminata) genome and the evolution of monocotyledonous plants[J]. Nature, 2012,488,7 410:213-217.
[10] DAVEY M W, GUDIMELLA R, HARIKRISHNA J A, et al. A draftMusabalbisianagenome sequence for molecular genetics in polyploid, inter- and intra-specificMusahybrids[J]. BMC Genomics, 2013,14(1):683.
[11] 杨舒贻,陈晓阳,惠文凯,等.逆境胁迫下植物抗氧化酶系统响应研究进展[J].福建农林大学学报(自然科学版),2016,45(5):481-489.
[12] 于威,郝天龙.几种防御性酶在植物抗病方面的研究进展[J].北京农业,2014,36:133-134.
[13] 曾永三,王振中.活性氧和超氧化物歧化酶在植物抗病反应中的作用[J].仲恺农业技术学院学报,1999,12(4):55-63.
[14] LI C, CHEN S, ZUO C, et al. The use of GFP-transformed isolates to study infection of banana withFusariumoxysporumf. sp.cubenserace 4[J]. European Journal of Plant Pathology, 2011,131(2):327-340.
[15] LI C, DENG G, YANG J, et al. Transcriptome profiling of resistant and susceptible Cavendish banana roots following inoculation withFusariumoxysporumf. sp.cubensetropical race 4[J]. BMC Genomics, 2012,13(1):374.
[16] WANG Z, ZHANG J B, JIA C H, et al.DeNovocharacterization of the banana root transcriptome and analysis of gene expression underFusariumoxysporumf. sp.cubensetropical race 4 infection[J]. BMC Genomics, 2012,13(1):650.
[17] BAI T T, XIE W B, ZHOU P P, et al. Transcriptome and expression profile analysis of highly resistant and susceptible banana roots challenged withFusariumoxysporumf. sp.cubensetropical race 4[J]. PloS One, 2013,8(9):e73945.
[18] 黄永红,李春雨,左存武,等.韭菜对巴西香蕉枯萎病发生的抑制作用[J].中国生物防治学报,2011,27(3):344-348.
[19] 刘景梅,王璧生,陈霞,等.广东香蕉枯萎病菌生理小种RAPD技术的建立[J].广东农业科学,2004,4:43-45.
[20] 黄永辉,李瑜婷,范家平,等.香蕉枯萎病菌4号生理小种产生毒素条件的优化[J].华中农业大学学报,2011,30(5):594-598.
(责任编辑:吴显达)
Comparisons of early responses of ‘Tianbaojiao’ banana and Sanming wild banana toFocTR4 infection
CHENG Chunzhen, MA Wensheng, LIU Weihua, ZHANG Zihao, QI Quan,SUN Xueli, ZHANG Yongyan, LAI Zhongxiong
(Institute of Horticultural Biotechnology, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China)
GFP-labeledFocTR4 was used to infect Sanming wild banana and ‘Tianbaojiao’ banana, and its colonization was evaluated by spore and root development under laser scanning confocal microscope and superoxide dismutase (SOD) analysis of root. Colonization was first detected in the root phloem of ‘Tianbaojiao’ banana. Higher SOD activity was found in Sanming wild banana. And opposite changing patterns of SOD activity were found between 2 banana germplasms, with up-regulation being in Sanming wild banana and down-regulation in ‘Tianbaojiao banana’. It could be concluded that the higher and up-regulated SOD activity in the early infection stage is attributed to Fusarium wilt tolerance of Sanming wild banana.
banana; fusarium wilt; green fluorescent protein; superoxide dismutase; early response
2016-11-13
2016-12-30
国家自然科学基金项目(31601713);福建省中青年教师教育科研项目(JAT160166);福建农林大学A类人才科研启动基金(61201400707);福建省省级扶贫重点县科技人员专项计划(K15160001A);福建农林大学博士后启动基金(13230097).
程春振(1986-),男,讲师.研究方向:园艺植物生物技术.Email:ld0532cheng@126.com.通讯作者赖钟雄(1966-),男,研究员.研究方向:园艺植物生物技术.Email:Laizx01@163.com.
S668.1;S436.68
A
1671-5470(2017)04-0397-05
10.13323/j.cnki.j.fafu(nat.sci.).2017.04.006

