肺表面活性物质微气泡的研究进展
刘 东,杨 芳,顾 宁
(东南大学生物科学与医学工程学院,江苏省生物材料与器件重点实验室,江苏南京210096)
肺表面活性物质微气泡的研究进展
刘 东,杨 芳,顾 宁
(东南大学生物科学与医学工程学院,江苏省生物材料与器件重点实验室,江苏南京210096)

顾 宁
结合药学、生物学、生物医学工程、材料学等多种学科,微气泡超声造影剂由于具有超声显影增强和药物装载功能,目前正朝着实现组织靶向分子成像、结合其他成像模式的多模态成像以及结合药物或基因,集诊断与治疗功能为一体的多模式、多功能方向发展。肺表面活性物质存在于肺泡气液交界面上,是一种主要由磷脂和特异性蛋白质组成的脂蛋白复合物,具有降低肺泡表面张力,实现先天性免疫以及防止病原体入侵体内等功能。因此,由肺部表面活性物质作为膜壳层稳定形成的肺表面活性物质微气泡是一种新型的兼具超声成像和治疗功能的药物输运系统,是该领域的研究热点之一。系统阐述了微气泡在医学诊疗领域中的应用,以及近期肺表面活性物质微气泡的研究进展,并对其在治疗上的应用和发展前景进行了讨论。
微气泡;肺表面活性物质;诊疗学;超声
1 前 言
肺部表面活性物质是Ⅱ型肺泡上皮细胞合成和分泌的一种磷脂-蛋白复合物,自肺表面活性物质于1980年首次成功用于呼吸窘迫综合征(RDS)治疗以来,越来越多的关于肺部表面活性物质在RDS治疗的应用被报道[1]。肺表面活性物质具有降低肺泡表面张力、维持肺泡稳定性、提升气道的清除能力、增强肺免疫功能、减轻肺部炎症反应等多种作用,是维持人类正常呼吸功能的重要物质[2,3]。
微气泡是由膜壳层与内部空腔组成的一种物质,直径一般为1~10μm。由于微气泡在超声作用下具有较强的回波反射性能,能够使超声信号显著增强,从而提高组织显影的清晰度,具有良好的超声显像增强作用,以上功能使得微气泡作为超声造影剂得到进一步广泛的运用。此外,微气泡也可作为靶向药物或基因治疗的载体,减小对正常组织的毒副作用,增强疾病的靶向治疗效果[4,5]。天然肺表面活性物质微气泡于1955年首次被Pattle R E报道[6],在后续研究中发现,以肺表面活性物质微气泡作为载体在超声显影及药物递送方面显示出较大的应用潜力,主要表现为更高的载药量,以及更好的气泡稳定性[7]。本文首先概述了微气泡的制备方法以及在诊疗学的应用,其次对肺表面活性物质的性质及功能进行了介绍,最后对肺表面活性物质微气泡的构建及最新应用进行了评述,并对其在医学诊疗学领域的应用前景进行了展望。
2 微气泡在医学诊疗领域的应用
近30年来,微气泡作为有效的超声造影材料在超声造影领域得到了很大的发展。微气泡潜在更多的医学应用被报道,包括靶向药物输送、基因治疗、溶栓治疗、诊断治疗一体化等[8]。
2.1 微气泡的制备方法
微气泡的组成一般包括膜壳材料和填充气体两部分。目前,主要的膜壳材料有蛋白质类、脂质类、聚合物类和表面活性剂类等物质[9,10]。蛋白质类物质是应用最早的微气泡膜壳材料,主要以人血清蛋白的研究较多。脂质类膜壳材料例如脂质体作为微气泡膜壳可以通过化学修饰制备靶向功能的微气泡,但其稳定性仍需进一步探索优化[11]。聚合物作为膜壳材料形成的微气泡具有较好的稳定性,常用的聚合物有聚乙烯醇(PVA)、聚乙二醇(PEG)、聚乳酸-聚羟基乙酸共聚物(PLGA)、海藻酸盐等[12]。表面活性剂类膜壳材料主要包括司盘和吐温系列以及肺部表面活性物质类[9]。
理想的微气泡材料除了需要满足对人体的生物安全性之外,还需要具有足够的稳定性以保证进入人体后较长的存活时间以及回波强度,此外考虑到人体毛细血管粒径因素,微气泡的粒径也需要严格控制在一定的范围内。因此,为了制备达到临床使用要求的微气泡材料,对制备工艺具有一定的要求。同时,随着诊疗领域对微气泡更多更广的应用需求,对微气泡制备技术也提出了更高的要求,例如要求更好地控制微气泡的粒径、稳定性以及质量均一性等[13]。超声波法及高剪切乳化法等微气泡传统的制备方法虽具有较低的生产成本及提供较高的产品得率的优势,但难以很好的控制微泡的粒径及均一性,这就需要新的制备技术的发展来响应医疗领域对该材料的需求。例如同轴静电雾化法、微流控技术、膜乳化法等[14]。
2.1.1 超声法
超声法是微气泡制备过程中最为常用的方法,它是利用高强度的超声波将气体或液体分散在合适的包被材料中而制备微气泡。通常认为有两种机制参与了该过程,第一种机制认为气体或液体通过乳化形成含微滴/微泡的混悬液,蛋白质或表面活性物质自动吸附在微泡气液界面;第二种机制认为较高的温度和压力引发混悬剂的内部空化效应,从而导致微泡表面层化学改性而增加其稳定性[14,15]。实验研究发现,超声法制备的微气泡粒径分布与超声强度、能量以及脉冲的范围有较大的关系,通过超声法制备微气泡的粒径范围更广,如图1所示[14],由于给药途径一般为静脉注射,所以在使用该法制备的微气泡前,需要对较大直径的微气泡进行分离纯化,以防止造成静脉血管栓塞。

图1 采用不同方法(超声法、同轴静电雾化法、T型微流体法)制备的微气泡粒径分布图[14]Fig.1 Typical size distributions of microbubbles prepared from a phospholipid suspension via sonica-tion,CEHDA and a microfluidic T-junction device[14]
2.1.2 高剪切乳化法
高剪切乳化法也是制备微气泡较为常用的方法之一,尤其是针对以聚合物为膜层的微气泡。该方法先将聚合物溶解在合适的溶剂中,然后将聚合物溶液置入水溶液中,在高剪切力作用下进行乳化,同时加入另一种与水和聚合物均不混溶的液体作为稳定剂。溶解聚合物的溶剂需要有足够的挥发性,通过蒸发将聚合物沉淀到液滴的表面,形成内部为液滴的微球,再通过冲洗除去微球过多的溶剂,之后采用冷冻干燥法制备充气微泡[16,17]。同样地,微气泡粒径分布取决于初始乳液制备过程中液滴的大小,以及后续处理过程中微球的聚合情况。因此,为了使得微气泡在临床应用过程中大小符合要求,在使用前还需要进行复杂的分离步骤。
2.1.3 同轴静电雾化法
同轴静电雾化法(Coaxial Electrohydrodynamic Atomi-zation,CEHDA)是近期用于微气泡制备较为新型的方法之一。传统的静电雾化法机制是在电场的影响下,将一股液体集中到一个射流中,然后分裂形成液滴,并经雾化形成悬浮液。同轴静电雾化法是在传统静电雾化法基础上发展而来,即由两股液体同轴形成射流然后雾化形成均匀的液滴。在一定的气体流速、液体流速和电压影响下,可产生连续的微气泡流,并且通过调整相关参数来控制微气泡的尺寸及均匀性。与高剪切乳化法相比,该技术的一个显著优点是微气泡可以在单一的制备步骤中完成[18]。
2.1.4 微流体技术
微流体技术制备微气泡可以高度控制微气泡的粒径和多分散性,但和同轴静电雾化法不同,微流体装置仅能在有限的压力和流速条件下进行操作控制。目前采用微流体装置制备微气泡的方法主要有两种:采用软刻技术制备流体聚焦单元,以及由毛细管铺设在聚合物材料块上组成T型接口的机械组装单元[19,20]。这两种设备构建的基本特征均是在该装置上面设置开口,内部气体冲击流动液体并形成喷射流。然后离装置开口一定距离的气液界面变得很不稳定并在“夹断”模式下形成微气泡。与同轴静电雾化法一样,微流体技术制备的微气泡可以在单一的步骤中完成,并且具有制备多层组装结构微气泡的潜力,例如采用微流体技术可以制备表面膜壳同时含有表面活性剂和金纳米粒子的微气泡[21]。
除以上介绍的微气泡制备方法之外,其它制备方法还包括膜乳化法、喷墨打印法、纳米颗粒聚结法等[14]。
2.2 微气泡的应用进展
微气泡类造影剂的研制并成功应用于临床,快速推动了超声在诊断治疗领域的发展。目前,已有多种微气泡类超声造影剂上市,例如Albunex、Sonovue、Optison等[22]。超声微气泡除了作为超声造影剂之外,还可作为药物载体,将药物载入微气泡中,通过在靶部位选择性地破碎微气泡,可以达到局部定位给药的目的[23]。同时,可以联合微气泡的超声显影及载药功能,实现以微气泡为载体的诊断治疗一体化的研究。
2.2.1 疾病治疗中的应用研究
微气泡在超声能量辐照下破泡所产生的空化作用可以促进血栓溶解。由于微气泡能够显著降低超声的空化阈值,从而导致超声在较低能量下,局部产生增强的空化效应,使栓塞部位的微气泡瞬时破裂时引起血栓中的纤维被拉长和损坏,从而使血栓的溶解加速[24]。大量的实验验证了其促溶血栓作用,因此,微气泡已在溶栓治疗领域显示了一定的应用前景。
此外,微气泡在肿瘤治疗中也有一定的应用。恶性肿瘤的治疗一直是研究的重点与难点。肿瘤部位微血管在肿瘤细胞生长繁殖中起到重要的作用,研究发现,低功率超声破坏微气泡可促使供应肿瘤的微血管破裂而引起肿瘤逐渐凋亡[25],进而,通过微气泡膜壳中携带血栓形成物的微气泡载体结构,在肿瘤内通过超声破坏后可形成肿瘤部位微血管栓塞,可以导致肿瘤坏死[26]。
2.2.2 微气泡在药物/基因递送系统中的应用研究
新型药物传递系统(Drug Delivery System,DDS)是目前制剂技术领域最重要的研究方向之一,它的目的在于,一方面显著降低药物用量,减小药物的毒副作用,另一方面提高病灶部位的药物浓度,增强治疗效果。研究发现,通过对超声强度及微泡剂量进行控制,微泡制剂能够增强细胞膜的通透性而不损坏细胞膜。当超声能量达到一定值时,就会导致微气泡产生空化效应[27]。一方面,可使所载药物或基因得以释放;另一方面,空化效应会使毛细血管破裂,细胞膜上出现可逆性声孔,细胞膜通透性明显增高,可使释放出来的药物或基因更容易进入局部组织和细胞内,从而大大提高局部药物浓度,并达到体内定点释放药物,提高疗效的目的(如图2所示[28])。而且,通过改变超声的频率和强度,药物或基因的释放速度能够得到很好的控制。
2.2.3 微气泡“诊疗一体化”应用研究
医学诊断治疗一体化系统,简称“诊疗一体化”,指依托药物载体控释材料构建稳定、高效和安全的微纳载体,在该载体系统上装载抗癌药物和诊断探针,结合可高精度引导向病灶组织的靶向技术,整合药物靶向运输、活体示踪、药物治疗和预后监测等功能于一体的多功能体系。通过将诊断和治疗合为一体,一方面它将被用于完成对病灶部位的精确检测,并可以通过释放药物进行相应的治疗;另一方面也可以作为评价治疗手段有效性的重要依据,治疗后对病灶部位治疗效果的监测。微气泡载药系统一方面本身可以作为超声造影剂,进入血液循环后,可通过超声诊断仪实时监控微泡的输运到靶部位的情况,达到实时监测的目的;另一方面可以通过携带治疗药物或其它成分,在靶部位定向释放,达到治疗疾病的目的。同时,通过引入磁性纳米粒子制备磁性微气泡,可以实现外磁场精准调控对靶组织的准确定位和病灶部位的靶向运输药物进行监测[29]。杨芳等[30,31]制备了一种新型的微气泡超声造影剂,见图3。该微气泡结构包括中间的气体核心,聚乳酸PLA装载的Fe3O4纳米颗粒层和最外面聚乙烯醇膜层。经过超声显影体内外实验研究发现,包裹Fe3O4纳米颗粒的微气泡比未包裹Fe3O4纳米颗粒的微气泡具有更好的超声显影效果,同时,包裹Fe3O4纳米颗粒的微气泡的体外磁共振(MRI)实验显示,该微气泡具有MRI显影的功能,并且发现膜壳中Fe3O4纳米颗粒含量越高,微气泡的MRI效果越好。该课题组后续围绕磁性微气泡进行了一系列研究,研究证明磁性微气泡在“诊疗一体化”领域有较大的应用潜力[32-34]。
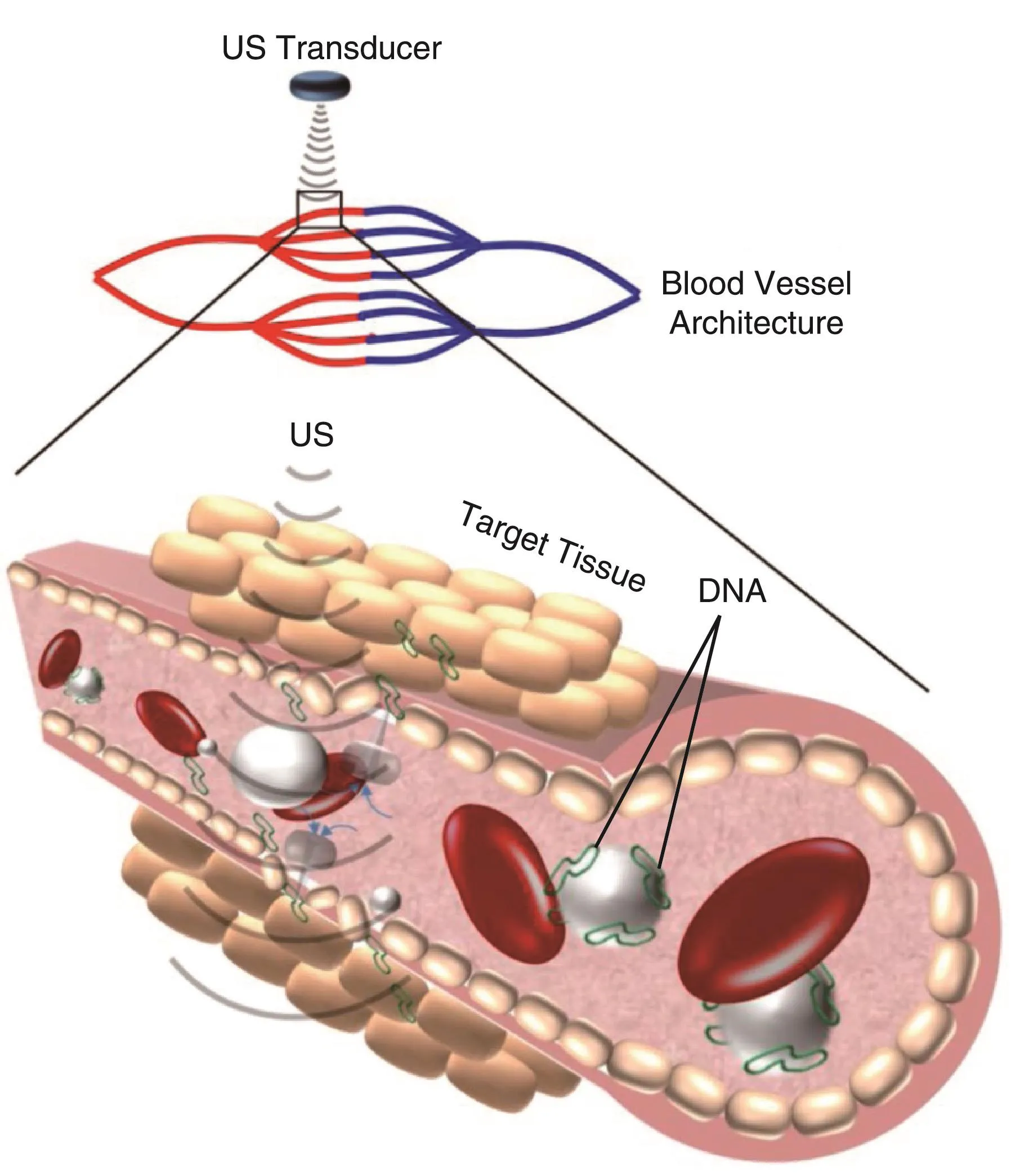
图2 超声介导微气泡载DNA向靶向组织渗透示意图[28]Fig.2 Schematic representation ofhow microbubble cavitation facilitates DNA(green)extravasation into tissue[28]
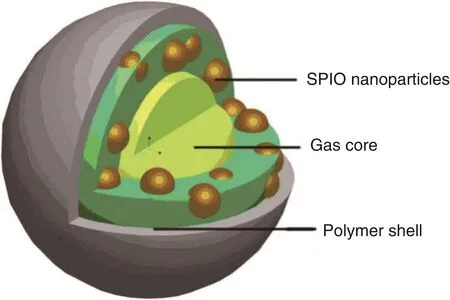
图3 含磁性纳米粒子微气泡设计示意图[31]Fig.3 Schematic diagram of the designed SPIO(superparamagnetic iron oxide)-inclusion encapsulated microbubble[31]
3 肺表面活性物质微气泡的研究进展
1955年,Pattle R E首次发现在肺组织可自发形成直径在40~50μm稳定的微气泡,并推断这些微气泡很可能是被肺部表面活性物质覆盖,并形成接近于零的表面张力[6]。近年来,研究发现与肺组织自发形成微气泡相同的脂质材料,可以用来人工制备微气泡,这在超声显影及治疗领域有着广泛的应用,说明两者在性质上具有一定的相似性,天然来源的肺表面活性物质形成的微气泡在医学领域仍有较大的研究价值和较为广阔的研究空间。
3.1 肺表面活性物质的性质及功能
肺表面活性物质(Pulmonary Surfactant,PS)是覆盖在支气管或肺泡气/液界面上的一种磷脂蛋白混合物,它是由肺泡上皮细泡合成和分泌,主要由90%的磷脂以及10%的蛋白质组成,其中磷脂酰胆碱(Phosphatidyl-choline,PC)是肺表面活性物质的主要磷脂类成分,约占脂质总量的80%。一般认为50%~60%的磷脂酰胆碱以饱和脂肪酰基的形式存在,主要形式为二棕榈磷脂酰胆碱(Dipalmitoyl-PC,DPPC),其它磷脂类成分主要包括磷脂酰甘油、磷脂酰乙醇胺、磷脂酰丝氨酸等[35]。除磷脂类成分,肺部表面活性物质含有多种肺表面活性蛋白(Surfactant Associated Protein,SP),目前已报道的活性蛋白主要有4种,即SP-A,SP-B,SP-C,SP-D,其中SP-A和SP-D是亲水性蛋白,SP-B和SP-C为疏水性蛋白[35]。SP-A是含量最为丰富的表面活性蛋白,约占蛋白总量的50%,分子量范围为30±4 kDa,其与SP-D在功能上具有相似性,主要与免疫防御及免疫调节相关。SP-B是由79个氨基酸组成的疏水性多肽,是肺表面活性物质中最关键的蛋白组分,具有促进磷脂在气液界面吸附、增加磷脂单分子层的稳定性以及参与板层体(Lamellar Body,LB)形成、对气道起宿主防御和稳定作用等功能。SP-C是由23个氨基酸组成的疏水蛋白,它通常可被嵌入脂质双分子层、对气液界面PS单分子层的形成和维护发挥重要作用[36]。SP-D能够激活肺部巨噬细胞,并与脂多糖结合,因此被认为参与机体的防御机制[37]。
综上所述,肺泡表面活性物质的主要功能是降低肺泡表面张力,减少肺泡塌陷,维持肺泡的稳定性,对新生儿正常肺功能的维护起着重要的作用。早产儿由于PS分泌不足会引发新生儿呼吸窘迫综合症(Neonatal Re-spiratory Distress Syndrome,NRDS),目前该类疾病主要采用PS的补充来达到治疗目的。此外,肺部表面活性物质蛋白类成分在增强肺免疫功能和减轻炎症反应等方面也起着非常重要的作用。
3.2 肺表面活性物质微气泡的构建研究
目前,微气泡已被广泛的应用于超声造影及药物传递系统研究之中[38],但肺部表面活性物质微气泡由于PS的引入,使其在医学显影和药物输运领域具有一些更为优良的性能。首先,天然来源的PS具有较低的毒性和免疫原性,虽然研究表明超声造影相对与X-射线扫描等方式具有更高的安全性[39],但造影剂处方组成等安全性问题仍然值得关注。其次,肺部表面活性物质能够迅速吸附到气/液界面。例如,新生儿肺表面活性物质在最初几次呼吸中必须快速吸附并提供正常肺功能[40]。同样,微气泡构建也需要快速的脂质吸附并形成单层气泡结构,否则微气泡将在短时间内溶解分散。因此肺部表面活性物质存在时更利于微气泡快速的形成。再者,肺部表面活性物质能够有效地降低表面张力,从而有效提高微气泡的稳定性。Sirsi等[41]采用Sur-vanta制备了一种肺部表面活性物质微气泡,并对其粒径、电位及微观形态进行观察(如图4所示),研究结果显示,利用外源性肺部表面活性物质Survanta,能够成功制备粒径范围在10μm以内的稳定微气泡,所形成微气泡表面呈较高的负电性,能够有效地防止微气泡的聚集和合并。通过优化处方,该肺部表面活性物质微气泡将在超声造影领域有一定的应用空间。

图4 Survanta肺部表面活性物质微气泡的制备:(a)气体成分对Survanta微泡得率的影响;(b)Survanta浓度对微泡得率的影响;(c)Survanta微气泡的Zeta电位测试;(d)通过脂溶性染料DiI对Survanta微气泡进行染色的荧光显微照片;(e)和(f)Survanta微气泡TEM照片[41]Fig.4 Survanta lung surfactant microbubbles are easily formed by the shaking method:(a)effect of gas composition on micro-bubble production yield,(b)effect of Survanta concentration on production yield of PFB filled microbubbles,(c)zeta potential measurements of Survanta microbubbles,(d)fluorescence microscopy of Survanta microbubbles doped with the lipoid dye DiI;(e)and(f)freeze-fracture electronmicroscopy(TEM)images of Survanta microbubbles[41]
微气泡可借助超声空化效应达到膜壳材料的无创靶向定点释放,但是由于微气泡膜壳层通常为单层膜,导致微气泡对脂溶性药物的包载非常有限。为此,Borden课题组[7]采用天然肺部表面活性物质提取物为膜壳材料制备了一种微气泡,并以脂溶性成分DiO为模型药物进行包载,研究结果显示含有SP-B和SP-C的肺部表面活性物质微气泡载药量为普通DPPC微气泡载药量的2倍以上,推测原因为肺部表面活性物质所含有的疏水性蛋白,可在微气泡表面形成皱褶,从而增加载药能力,如图5所示。同时,肺部表面活性微气泡超声造影成像在低噪音强度下具有更高的回声,并且靶向性实验结果表明,与普通脂质微气泡相比,生物素标记的肺部表面活性物质微气泡所包载荧光模型药物在靶部位显示出3倍的荧光强度,进一步表明肺部表面活性物质微气泡在靶向给药系统的应用潜力。

图5 Survanta微气泡与DPPC微气泡表面结构示意图。疏水性肺部表面活性物质蛋白SP-B和SP-C分别用红色和亮蓝色标注[7]Fig.5 Schematic comparing normallipid(DPPC)and Survanta micro-bubble shellarchitectures.Hydrophobic surfactantproteins SP-B and SP-C are shown in red and light blue,respectively[7]
4 结 语
经过研究人员多年的研究,关于肺部表面活性物质微气泡在诊断和治疗上的应用已经取得了一定的进展,但总体上处于研究的初级阶段,仍有较多的问题亟待解决:①膜壳材料成份的均一性问题,目前肺部表面活性物质微气泡的制备多采用天然来源的PS成份作为膜壳材料,批次间成份比例无法控制,均一性差;②稳定性问题,虽然肺部表面活性物质微气泡相对于普通脂质微气泡在稳定性方面有一定改善[38],但离成为优良的药物/基因载体仍有较大差距;③载药量较低,只有达到一定的药物浓度后才能完成对病灶部位疾病治疗目的,
这就需要微气泡载药量达到一定要求。此外,微气泡还面临着体内循环时间较短,易被网状内皮系统清除等问题。随着生物医学的发展,以上问题将会逐步得到解决,相信肺部表面活性物质微气泡这一新型药物/基因递送系统在诊断治疗学领域中将能发挥更大的作用。
References
[1] Halliday H L.Neonatology[J],2005,87(4):317-322.
[2] Zuo Y Y,Veldhuizen R A W,Neumann A W,et al.Biochimica et Biophysica Acta(BBA)-Biomembranes[J],2008,1778(10): 1947-1977.
[3] Rugonyi S,Biswas S C,Hall S B.Respiratory Physiology&Neurobiol-ogy[J],2008,163(1):244-255.
[4] Lindner J R.Nature Reviews Drug Discovery[J],2004,3(6): 527-533.
[5] Unger E,Porter T,Lindner J,et al.Advanced Drug Delivery Reviews [J],2014,72:110-126.
[6] Pattle R E.Nature[J],1955,175:1125-1126.
[7] Sirsi S R,Fung C,Garg S,et al.Theranostics[J],2013,3(6): 409-419.
[8] Cai X,Yang F,Gu N.Theranostics[J],2012,2(1):103-112.
[9] Sirsi S R,Borden M A.Bubble Science,Engineering&Technology [J],2009,1(1-2):3-17.
[10]Tinkov S,Bekeredjian R,Winter G,et al.Journal of Pharmaceutical Sciences[J],2009,98(6):1935-1961.
[11]Kwan J J,Borden M A.Advances in Colloid and Interface Science[J],2012,183:82-99.
[12]Sanna V,Pintus G,Bandiera P,et al.Molecular Pharmaceutics[J],2011,8(3):748-757.
[13]Klibanov A L.Medical&Biological Engineering&Computing[J],2009,47(8):875-882.
[14]Stride E,Edirisinghe M.Soft Matter[J]2008,4(12):2350-2359.
[15]De Cock I,Zagato E,Braeckmans K,et al.Journal of Controlled Re-lease[J],2015,197:20-28.
[16]Kothapalli S V V N,Wiklund M,Janerot-Sjoberg B,et al.Ultrasonics [J],2016,70:275-283.
[17]Fokong S,Theek B,Wu Z,et al.Journal of Controlled Release[J],2012,163(1):75-81.
[18]Farook U,Stride E,Edirisinghe M J.Journal of the Royal Society In-terface[J],2009,6(32):271-277.
[19]Xu J H,Li S W,Wang Y J,et al.Applied Physics Letters[J],2006,88(13):133506.
[20]Yang L,Wang K,Mak S,et al.Lab on a Chip[J],2013,13(17): 3355-3359.
[21]Mahalingam S,Raimi-Abraham B T,Craig D Q M,et al.Langmuir [J],2014,31(2):659-666.
[22]Unnikrishnan S,Klibanov A L.American Journal of Roentgenology [J],2012,199(2):292-299.
[23]Tinkov S,Bekeredjian R,Winter G,et al.Journal of Pharmaceutical Sciences[J],2009,98(6):1935-1961.
[24]Wang X,Gkanatsas Y,Palasubramaniam J,et al.Theranostics[J],2016,6(5):726-738.
[25]Wood A K W,Sehgal C M.Ultrasound in Medicine&Biology[J],2015,41(4):905-928.
[26]Ibsen S,Schutt C E,Esener S.Drug Des Devel Ther[J],2013,7: 375-388.
[27]Geis N A,Katus H A,Bekeredjian R.Current Pharmaceutical Design [J],2012,18(15):2166-2183.
[28]Sirsi S R,Borden M A.Theranostics[J],2012,2(12):1208-1222.
[29]Cai X,Yang F,Gu N.Theranostics[J],2012,2(1):103-112.
[30]Yang F,Gu A,Chen Z,et al.Materials Letters[J],2008,62(1): 121-124.
[31]Yang F,Li Y,Chen Z,et al.Biomaterials[J],2009,30(23): 3882-3890.
[32]Yang F,Chen P,He W,et al.Small[J],2010,6(12):1300-1305.
[33]Yang F,Wang Q,Gu Z,et al.ACS Applied Materials&Interfaces[J],2013,5(18):9217-9223.
[34]Yang F,Li M,Liu Y,et al.Journal of Controlled Release[J],2016,228:87-95.
[35]Veldhuizen R,Nag K,Orgeig S,et al.Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease[J],1998,1408(2):90-108.
[36]Nkadi P O,Merritt T A,Pillers D A M.Molecular Genetics and Metab-olism[J],2009,97(2):95-101.
[37]Van Golde L M G.Neonatology[J],1995,67(Suppl.1):2-17.
[38]Kiessling F,Fokong S,Koczera P,et al.Journal of Nuclear Medicine [J],2012,53(3):345-348.
[39]Ter Haar G.Medical&Biological Engineering&Computing[J],2009,47(8):893-900.
[40]Bohlin K,Bouhafs R K L,Jarstrand C,et al.Pediatric Research[J],2005,57:624-630.
[41]Sirsi S,Pae C,Oh D K T,et al.Soft Matter[J],2009,5(23): 4835-4842.
(本文为本刊约稿,编辑 盖少飞)

特约撰稿人尹海清

特约撰稿人李 凯

特约撰稿人刘兴军
尹海清:女,1971年生,北京科技大学教授、博士生导师。长期从事粉末冶金领域和材料数据的研究工作,近年来在粉末高速压制、粉末微注射成形、材料数据库及数据分析、第一性原理计算与模拟等研究方向取得多项优秀研究成果,主持和参与完成了国家“973”计划项目、国家科技基础条件平台建设项目、“863”计划项目、国家自然科学基金项目、军品配套项目和Kennametal-USTB国际合作科研课题共计近20项。曾获省部级科技成果奖一等奖1项、二等奖2项。发表论文40余篇,SCI收录20余篇,EI收录30余篇。担任«粉末冶金工业»、«中国科学数据»及«科研信息化技术与应用»等杂志的编委,亚洲材料数据委员会(AMDC)委员及中方联络人。
李 凯:男,1986年生,中南大学讲师、硕士生导师,任中南大学高等研究中心材料微结构研究所所长助理。主要研究方向为铝合金中的微结构定量表征及针对微结构-性能相关性的研究,涉及矿石、硬质合金及其涂层的微结构表征工作,所用的研究方法包含TEM、三维原子探针(3DAP)、相图及第一原理计算等。已在Scripta Materialia,Acta Materialia,Materials Char-acterization等国际期刊上发表SCI论文16篇(第一及通讯作者8篇),发表中文核心期刊论文3篇(通讯作者1篇),以通讯作者身份获得第15届国际铝合金大会(ICAA15)最佳海报奖。担任M a teria ls C h aracterization、P h ilo-soph ica l M a gazine L etters等期刊的审稿人。现主持国家自然科学青年基金项目1项及中国博士后基金项目1项。
刘兴军:男,1962年生,教授,博士生导师。现为厦门大学材料学院院长,国家杰出青年科学基金获得者,福建省材料基因重点实验室主任,福建省闽江学者特聘教授。兼任国际合金相图委员会委员、中国材料研究学会常务理事、中国物理学会相图专业委员会委员、福建省金属学会副理事长、厦门-台北科技产业联盟副理事长、海峡(厦门)新材料产业技术联盟理事长,担任«中国材料进展»、«功能材料»及«中国有色金属学报»编委。主要研究领域包括相图与相变、计算材料学、金属材料及功能材料等。已在Science,Phy Rev Lett等学术刊物上发表论文210余篇,论文被引用3000余次,已获授权国家发明专利20余项。曾获得日本金属学会技术发明奖、国际合金相图委员会最优秀论文奖等奖项。
Research Progress on the Lung Surfactant Microbubbles
LIU Dong,YANG Fang,GU Ning
(Jiangsu Key Laboratory for Biomaterials and Devices,School of Biological Sciences and Medical Engineering,Southeast University,Nanjing 210096,China)
Combining with pharmacy,biology,biomedical engineering,materials science and other disciplines,micro-bubbles ultrasound contrast agents have the functions of enhanced ultrasound imaging and drug loading.So far microbubbles are moving towards to achieve the aim of tissue targeted molecular imaging and combined with multimodality imaging and other imaging mode,as well as unite drugs or genes.Pulmonary surfactant(PS)is a kind of lipid protein complex,located on the alveolar gas-liquid interface and mainly consisting of phospholipids and specific proteins.The function of PS is to reduce the surface tension of lung,realize the innate immunity and protect from the invasion of patho-gens.Microbubbles coated and stabilized by PS have been a topic of interest as a novel drug delivery system with ultra-sound imaging and therapeutic functions.In the paper,the application of microbubbles in the fields of medical diagnosis and treatment is elaborated,the research process on PS microbubbles is introduced,and the prospects of application and development to PS microbubbles are also discussed.
microbubbles;pulmonary surfactant;theranostics;ultrasound
R94
A
1674-3962(2017)06-0448-07
2016-08-10
科技部“973”计划项目(2013CB733804);国家自然科学基金国际合作重点项目(61420106012);国家自然科学基金项目(31370019,81473160)
刘 东,男,1984年生,博士研究生
顾 宁,男,1964年生,教授,博士生导师,Email: guning@seu.edu.cn
10.7502/j.issn.1674-3962.2017.06.08

