单核细胞增生李斯特氏菌生物膜形成特性
陈康勇 彭芳 薛竣仁 钟为铭 高志鹏

摘要 [目的]研究单增李斯特氏菌生物膜的形成特性。[方法]采用24孔板法培养生物膜,分别采用结晶紫染色法和光学显微镜进行生物膜的定量和定性研究,观察在不同培养时间(8、16、24、32、40、48 h)单增李斯特氏菌生物膜的形成状况。[结果]随着培养时间的增加,单增李斯特氏菌生物膜生物量逐渐增加,生物膜经历了黏附、微菌落形成、大菌落形成到成熟的全部过程。[结论]试验结果为单增李斯特氏菌生物膜相关研究提供了理论依据。
关键词 单核细胞增生李斯特氏菌;生物膜;形成特性
Biofilm Formation Characteristics of Listeria monocytogenes
CHEN Kang-yong1,PENG Fang1,XUE Jun-ren1,GAO Zhi-peng1,2* et al (1.College of Animal Science and Technology,Hunan Agricultural University,Changsha,Hunan 410128; 2.Collaborative Innovation Center for Efficient and Health Production of Fisheries in Hunan Province,Changde,Hunan 415000)
Abstract [Objective]The aim was to investigate the biofilm formation characteristics of Listeria monocytogenes. [Method]To investigate the characteristics of Listeria monocytogenes biofilm at different incubation times (8,16,24,32,40,48 h),24-well plate method was used to cultivate biofilm,and quantitative and qualitative data were obtained by crystal violet staining assay and light microscopy.[Result]With the increase of culture time,the biomass of Listeria monocytogenes biofilm increased gradually,and the biofilm went through the process of adhesion,microcolony formation,macrocolony formation to mature.[Conclusion]The results provide a theoretical basis for the related research of Listeria monocytogenes biofilm.
Key words Listeria monocytogenes;Biofilm;Formation characteristics
生物膜(BF)是细菌为了适应生存环境,黏附于非生物或者活性组织的表面,包被于自身分泌的胞外基质中,形成的一种三维聚合网状结构,细菌生物膜是一种和浮游生长对应的生长方式[1-3]。生物膜参与65%以上的感染,尤其是与医疗器械相关的、机体表面的(如皮肤、软组织等)和慢性感染,原因主要是生物膜对宿主防御和抗菌药物具有很强的抵御能力[4-6]。生物膜是细菌耐药性产生的重要原因,可使细菌的耐药性提高10~1 000倍[7-8]。生物膜感染已成為全球关注的问题。
单核细胞增生李斯特氏菌(Listeria monocytogenes)是一种能在冷藏的温度下进行繁殖的致病菌,由于该细胞的苯酚-水浸出物能够诱导单核细胞生成,所以被命名为“单核增生细菌”[9]。人或者牲畜感染之后主要表现出败血症、胃肠炎、脑膜炎、孕妇流产等症状[10]。婴幼儿、老年人以及免耐受病人的临床死亡率约为30%[11]。该菌种在自然界广泛存在,对于不利的生长环境条件具有很强的耐受能力,在4 ℃冰箱中可生长繁殖,所以各类冷冻食品均成为被感染对象,如肉制品、奶制品、冰激凌等[12]。在对含有单增李斯特氏菌的乳制品进行超高压处理研究中发现,在500 MPa、10 min、20 ℃下处理乳制品,虽然能够降低其单增李斯特氏菌活菌量,但仍有细菌存活并繁殖[13]。同时,单增李斯特氏菌对水产品也具有较高的污染程度[14-15]。单增李斯特氏菌所产生的生物膜可保护其不受抗菌药物作用,并且能降低机体免疫细胞的吞噬作用。试验表明,在任何温度条件下,单增李斯特氏菌可在固体表面形成生物膜,并且能够在很长时间黏附于固体表面,其生物膜的形成引起了食品、用品卫生安全的隐患[16]。
单增李斯特氏菌生物膜所导致的相关性疾病患病率逐年上升,至今很少有药物能有效控制该类感染,深入研究单增李斯特氏菌生物膜形成特性,对于寻找有效的防治药物和方法具有重要意义。笔者研究了单增李斯特氏菌生物膜的形成过程,以期为单增李斯特氏菌研究提供参考。
1 材料与方法
1.1 材料
1.1.1 供试菌。单核细胞增生李斯特氏菌(编号:ATCC19115),购自广东省微生物研究所。
1.1.2 主要试剂。LB肉汤(广东环凯微生物科技有限公司)、技术琼脂粉(广东环凯微生物科技有限公司)、0.1%结晶紫溶液(Sigma公司)、95%乙醇溶液、磷酸盐缓冲液(PBS)和4%多聚甲醛(Sigma公司)。
1.1.3 主要仪器。
荧光多功能酶标仪、光学显微镜、24孔和96孔细胞培養板、高压灭菌锅和高速彩色平台扫描仪。
1.2 方法
1.2.1 单增李斯特氏菌生物膜培养。
采用24孔板法,具体操作:取单个单增李斯特氏菌菌落接种到5 mL LB液体培养基中,37 ℃静置培养24 h。取10 μL 菌液转接至预先加入无菌盖玻片(12 mm)和2 mL 新鲜LB培养液的24孔细胞培养板中,然后37 ℃静置培养。
1.2.2 不同培养时间对单增李斯特氏菌生物膜形成特性的影响。
按培养时间分别设置8、16、24、32、40、48 h 6个试验组,每组分别做6个平行,按照“1.2.1”进行生物膜培养,在上述时间点进行结晶紫染色试验和显微镜观察。
1.2.3 单增李斯特氏菌生物膜结晶紫染色试验。
利用生物膜内物质可与特殊染料结合的原理,通过染色的方法对生物膜进行定性或定量分析。单增李斯特氏菌生物膜形成后,将24孔板从培养箱中取出,吸出培养液,用无菌PBS浸洗盖玻片3次,然后用4%多聚甲醛固定20 min,弃固定液,并用无菌PBS浸洗3次,洗去浮游菌,使黏附在盖玻片的生物膜自然风干,室温下用0.1%结晶紫染色20 min,吸除染色液后,用无菌PBS浸洗3次,自然风干,然后用高速彩色平台扫描仪扫描拍照。
1.2.4 单增李斯特氏菌生物膜生物量的测定。
单增李斯特氏菌生物膜形成后,吸出培养液,用无菌PBS浸洗盖玻片3次,每孔加入200 μL 95%乙醇,置于摇床30 min使结晶紫完全溶解,溶解液转移至96孔细胞培养板中,并用酶标仪测定540 nm波长处的吸光度,即OD540,每个试验重复3次。
1.2.5 显微镜观察单增李斯特氏菌生物膜。
方法同“1.2.3”,结晶紫染色后,用无菌PBS浸洗盖玻片3次,然后置于100倍油镜下观察生物膜的形成状况,并拍照记录。
2 结果与分析
2.1 不同培养时间下单增李斯特氏菌生物膜结晶紫染色结果
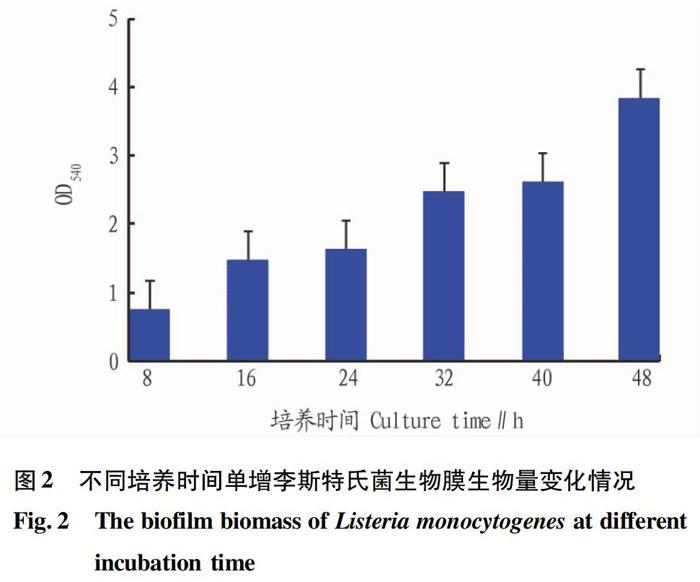
研究发现单增李斯特氏菌生物膜的形成分为4个阶段,即黏附阶段、微菌落形成阶段、大菌落形成阶段和成熟阶段。①黏附阶段(0~16 h):细菌逐渐聚集并黏附于介质(盖玻片)表面,生物膜形成速度较慢;②微菌落形成阶段(17~24 h):生物膜结晶紫染色较浅,微菌落开始形成,并呈斑块状分布;③大菌落形成阶段(25~32 h):细菌聚集明显,生物膜斑块变大,32 h时布满盖玻片,结晶紫染色加深;④成熟阶段(33~48 h):结晶紫染色比前32 h明显加深,生物膜斑块更加密集,厚度增大,40 h时生物膜基本形成,33~48 h形成的生物膜的OD540快速增长。随着培养时间的增加,单增李斯特氏菌的生物膜呈现出从黏附聚集到成熟的过程,于48 h达到最成熟的状态(图1、2)。
2.2 不同培养时间下单增李斯特氏菌生物膜显微观察结果
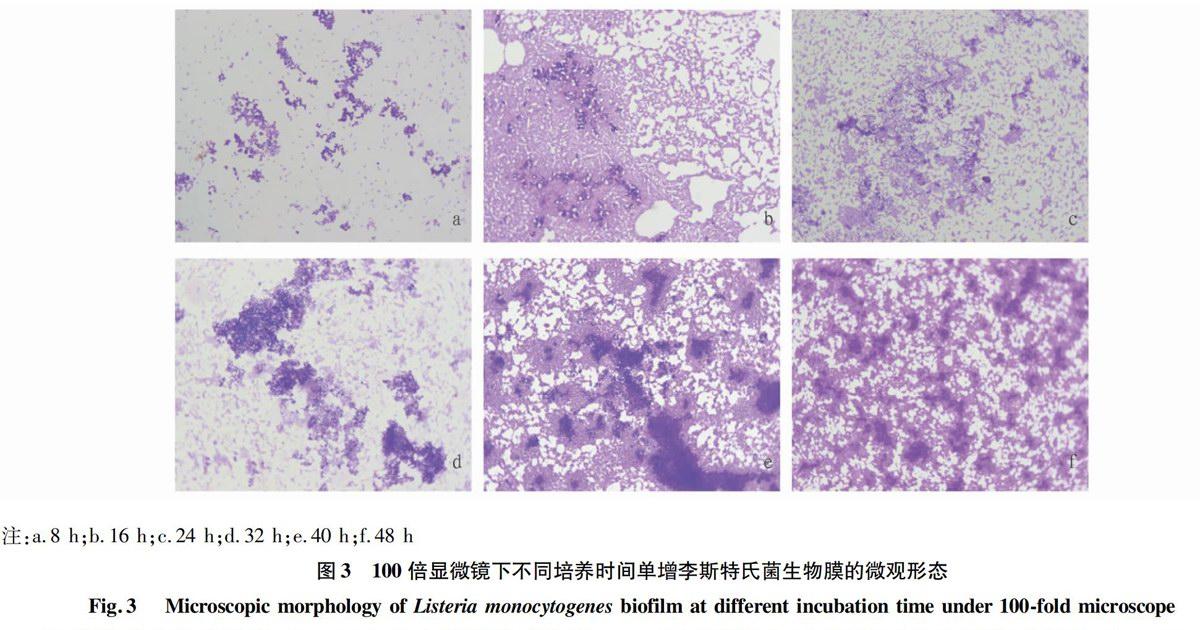
①黏附阶段:在物镜为100倍的显微镜下可观察到生物膜的厚度小,菌落间的通道多,说明生物膜形成并不成熟。②微菌落形成阶段:微菌落开始形成,生物膜斑块数量增多,生物膜的厚度开始增加,菌落间通道变少。③大菌落形成阶段:结晶紫染色变深,开始形成较为致密的生物膜,但生物膜斑块比较分散,菌落间通道继续变少。④成熟阶段:生物膜斑块大量增加并且形成了牢固、稳定的网状三维结构,生物膜厚度明显增加,染色显著加深,培养至48 h时生物膜极厚,菌落之间几乎没有通道,生物膜完全成熟(图3)。可见,生物膜形成期间,菌落间的通道不断减少,生物膜斑块逐渐增加并且密集,生物膜的厚度逐渐增加,并趋于成熟。
3 讨论
细菌生物膜的形成是一个动态过程,随着细菌的生长,生物膜对营养因子的通透性变差,同时细菌也开始老化甚至失去了成膜能力。进入成熟期后,随着生存环境中营养等限制因子的消耗以及代谢产物的积累,细菌的生长开始受到限制,生物膜的形成达到一个相对稳定的状态,此时生物膜的厚度基本稳定。进入衰老期后,伴随着营养物质的不断消耗,生物膜中细菌的大部分蛋白质和RNA的合成速率降低,致使胞外多糖的合成量减少,生物膜的结构出现崩解甚至细菌也开始从生物膜表面脱落,再次成为游离菌,使生物膜的厚度减少。
单增李斯特氏菌生物膜的形成是一个复杂的过程,涉及到多种蛋白、核酸分子和多糖等因素,同时也受到各种调控网络的共同作用。深入研究单增李斯特氏菌生物膜的形成和调控的分子机制对寻找特异性干预靶点具有重要意义。该试验目前只是研究培养时间对单增李斯特氏菌生物膜形成的影响,主要是通过观察细菌生物膜的形成情况来说明培养时间对生物膜的影响,后续试验还可研究环境因素对单增李斯特氏菌生物膜基质组成的影响,通过观察环境因素对生物膜中蛋白质、胞外多糖、胞外DNA组成的影响,进一步探究单增李斯特氏菌生物膜的形成机制。
4 结论
采用24孔板法和结晶紫染色法研究单增李斯特氏菌生物膜的形成过程,发现在静置培养条件下的单增李斯特氏菌生物膜的形成经历了4个阶段,0~16 h为细菌黏附阶段,17~24 h为微菌落形成阶段,25~32 h为大菌落形成阶段,33~48 h为成熟阶段。细菌黏附阶段,菌落间的通道多,形成生物膜速度慢。微菌落形成阶段,随着培养时间的延长,生物膜结晶紫染色颜色变深,细菌开始形成微菌落,但形成速度较慢,并开始形成生物膜斑块。大菌落形成阶段,细菌形成的大量微菌落聚集成大菌落,生物膜斑块增大,开始形成较为致密的生物膜,结晶紫染色快速变深。成熟阶段,生物膜斑块快速增大并且密集,形成了具有牢固、稳定的网状三维结构的生物膜,菌落间的通道不断减少。培养48 h期间,单增李斯特氏菌生物膜的生物量随培养时间的增加而增大,表明细菌生物膜的生长经历了从黏附聚集到成熟的过程,在48 h生物膜生长达到完全成熟的状态。
参考文献
[1] HALL-STOODLEY L,STOODLEY P.Biofilm formation and dispersal and the transmission of human pathogens[J].Trends in microbiology,2005,13(1):7-10.
[2] 袁海蘭,苏建,胡鲲,等.环境因子对水霉菌生物膜形成的影响[J].微生物学通报,2014,41(9):1829-1836.
[3] 徐文生,张艳艳,黄漫青,等.环境因素对长双歧杆菌CICC6069生物膜生成的影响[J].中国食品学报,2012,12(4):36-42.
[4] COSTERTON J W,STEWART P S,GREENBERG E P.Bacterial biofilms:A common cause of persistent infections[J].Science,1999,284(5418):1318-1322.
[5] O′TOOLE G,KAPLAN H B,KOLTER R.Biofilm formation as microbial development[J].Annual review of microbiology,2000,54(1):49-79.
[6] KOLTER R.Biofilms in lab and nature:A molecular geneticist′s voyage to microbial ecology[J].International microbiology,2010,13(1):1-7.
[7] 祝司霞.细菌生物膜的结构及形成机制的研究进展[J].沈阳医学院学报,2015,17(2):115-117.
[8] EHRLICH G D,AHMED A,EARL J,et al.The distributed genome hypothesis as a rubric for understanding evolution in situ during chronic bacterial biofilm infectious processes[J].FEMS immunology and medical microbiology,2010,59(3):269-279.
[9] 马里奥特.食品卫生原理 [M].4版.北京:中国轻工业出版社,2001.
[10] 吕素玲,谭冬梅,李秀桂.广西食源性单核细胞增生李斯特菌耐药趋势分析[J].实用预防医学,2013,20(6):734-735.
[11] MARIJA Z,KONRAD J D,WOLFGANG K.Practical relevance of methodologies for detecting and tracing of Listeria monocytogenes in ready-to-eat foods and manufacture environments:A review[J].LWT-Food science and technology,2011,44(2):351-362.
[12] LEMON K P,FREITAG N,KOLTER R.The virulence regulator PrfA promotes biofilm formation by Listeria monocytogenes[J].Journal of bacteriology,2010,192(15):3969-3976.
[13] STEPANOVIC′ S,VUKOVIC′ D,DAKIC′ I,et al.A modified microtiter-plate test for quantification of staphylococcal biofilm formation[J].Journal of microbiological methods,2000,40(2):175-179.
[14] 张海英,罗茂凰,高旗利,等.食品中单核细胞增生李斯特氏菌的污染概况及防制[J].食品研究与开发,2003,24(6):154-156.
[15] 郑俏慧.冻水产品中单核细胞增生李斯特氏菌的检验研究[J].食品工程,2010 (1):58-60.
[16] 刘彤,陈晶瑜,韩北忠,等.单核增生李斯特氏菌生物被膜的形成及控制[J].食品研究与开发,2010,31(2):163-166.

