微纳电极阵列检测丘脑底核电刺激引起的纹状体神经元活动变化
杨丽丽++宋轶琳++徐声伟++张禹++肖桂花++张松
摘要丘脑底核(STN)深部脑刺激(DBS)已成为帕金森病的重要外科治疗手段,然而其确切的作用机理尚不明确。本研究采用微机电系统(MEMS)技术制备了一种16通道植入式微电极阵列(MEA),在MEA表面修饰了铂黑还原氧化石墨烯Nafion膜(Pt/RGO/Nafion)纳米材料,用于同步检测麻醉大鼠脑内纹状体神经元在STN电刺激前后多巴胺(DA)含量和动作电位(Spike)发放变化。STNDBS结果表明,电刺激20 s后,DA含量开始升高,最高达1.72 μmol/L,较高浓度状态保持约50 s后回落至正常水平。与此同时, 检测到在DA上升阶段中间神经元Spike发放活动增强,在保持高于DA正常浓度水平阶段,中等多棘神经元(MSNs)放电频率增加。本研究制备的微电极阵列传感器能够实现脑内多巴胺和电生理的原位实时检测,有望成为神经信息检测的有力工具。
关键词微机电系统; 微纳电极阵列; 丘脑底核电刺激; 多巴胺; 动作电位
1引 言
帕金森病(Parkinson′s disease, PD)是人类最常见的神经退行性运动障碍性疾病之一,其特征是中脑黑质多巴胺能神经元变性丢失,纹状体内多巴胺浓度降低\[1\]。丘脑底核(Subthalamic nucleus, STN)深部脑刺激(Deep brain stimulation, DBS)对PD病人的僵直、运动迟缓、震颤和左旋多巴引起的异动症具有良好的改善效果,已成为帕金森病的重要外科治疗手段。尽管STNDBS已广泛应用,其确切的作用机理尚不明确\[2\]。临床研究表明,给予STN高频电刺激后,PD患者的多巴胺(Dopamine, DA)药物用量可以减少一半以上\[3\],提示其可能影响DA的活性。纹状体是基底节的输出核团,也是多巴胺的主要释放区域,研究STNDBS对纹状体神经元电生理活动和多巴胺含量的影响,对了解STNDBS作用机理有重要意义。
目前,在体神经元电生理活动记录方法主要为微丝电极阵列\[4~7\],实时微创多巴胺含量检测的方法主要是微透析法定量多巴胺及代谢产物\[8,9\]和碳纤维电极快速循环伏安法检测\[10,11\]。然而神经元内在信息传递依靠电信号和化学信号两种模式,关系密切,实时同步检测这两种信号变化有利于全面了解神经元的状态。
为了实现脑内STNDBS下的神经元活动双模检测,本研究制备了一种基于微机电系统(Microelectromechanical systems, MEMS)技术的16通道植入式微电极阵列(Microelectrode array, MEA),在其位点表面修饰铂纳米颗粒还原氧化石墨烯Nafion膜(Pt/RGO/Nafion)材料,使其适用于电生理和多巴胺电化学信号同步检测。将此MEA植入麻醉大鼠脑内纹状体,实时检测了丘脑底核电刺激前后的动作电位(Spike)随多巴胺含量的同步变化。
2实验部分
2.1 仪器与试剂
USBME16FAISystem16通道滤波放大器(德国MultiChannel Systems公司); 双极型同心圆电刺激电极(美国Microprobes公司); STG4002电刺激发生器(德国MultiChannel Systems公司); Reference 600电化学工作站 (美国Gamry Instruments公司); KH2200E超声振荡器(中国合创公司); BX51TRF光学显微镜(日本Olympus公司); S4800扫描电镜(日本Hitachi公司); 51650立体定位仪(美国Stoelting公司); 50121C液压探针驱动器(美国FHC公司); MWD20实验室超纯水器(中国美诚公司); BSA124S电子天平(德国赛多利斯公司)。
氯铂酸(H2PtCl6)、醋酸铅(Pb(CH3COO)2),分析纯,国药集团化学试剂有限公司;氧化石墨烯溶液(GO,2 mg/mL,南京先锋纳米科技公司);Nafion阳离子交换膜(美国SigmaAldrich公司);磷酸缓冲盐片剂 (PBS,0.01 mol/L,Na2HPO4NaH2PO4KCl,pH 7.4,美国Sigma公司);多巴胺(DA,美国Acros Organics公司);抗坏血酸(AA)、尿酸(UA)、五羟色胺(5HT),美国Alfa Aesar公司);生理盐水(0.9%,石家庄四药公司);乌拉坦(Urethane,≥98%,上海国药集团)。
实验用水为超纯水(阻抗>18MΩ·cm),電极修饰材料用纯水配制,体外标定溶液用生理盐水配制。
2.2植入式微电极阵列制备、修饰
实验记录电极采用自制的基于MEMS工艺的硅基微电极阵列(MEA)探针,如图1所示,MEA探针通过标准光刻及薄膜工艺在SOI硅片上批量制备,具体参数同文献\[12\]。制备好的MEA通过铝丝键合的方法和后端电路接口连接,并绝缘封装,封装后的电极见图1E。微电极阵列探针的版图(图1A)包括三层: 铂导电层、暴露电极位点及压焊窗口点的Si3N4SiO2双绝缘层及探针外形层。MEA厚30 μm,前端可植入部分长6 mm,为双针型,每根针上有7个圆形电生理信号记录位点(直径20 μm)和1个长方形多巴胺电化学信号检测位点(40 μm×20 μm)。每4个位点呈十字端点排列,相邻位点间圆心至圆心距离为40 μm,两个十字间距4 mm,见图1B。铂(Platinum, Pt)是一种贵金属,常用于制备纳米材料。石墨烯(Graphene, Gr)具有极大的表比面积和优越的导电性能,其衍生物氧化石墨烯和还原氧化石墨烯常用于构建电化学传感器\[13,14\]。本研究对制备好的电极进行Pt/RGO/Nafion修饰,以减低电极阻抗和增大对DA检测的灵敏度及选择性。具体修饰方法为: 2.5 mL 19.2 mmol/L 氯铂酸, 2.5 mL 1.68 mmol/L 醋酸铅和5 mL 2 mg/mL GO溶液,超声2 h构成电镀液。构建三电极体系,对电极为铂丝电极,参比电极为Ag|AgCl电极,工作电极为封装后的16位点微电极阵列,使用电化学工作站,在1 V的工作电压下,采用计时电流法沉积50 s。电镀结束大量去离子水冲洗后在PBS缓冲液(pH 7.4)中0.1~
Symbolm@@ 1.6 V范围内以50 mV/s循环伏安法扫描10圈至电流与前一圈相比不再变化。冲洗后,在MEA表面滴涂 5 μL 0.5% Nafion 乙醇溶液,100℃烘烤30 min。电极位点修饰Pt/RGO/Nafion后光学显微镜下形貌如图1C所示,图1D为位点局部扫描电镜图片。
2.3植入式微电极阵列体外测试
在体实验前须进行MEA体外多巴胺检测和电生理检测性能测试。所有测试均在屏蔽箱中进行。针对电化学检测,采用两电极体系,工作电极为MEA电化学检测位点,参比和对电极为Ag|AgCl电极。首先在50 μmol/L多巴胺PBS溶液中进行CV扫描确定氧化峰电位,选定氧化峰电位为计时电流法测量的恒定电压。测试基底溶液为50 mL PBS溶液,取50 μL 1000倍于标示浓度的溶液加入到测试体系中,通过磁石转子搅拌达到均匀状态,形成标准溶液。首先测试了MEA电化学检测位点在先后加入400 μmol/L尿酸、400 μmol/L抗坏血酸和20 μmol/L五羟色胺干扰物的响应情况,测试完成后去离子水冲洗电极。测试电极位点在多巴胺溶液中的响应曲线,测试方法为电极在测量体系溶液中达到稳定状态后,每隔100 s滴加由低至高浓度的DA标准溶液,形成0.01~110 μmol/L浓度范围的测试用多巴胺溶液。针对电生理检测,电极位点进行150 mV正弦微弱信号下阻抗扫描测试,重点关注1 kHz处阻抗值,测试结果表明,修饰后电生理电极位点阻抗平均为29 kΩ。
2.4在体实验
实验选取健康SpragueDawley雄性大鼠一只,体重260 g,20%乌拉坦溶液腹腔注射麻醉(0.7~0.8 mL/100 g),固定在脑立体定位仪上,去除头皮,暴露前囟点,电极定位大鼠纹状体脑区(AP: +1.44 mm, ML:
Symbolm@@ 2.5 mm,DV:
Symbolm@@ 4.4 mm),刺激电极定位丘脑底核(AP:
Symbolm@@ 3.60 mm, ML: +2.5 mm,DV:
Symbolm@@ 8.1 mm)使用颅骨钻在颅骨上开1 mm ×1 mm的电极植入窗口,直径0.1 mm的刺激电极植入圆孔,植入电极前用镊子挑开硬脑膜。此外,开出颅骨钉和参比电极(AP: +2.5 mm, ML: 0 mm)固定圆孔。定位结束后,首先植入刺激电极,将刺激电极垂直固定在微推进器上,调整电极垂直高度使其尖端接触软脑膜表面,通过液压推进器缓慢匀速推进至目标深度,以牙科水泥固定。采用相同的方法植入MEA。
电化学信号测量方法: 采用两电极体系,MEA电化学记录位点为工作电极。采用计时电流法检测脑内多巴胺,施加恒电位+0.15 V,采样频率为2 Hz(采样间隔为0.5 s)。MEA以1 μm/s的速度匀速下降至目标区域,停留50 s后开始测定多巴胺氧化电流。
电生理信号测量方法为: MEA的14个电生理通道连接MultiChannel电生理记录仪,25 kHz采样频率实时连续记录电生理信号。实验体系均位于屏蔽箱中以最大程度降低外界噪声干扰。实验中电刺激电极参数设置为60 Hz,双向方波,每相2 ms,幅值300 μA,共120个脉冲,持续时间2 s。所有实验方法均符合动物实验操作相关规定。
2.5电生理信号数据处理方法
将Mutichannel记录到的原始信号用NeuroExplorer软件250~5000 Hz带通滤波, 采用阈值触发采样技术得到Spike信号,只有信噪比大于3∶1的Spike会被分析和处理。将记录到的Spike通过Offline Sorter中的Kmeans聚类分析,可分离出同一测量点上检测到的多个细胞单元信号,得到单神经元的放电波形及时间序列[15]。
3结果与讨论
3.1MEA的电化学性能
电极在50 μmol/L DA溶液中CV扫描,确定了DA在电极表面氧化峰电位为150 mV。在细胞外液中,尿酸(UA)和抗坏血酸(AA)含量可达多巴胺的100~1000倍\[16\], 五羟色胺(5HT)和DA同属单胺类神经递质,它们在裸电极上均会极大干扰DA检测,为此测试电极在150 mV恒定电位下计时电流法对UA、AA和5HT的响应电流,其结果能在很大程度上代表电极对多巴胺的选择性,如图2所示。微电极对400 μmol/L UA几乎无响应,对400 μmol/L AA响应電流为4 pA,对20 μmol/L 5HT响应电流为8 pA。PtRGONafion修饰微电极对UA、AA和5HT的响应度均很低。
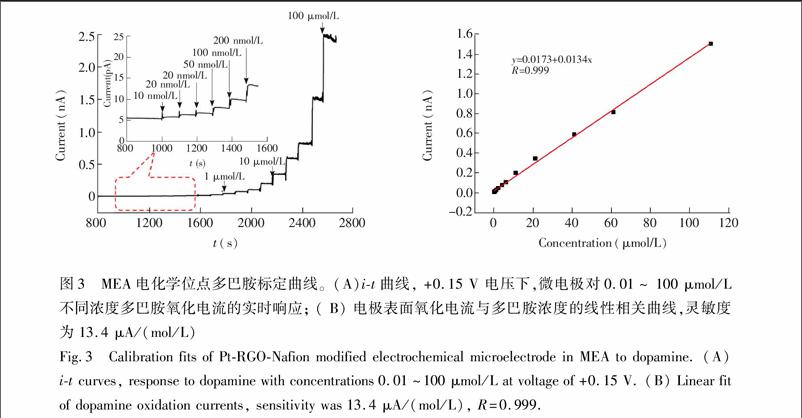
在150 mV恒定电位下计时电流法对不同浓度的DA溶液中响应电流见图3A,在0.01~110 μmol/L范围内,随着多巴胺浓度的增加,PtRGONafion膜修饰微电极的响应电流随之台阶式上升。图3B为电极表面氧化电流与多巴胺浓度的线性拟合关系,灵敏度为13.4 μA/(mol/L),线性相关系数R=0.999。实验表明,20 μmol/L DA造成了响应电流上升256 pA,为20 μmol/L 5HT造成响应电流的32倍。
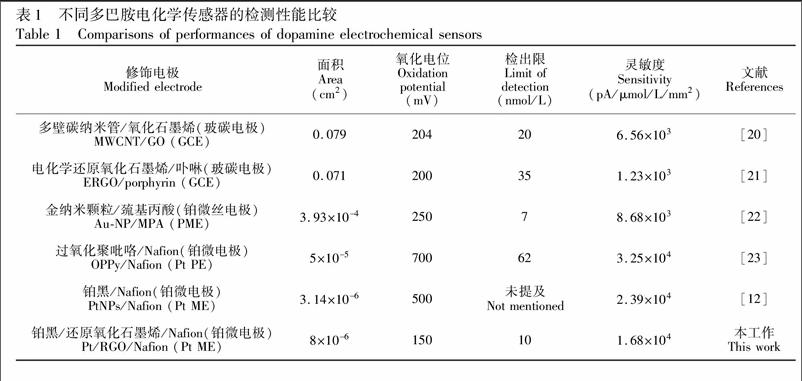
本研究的微传感器与其他电化学传感器对多巴胺检测的对比情况见表1。与传统多巴胺电化学传感器(如玻碳电极和微丝电极)相比,铂微电极多巴胺检测灵敏度显著提高。本研究采用Pt/RGO/Nafion修饰,相比于其它微电极修饰方法,在保持同一数量级的检测灵敏度外,DA氧化电位明显降低,检出限低。更低的氧化电位能够提高电极的抗干扰性。氧化电位和检测限降低的原因推测是由于铂纳米颗粒电沉积过程中与氧化石墨烯的复合能够极大地增加电极的有效表面积,并且调控复合后铂黑颗粒的粒径,从而表现出更好的催化活性。氧化石墨烯通过电化学还原的方式形成还原氧化石墨烯后,能够很大程度改善石墨烯含氧集团引入带来的缺陷\[14\],提高电子转移效率,并进一步减低微电极阻抗。Nafion阳离子交换膜能够排斥细胞外液中以阴离子形式存在的AA和UA分子,而能够为以阳离子形式存在的多巴胺分子提供传输通道\[18,19\]。在微电极Pt/RGO修饰后引入Nafion能够进一步减低AA和UA干扰,尤其是减低氧化电位更低的AA干扰。
Pt/RGO/Nafion修饰微电极对多巴胺的电化学检测实验结果表明,采用150 mV DA氧化电位下计时电流法测量,修饰电极对典型干扰物UA、AA和5HT有极强的抗干扰性,且对DA检出限低,灵敏度较好。MEA电化学检测位点能够很好地检测多巴胺浓度变化。
3.2大鼠丘脑底核电刺激下动作电位与多巴胺浓度同步变化
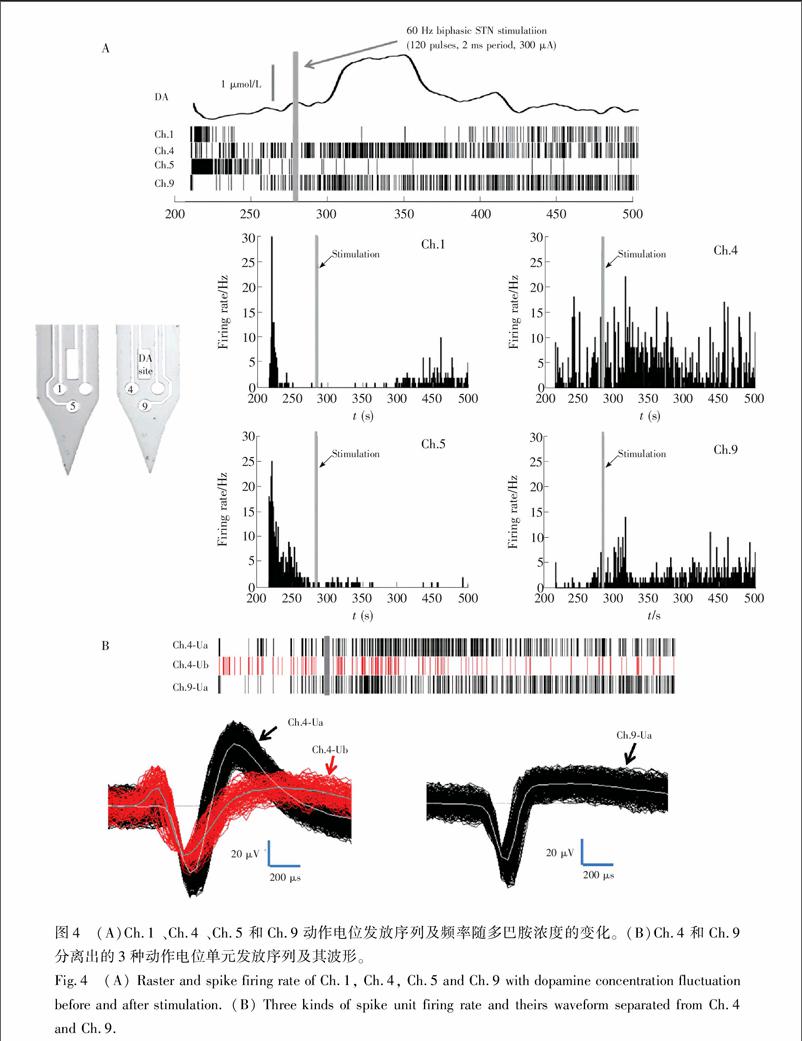
当电极尖端植入至纹状体记录到稳定的电化学和电生理信号后,标为0时刻,282 s时对大鼠STN施加电刺激,持续时间为2 s。刺激前70 s,刺激后220 s,DA氧化电流和周围4个通道Spike发放栅格图同步变化以及各通道spike发放频率情况如图4A所示。
刺激结束后的20 s内,DA氧化电流在由781 pA最高升至804 pA(350 s)时,随后电流值缓慢回落,至425 s时,基本达到初始水平。电刺激后多巴胺浓度有明显增加,最高达到1.72 μmol/L。
MEA位于纹状体与细胞接触良好的4个电生理位点Ch.1、Ch.4、Ch.5和Ch.9实时记录了神经电信号随DA浓度升高的同步变化。从微电极位点的动作电位栅格图(图4A)可见,不同通道动作电位发放情况并不相同,栅格图下为各通道Spike发放频率随时间变化图。随电刺激后多巴胺浓度的变化,Ch.1和Ch.5未出现明显的动作电位发放,而Ch.4在多巴胺浓度高于正常水平时出现明显的spike发放频率增加,Ch.9在多巴胺浓度上升时spike发放频率明显增加。
针对Ch.4和Ch.9通道检测到的Spike进行聚类分析,如图4B所示,分离出各自单元(Unit)动作电位发放序列栅格图及其波形。Ch.4检测到了两种单元动作电位类型,Ch.4Ua和Ch.4Ub。Ch.9检测到了一种单元动作电位类型Ch.9Ua。Ch.4Ua具有和去极化电位相当的超极化电位,而Ch.4Ub和Ch.9Ua超极化幅值小,时程长。通过多巴胺浓度与动作电位栅格图同步变化可以看出,Ch.4Ua在刺激后多巴胺浓度高于正常水平时,放电密集,而Ch.4Ub和Ch.9Ua在多巴胺浓度开始上升时放电密集。
啮齿类动物纹状体中,有超过95%神经元为中等多棘神经元 (Medium spiny neurons, MSNs),剩下的3%~5%纹状体神经元包括胆碱能中间神经元和几种γ氨基丁酸(GABA)释放中间神经元\[16\]。这些中间神经元数量上很少,但它们会产生不与其数量成比例的重要影响\[24\],能够调控多棘神经元的兴奋性。纹状体信息的整合依靠MSNs。根据参考文献\[25\]报道的波形特征,可以判断出Ch.4Ua为中等多棘神经元,Ch.4Ub和Ch.9Ua为中间神经元。丘脑底核电刺激后,在细胞外多巴胺浓度开始上升时,中间神经元放电频繁,持续约20 s。而MSNs在电刺激引起多巴胺浓度开始上升到回落至正常水平的过程中,放电活动持续频繁。
4结 论
本研究制备了一种基于MEMS工艺的植入式微纳电极阵列探针,用于细胞外DA含量和动作电位的原位双模同步检测。电极表面Pt/RGO/Nafion修饰有利于提高DA及电生理检测的信噪比和选择性。MEA电化学位点对代表性干扰物尿酸、抗坏血酸和五羟色胺具有良好的抗干扰性。多巴胺体外标定结果表明,在多巴胺浓度为 0.01~110 μmol/L范围内,灵敏度为13.4 μA/mol/L,线性相关系数为0.999。此探针植入大鼠纹状体后,成功记录到了丘脑底核电刺激下多巴胺释放和电生理信号同步变化。实验结果为揭示丘脑底核电刺激的作用机制提供了实验数据,所制备MEA在神经科学研究领域具有广阔的应用前景。
References
1ZHANG MeiRong, SUN FangLing, AI HouXi, ZHANG Li, JIANG Ying, WEI ShouRong, WANG Wen. Chin J Rehabil Theory Pract, 2012, 18(11): 1040-1043
张美蓉, 孙芳玲, 艾厚喜, 张 丽, 蒋 莹, 魏守蓉, 王 文. 中国康复理论与实践, 2012, 18(11): 1040-1043
2Albaugh D L, Shih Y Y. Brain Connectivity, 2014, 4(1): 1-14
3Benabid A L, Benazzouz A, Hoffmann D, Limousin P, Krack P, Pollak P. Movement Disord., 1998, 13(S3): 119-125
4Shi L H, Luo F, Woodward D J, Chang J Y. Synapse, 2006, 59(7): 445-457
5XU ShengWei, WANG Li, SONG XianTeng, ZHANG Song, WANG MiXia, YU Ping, MAO LanQun, CAI XinXia. Chinese J. Anal. Chem., 2016, 44(9): 1458-1464
徐声伟, 王 力, 宋先腾, 张 松, 王蜜霞, 于 萍, 毛蘭群, 蔡新霞. 分析化学, 2016, 44(9): 1458-1464
6Li X H, Wang J Y, Gao G, Chang J Y. Woodward D J, Luo F. J. Neurosci. Res., 2010, 88(7): 1510-1521
7WEI WenJing, SONG YILin, FAN XinYi, ZHANG Song, WANG Li, XU ShengWei,CAI XinXia. Chinese J. Anal. Chem., 2015, 43(7): 983-988
蔚文婧, 宋轶琳, 范心怡, 张 松, 王 力, 徐声伟, 蔡新霞. 分析化学, 2015, 43(7): 983-988
8Walker R H, Koch R J, Moore C, Meshul C K. Synapse, 2009, 63(2): 136-146
9Strafella A P, Sadikot A F, Dagher A. Neuroreport, 2003, 14(9): 1287-1289
10Shon Y M, Lee K H, Goerss S J, Kim I Y, Kimble C,Van Gompel J J, Bennet K, Blaha C D, Chang S Y. Neurosci. Lett., 2010, 475(3): 136-140
11He Z, Jiang Y X, Xu H M, Jiang H, Jia W T, Sun P, Xie J X. Behav. Brain Res., 2014, 263: 108-114
12Zhang S, Song Y L, Wang M X, Zhang Z M, Fan X Y, Song X T, Zhuang P, Yue F, Chan P, Cai X X. Biosens. Bioelectron., 2016, 85: 53-61
13JIANG LiYing, ZHOU PengLei, XIAO XiaoNan, ZHANG Pei, LIU Shuai, YAN YanXia, CHEN QingHua, JIANG SuXia. Chinese Journal of Luminescence, 2016, 37(7): 881-886
姜利英, 周鹏磊, 肖小楠, 张 培, 刘 帅, 闫艳霞, 陈青华, 姜素霞. 发光学报, 2016, 37(7): 881-886
14RAO HongHong, XUE ZhongHua, WANG XueMei, ZHAO GuoHu, HOU HuiHui, WANG Hui. Progress in Chemistry, 2016, 28(2): 337-352
饶红红, 薛中华, 王雪梅, 赵国虎, 侯辉辉, 王 晖. 化学进展, 2016, 28(2): 337-352
15XU JiaMin, WANG CeQun, LIN LongNian. Acta Physica Sinica, 2014, 66(3): 349-357
徐佳敏, 王策群, 林龙年. 生理学报, 2014, 66(3): 349-357
16Kawaguchi Y, Wilson C J, Augood S J, Emson P C. Trends Neurosci., 1995, 18(12): 527-535
17Johnson M D, Franklin R K, Gibson M D, Brown R B, Kipke D R. J. Neurosci. Methods, 2008, 174(1): 62-70
18Wang H S, Li T H, Jia W L, Xu H Y. Biosens. Bioelectron., 2006, 22(5): 664-669
19LI Juan, JIA LiPing, YAO Fei, HUO RuiWei, HOU GuanWei, JIA WenLi, WANG HuaiSheng. Journal of Nanjing Normal University (Natural Science Edition)., 2013, 36(2): 67-73
李 娟, 賈丽萍, 姚 飞, 霍瑞伟, 侯关伟, 贾文丽, 王怀生. 南京师大学报自然科学版, 2013, 36(2): 67-73
20CheemalapatiS, Palanisamy S, Mani V, Chen S M. Talanta, 2013, 117(22): 297-304
21Han H S, Lee H K, You J M,Jeong H, Jeon S. Sens. Actuators B, 2014, 190(1): 886-895
22Tsai T C, Guo C X, Han H Z,Li Y T, Huang Y Z, Li C M, Chen J J J. Analyst, 2012, 137(12): 2813-2820
23Tseng T C, Monbouquette H G. J. Electroanal. Chem., 2012, 682(9): 141-146
24Tepper J M, Koos T, Wilson C J. Trends Neurosci., 2004, 27(12): 662-669
25Kulik J, Pawlak A, Kalkat M, Coffey K, West M O. Brain Res., 2017, 1657: 101-108

