反刍动物瘤胃上皮的生长发育及其调节
卢劲晔顾蓓蓓冯 晴赵怀宝张 磊许 君沈赞明
(1.南京农业大学动物医学院,江苏南京210095;2.江苏农牧科技职业学院,江苏泰州225300;3.泰州出入境检验检疫局,江苏泰州225300;4.连云港东海县卫生监督所,江苏连云港222300)
反刍动物瘤胃上皮的生长发育及其调节
卢劲晔1,2顾蓓蓓1,3冯 晴4赵怀宝1张 磊1许 君1沈赞明1
(1.南京农业大学动物医学院,江苏南京210095;2.江苏农牧科技职业学院,江苏泰州225300;3.泰州出入境检验检疫局,江苏泰州225300;4.连云港东海县卫生监督所,江苏连云港222300)
瘤胃是反当动物消化代谢和营养吸收最重要的场所之一。瘤胃内分解产生的小分子营养物质大部分通过瘤胃上皮直接吸收,因而瘤胃上皮的生长发育和功能完善直接影响到反当动物的生产性能。伴随着反当动物机体的发育,从胎儿期到出生期直至成年,瘤胃上皮的形态结构及生理功能都在持续不断的发展和完善。其生长发育受到日粮营养水平(如日粮营养水平、饲料的精粗料比例、物理性质、代谢产物和饲喂制度等)、瘤胃内代谢产物(如短链脂肪酸、葡萄糖、多胺等)、神经内分泌(如胰岛素、胰岛素样生长因子-1、表皮生长因子、转化生长因子-α、胰高血糖素、生长激素、生长抑素等)等多重因素的影响。笔者主要对瘤胃上皮的生长发育过程及其调节因素进行了综述。
瘤胃上皮;生长发育;调节
反刍动物的胃是复胃,由四个胃室组成,分别是瘤胃(rumen)、网胃(reticulum)、瓣胃(omasum)和皱胃(abomasum)[1-4]。反刍动物四个胃约占整个腹腔容积的75%,其中瘤胃最大,约占四个胃室总容积的80%。
瘤胃是反刍动物消化代谢和营养吸收最重要的场所之一。瘤胃内微生物将食物发酵产生短链脂肪酸(short-chain fatty acid,SCFA),其中85%的SCFA直接被瘤胃上皮吸收,为宿主提供60~80%的所需代谢能[1];瘤胃上皮还吸收发酵产生的35~65%的氨NH3)以及进入瘤胃的多种无机离子、少量水分、葡萄糖、小肽和氨基酸等营养物质,瘤胃上皮的生长发育和功能完善直接影响到反刍动物的生产性能。
1 瘤胃上皮的生长发育
反刍动物从胎儿期到出生期直至成年,瘤胃上皮在形态结构都得到了不断的发展和完善。反刍动物胎儿期复胃由舒张的长纺锤形原肠分化发育而来。以绵羊胚胎为例[12]:
怀孕23~29d时(胚胎长度0.14~1.9 cm)瘤胃开始形成,此时的瘤胃壁非常薄(厚度为229µm),整个瘤胃只有一个腔,呈纺锤形。瘤胃壁由无分泌功能的假复层上皮细胞构成的瘤胃上皮层(厚度为54.1µm)和原生质多功能造血干细胞构成的基层组成。
30~32d(胚胎长度2~2.5 cm),瘤胃仍只有一个腔,但容积增大,并且瘤胃壁开始分化为三层:从瘤胃内往外,最内部的一层为复层上皮,中间是未分化的多功能造血干细胞层,最后一层是由单层扁平细胞和间质构成的浆膜层。
33~38d(胚胎长度2.6~3.6 cm),第33 d,瘤胃壁开始分化,瘤胃上皮着色加深,细胞数量性增生,厚度增加到98.1µm。基层的原生质多功能造血干细胞血管化。粘膜层和浆膜层之前出现肌层。
39~52d(胚胎长度4~8 cm),第42 d时瘤胃肌柱开始形成,呈乳头状外突,瘤胃上皮向腔内方向快速拉扯生长,上皮细胞开始分化,内层细胞染色较深,外层细胞胞质成分较内层细胞增多,细胞核变小。瘤胃上皮层嵌入性生长,形成瘤胃外围轮廓,在乳头形成中扮演了主要角色。基层出现了为数众多的血管。第46d时,初次检测到瘤胃上皮细胞分泌中性粘多糖。
53~79d(胚胎长度8.9~19 cm),至53d(8.5 cm)瘤胃壁已明显地分化为上皮层、固有层、粘膜下层、肌层和浆膜层(如图1-2)。此时瘤胃上皮较为平坦,细胞以肥大型增生为主,厚度增长至121.3µm,上皮清晰的分为基底层和外层两层,最外层与瘤胃腔接触的角质层细胞无细胞核。第57d,基层发育成粘膜固有层和粘膜下层,固有层为富含星型细胞的结缔组织;粘膜下层细胞较少,由基质构成;这两层合计厚度96.6µm。肌层厚度增至70.5µm,由两层平滑肌纤维构成。浆膜层由一层扁平上皮细胞和富含纤维、基质的结缔组织构成,较薄,仅24µm。浆膜层开始出现神经末梢。61d时,瘤胃上皮基底层细胞外凸,开始形成瘤胃乳头。
81~112 d(20~31.5 cm),瘤胃上皮已经完全分化为四层:基底层、棘状细胞层、颗粒细胞层和角质化细胞层。此时,瘤胃乳头更加清晰。上皮基底层、基膜、粘膜固有层和粘膜下层向瘤胃腔内生长。肌层增厚明显(183µm),肌束间出现血管。
113~118 d(32~36cm),粘膜层不再平滑,出现一些起伏,瘤胃乳头向腔内伸出。至113 d,乳头长度达到上皮宽度的一半。中性粘多糖分泌量下降,染色区域集中在棘突层和颗粒层。
120~150d(32~36cm),瘤胃乳头完全分化,但未发现外层细胞脱落现象。中性粘多糖分泌量下降到出生前的最低点,主要由除角质层以外的最外2~3层细胞分泌,未检测到酸性粘多糖、粘蛋白以及类粘蛋白物质。高纤维密度的粘膜层伸入至乳头中,起支撑作用。
出生后瘤胃迅速发育,体积不断增大。刚出生的反刍动物瘤胃是四个胃中较小的。随着年龄的增长,瘤胃的体积和重量不断增大。羔羊瘤胃在7~30日龄期间生长非常显著,8周龄时既能达到相对成年大小[1];犊牛的瘤网胃在8周龄前生长最快,4周龄左右开始出现反刍现象,大概12周龄时达到相对成年大小[1];鹿的瘤胃发育时间较长,2~4周龄发育速度最快,3~4月龄达到相对成年大小。从21日龄到77日龄,羔羊的瘤网胃体积相对体积增加6~8倍,绝对体积增加15~25倍[1];绵羊从16月龄到29月龄,体积增加21%;犊牛瘤网胃在出生时占四个胃体积的33%,10~12周龄时占67%,4月龄时占80%,18月龄时基本达到成年牛水平[2]。
出生后,犊牛瘤胃乳头迅速的发育,特别在一些固体饲料的刺激下,如谷物(图1),长叶状的瘤胃乳头逐渐出现,乳头表层细胞角质化程度提高,不断有大量的角质化上皮细胞脱落,上皮组织的更新加快。1~4周龄羔羊,瘤胃乳头表面较光滑,瘤胃上皮细胞相对细小扁平,而6~10周龄瘤胃乳头表面明显变粗糙。羔羊从4~5月龄到12月龄,单位面积乳头数降低18%,而瘤胃表面积却增加了18%。犊牛出生后的前2个月,乳头的高度和乳头内的成纤维数量降低,而乳头底部直径和乳头间距却在增加。犊牛断奶后,单位面积瘤胃乳头下降达128%,而乳头高度、宽度和表面积均得到极大地提高。

图1 谷物对新生犊牛瘤胃上皮乳头发育的影响(第3d至第35d)
2 瘤胃上皮生长发育的调节
国外对瘤胃组织形态学的研究较为成熟,并且形成了较系统的研究方法。瘤胃的组织形态学发育包括瘤胃上皮细胞生长、分化和与此相关的瘤胃乳头长度、宽度、密度、瘤胃壁厚度以及每平方厘米乳头的表面积,此外还包括瘤胃壁颜色和肌肉层的变化。早期研究发现,日粮因素主要影响对瘤胃上皮生长和发育,而对瘤胃壁厚度和容积的没有作用,瘤胃上皮、瘤胃壁和瘤胃容积的发育可能相互独立。Stobo研究表明,随着精料饲喂量的增加,犊牛瘤胃壁厚度没有显著的变化,而瘤胃上皮乳头长度增加、密度增大;Harrison研究表明,惰性物质(如海绵、牙刷硬毛)对瘤胃乳头的发育无刺激作用,但可增加瘤胃的容积以及肌肉层的厚度。Lesmeister 通过统计学分析对试验所需犊牛数量、样品采集部位、样品采集数量等进行讨论,并认为在评定瘤胃的指标中,瘤胃乳头的长度是最重要因素,其次是瘤胃乳头的宽度和瘤胃壁的厚度,而单位面积内乳头的密度不能作为瘤胃发育评定指标,并通过试验,验证了该方法在研究瘤胃形态学发育过程中的可重复性;此外,瘤胃乳头表面积也是瘤胃粘膜代谢水平的重要体现(Dirksen等)。大量研究表明,瘤胃上皮的生长发育受遗传、神经内分泌等内部因素和日粮营养水平、环境等外部因素的影响,同时瘤胃内环境的变化对瘤胃上皮的生长发育也有一定的调节作用。
2.1 日粮
日粮营养水平的是影响反刍动物瘤胃上皮发育的重要因素,包括日粮营养水平、饲料的精粗料比例、物理性质、代谢产物和饲喂制度等多种方面。
高能量日粮促进反刍动物瘤胃的生长。在对羊和牛的研究发现,与饲喂低能量粗料日粮相比,饲喂高能量精料日粮可以提高瘤胃的干重,促进瘤胃乳头发育,见图2。同样,高能量的同一性质饲料也可以显著的刺激瘤胃的增重。Stobo研究结果表明随着浓缩料饲喂量的增加,可增加犊牛瘤胃上皮乳头长度和密度;当犊牛饲喂低能量饲料时,瘤胃乳头会逐渐退化;而当犊牛饲喂高能量饲料时,其瘤胃上皮增殖加快。Mcleod研究了日粮精粗比以及日粮代谢能水平对绵羊消化道生长的影响,发现高能量组绵羊日增重、消化道重、瘤胃重、瘤胃上皮细胞蛋白合成水平显著高于低能量组。Dirksen在对奶牛的研究中也同样发现,饲喂高能量日粮能增大奶牛瘤胃乳头横切面面积。本实验室以山羊为实验动物,证明了高能量高蛋白日粮促进青年山羊瘤胃乳头的高度、宽度和表面积的增加,同时增强瘤胃上皮对Na+的吸收能力。

图2 低(左)、高(右)水平日粮饲喂对瘤胃乳头发育的影响
饲料的精粗料比例影响瘤胃上皮的生长发育。精料为反刍动物提供更高的能量水平:添加适当精料,瘤胃乳头生长较快,而多喂干草则可促进胃容积和肌肉发育。同时,精料还能够促进羔羊瘤胃上皮细胞RNA、DNA含量和蛋白质合成能力的提高,促进细胞增殖。但是精料并非万能的,粗料的作用也至关重要,研究发现,一定数量的粗料是维持瘤胃上皮乳头高度、单位面积乳头数和乳头表面积等指标的基本条件,而精料比例过高容易引起瘤胃上皮发育异常,如瘤胃乳头不规则分支和瘤胃上皮角化不全。
饲喂制度也是影响瘤胃上皮的生长发育的重要因素之一。日粮饲喂粗料的山羊改喂精料后瘤胃上皮细胞增殖指数迅速显著增大,数天后逐渐降低到稍高于粗料饲喂期水平;瘤胃上皮的周转更新时间降低为4.3d,后持续精料饲喂为10.9d,较粗料饲喂期16.5d显著减少。而对羔羊进行限饲后,瘤胃重量显著的低于正常饲喂的羔羊。有研究人员对山羊先进行161d的低能量饲喂,然后进行154d的高能量饲喂,相比于一直进行低能量的山羊,瘤胃增重34%。Noziere等(1999)也进行过类似的实验,成年山羊分为四组:正常饲喂组(M)、低能量日粮组(U)、正常饲喂78d后过饲精料26d组(MO)和低能量日粮饲喂78d后过饲精料26d组(UO);结果显示瘤胃干重和湿重M组高于U组,MO组高于UO组,UO组高于U组,证实日粮能量和饲喂制度均可以影响瘤胃重量的改变。同时还发现,正常能量较低能量,过饲较非过饲,瘤胃上皮RNA/蛋白比例升高、蛋白/DNA比例下降,而瘤胃上皮肌肉层恰好相反,提示高能量过饲精料通过促进细胞增殖加速山羊瘤胃上皮生长,而肌肉层则通过增大细胞体积来增加重量。
日粮的物理性状也可以影响瘤胃上皮的发育。研究表明,犊牛早期断奶,其乳头长度和宽度均高于晚期断奶;新生反刍动物仅喂乳汁,会延滞瘤胃的发育,这些动物的瘤胃比同龄的正常动物小,胃壁较薄,乳头缺乏正常的发育和色泽(图3)。乳汁作为液体食物通过食管沟时,食管沟反射地蜷缩成管状,成为食管的延长部分,乳汁不通过瘤胃直接进入瓣胃和皱胃,而固体饲料进入瘤胃后能刺激瘤胃上皮发育。但固体饲料的体积也不是越大越好,同一种日粮,进行粉碎后饲喂,可以显著的促进瘤胃乳头的高度和表面积。Greenwood等(1997)研究发现,喂颗粒较粗糙的日粮降低瘤胃干重、瘤胃乳头的高度和宽度。
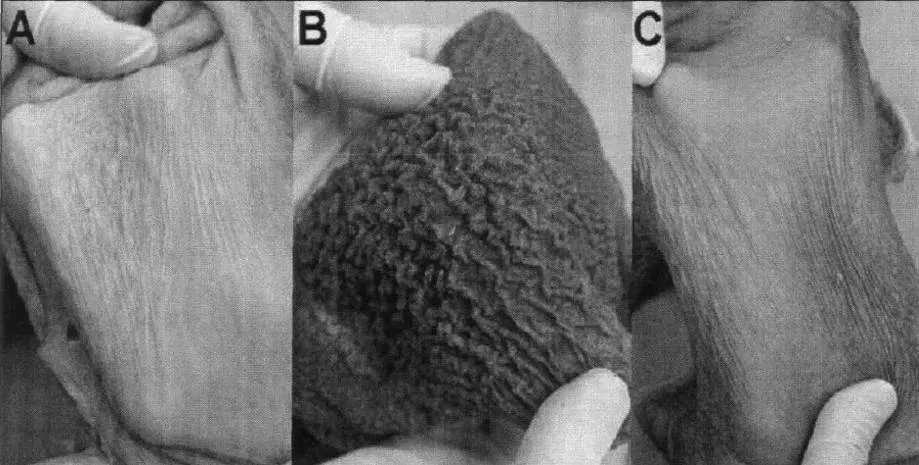
图3 饲喂牛奶(A)、牛奶和谷物(B)、牛奶和干草(C)的犊牛瘤胃乳头发育
2.2 瘤胃内代谢产物
短链脂肪酸(short chain fat acid,SCFA)是瘤胃内微生物发酵的主要产物,它能够促进瘤胃的发育,是瘤胃组织形态发育和吸收能力提高的化学刺激因素,其中丁酸为启动瘤胃发育所必需,起着首要作用,而丙酸/乙酸的比例对于瘤胃的发育也存在一定的影响。Warner(1959)指出,挥发性脂肪酸能增大瘤胃乳头表面积,另外还有助于瘤胃乳头的生长、形态和功能的维持。Asai(1973)研究发现,犊牛喂乳加SCFA,2~3周龄就出现反刍,而仅喂乳则一般到4~10周龄才出现反刍,表明瘤胃发育与饲料中的SCFA有着密切的关系。Shen等(2005)试验证明丁酸灌注能够提高去势公牛瘤胃上皮乳头的的高度、宽度和表面积。Sakata等研究表明,给瘘管绵羊投饲丁酸钠,投饲之前瘤胃上皮细胞的分裂指数低于0.48%,快速投饲后1天,其分裂指数增加到1.29%以上,而缓慢投饲的绵羊,其细胞分裂指数仍低于0.50%,且未出现明显波动,说明挥发性脂肪酸对瘤胃发育的刺激作用可能是由其浓度迅速升高引起的;给瘘管绵羊快速灌喂乙酸和丙酸后,也会引起瘤胃上皮的迅速增生,但与添加丁酸相比,其分裂指数峰值的出现时间推后2~3d,表明丁酸对瘤胃的作用要快于乙酸和丙酸。Mentschel在饲喂犊牛SCFA盐时发现,饲喂丙酸盐和丁酸盐组较对照组瘤胃上皮细胞有丝分裂指数升高,同时饲喂丁酸盐组和对照组较饲喂丙酸盐组细胞凋亡减少,提示丁酸在刺激瘤胃上皮细胞增殖的同时有效的控制其凋亡速率。在体外实验中,SCFA却抑制瘤胃上皮细胞的增殖。这种体内和体外不一致的现象可能和体外缺少某种激素有关,其机理还有待进一步阐明,有学者认为:丙酸和丁酸的组蛋白去乙酰化和DNA甲基化作用与其有关。此外,瘤胃内灌注葡萄糖也可以刺激瘤胃上皮细胞有丝分裂指数。多胺也是影响瘤胃上皮发育的因素之一。
2.3 神经内分泌
2.3.1 胰岛素
胰岛素(Insulin)是胰岛β-2细胞受内源性或外源性物质刺激而分泌的一种双链多肽的蛋白质激素,在促进细胞增殖、分化以及糖原、脂肪和蛋白质的合成代谢中发挥重要作用。
之前已经阐述了S C F A刺激瘤胃上皮生长,G a l f i等(1991)认为一些激素参与其中,包括:胰岛素、五肽胃泌素(pentagastrin,PG)、胰高血糖素(glucagon)和皮质醇(cortisol)等。Sakata研究表明丙酸能够刺激胰岛素的释放。Neogrady等(1989)研究表明,瘤胃丁酸灌注后,血浆胰岛素水平升高,瘤胃上皮细胞分裂增强。进一步研究表明,成年绵羊瘤胃灌注胰岛素引起血浆免疫活性胰岛素浓度升高,进而提高血糖浓度,促进瘤胃上皮细胞增殖;体外研究证实了葡萄糖对瘤胃上皮细胞增殖的作用。Baldwin(1999)验证了胰岛素刺激体外培养瘤胃上皮细胞增殖和DNA合成的作用,但丁酸与其同时处理时,却没有发现它们之间的相互协同作用。成年绵羊静脉注射生理剂量的胰岛素可以显著的促进瘤胃上皮细胞的有丝分裂指数。在青年山羊,瘤胃乳头的高度和宽度与静脉注射胰岛素的剂量相关,在耐受范围内,随着剂量提高,瘤胃乳头的高度和宽度变大。
2.3.2 胰岛素样生长因子-1
胰岛素样生长因子(Insulin-like growth factor-1,IGF-1)主要由肝脏合成,大部分存在于血液中,在体内的表达受到生长激素(GH)的调节。IGF-1主要的生物学效应有以下两类:(1)类似胰岛素的代谢作用:促进组织摄取葡萄糖,调节糖原异生和糖酵解,促进糖原、蛋白质和脂肪合成。(2)促有丝分裂作用:刺激RNA、DNA的合成和细胞增殖。
口服rhIGF-1显著促进新生羔羊瘤胃上皮乳头发育,刺激瘤胃上皮DNA合成。体外研究表明,IGF-1可以刺激瘤胃上皮细胞DNA合成和细胞增殖。Shen等(2004)研究表明,高能量日粮促进瘤胃上皮增殖,提高血浆IGF-1浓度,增加瘤胃上皮IGF-1受体(IGF-1R)的结合能力。推测高能量日粮介导IGF系统促进瘤胃上皮生长发育,这与Ingvartsen等(2000)的推测一致。Shen等(2005)在体内证实,丁酸的促生长作用与IGF-1无关,Baldwin(1999)的体外试验与其一致。
2.3.3 表皮生长因子和转化生长因子-α
表皮生长因子(Epidermal growth factor,EGF)是由53个氨基酸组成的单链多肽,主要由唾液腺、十二指肠Brunner腺分泌至胃肠道,促进上皮细胞的增殖和分化。转化生长因子-α(Transforming growth factor-α,TGF-α)的生物学功能与EGF相似,且只与EGF受体结合。EGF和TGF-α可促进胃肠道上皮细胞和角蛋白细胞增殖,EGF还可促进肠内鸟氨酸脱羧酶、增蔗糖酶和氨基肽酶的活性。体外研究显示,EGF可刺激小肠上皮细胞分裂,提高绒毛刷状缘消化酶的活性。在反刍动物,EGF和TGF-α主要产生于绵羊的腮腺的导管上皮细胞,起主要作用的是EGF。瘤胃上皮细胞存在EGF和TGF-α,但EGF表达很弱。体外研究表明,EGF能够刺激瘤胃上皮细胞增殖和DNA合成,与丁酸没有相互协同作用。目前关于EGF对瘤胃上皮的影响主要集中在对瘤胃上皮损伤的修复上,对瘤胃上皮生长发育的影响研究很少,TGF-α更是未见报道。
2.3.4 胃肠胰肽
胃肠道激素(gastroenter opancreatic peptides,GEP)密切参与动物消化道结构与功能的发育和成熟过程。Johnson等发现胃泌素(gastrin)和五肽胃泌素(pentagastrin,PG)可促进肠上皮细胞DNA合成,增加细胞中总蛋白、RNA和DNA的含量。PG还可刺激大鼠十二指和结肠隐窝上皮细胞有丝分裂。
Puccio等研究发现,蛙皮素(bombesin,BBN)能促进大鼠小肠的生长发育,增加肠道长度,提高肠粘膜细胞蛋白质和DNA含量。胆囊收缩素(cholecystokinin,CCK)、促胰液素(secretin)、肠高血糖素(enteroglucagon)和神经加压肽(neurotensin,NT)等均可促进小肠粘膜上皮细胞的增殖和分化。在反刍动物,gastrin可以提高成年牛瘤胃上皮细胞体外培养时DNA的合成。PG也可直接刺激体外培养的成年奶牛瘤胃上皮细胞DNA合成,但对新生奶牛无明显作用。BBN能够刺激羔羊的生长发育。反刍动物静脉注射CCK和secretin可以促进瘤胃的能动性,但是对其生长发育的研究还未见报道。
2.3.5 其他激素
Galfi等(1991)认为丙酸和丁酸促进体内瘤胃上皮细胞增殖可能是通过胰岛素、五肽胃泌素、胰高血糖素和皮质醇等介导的。胰高血糖素刺激体外培养瘤胃上皮的细胞增殖,而用皮质醇处理却未见差异。生长激素(growth hormone,GH)是IGF-1的促激素,GH刺激肝脏产生IGF-1,从而影响动物的生长发育;同时GH也可以与受体结合,直接产生作用。而GH的分泌受生长激素释放因子(growth hormone-releasing factor,GRF)和生长抑素(somatostatin,SS)的调控。由此可见,GH、GRF和SS均可以直接或间接的影响动物的生长发育。
[1] 韩正康,陈杰.反刍动物瘤胃的消化和代谢[M].北京:科学出版社,1988.
[2] 冯仰廉.反刍动物营养学[M].北京:科学出版社,2004.
[3] Perry T W,Cecava M J. Beef cattle and nutrition[M].California:Academic Press Inc.,1976.
[4] Church D C. The ruminant animal:digestive physiology and nutrition[M].NJ:Prentice Hall Englewood Cliffs,1988.
[5] Nolan J V,Strachin S. Fermentation and nitrogen dynamics in Merino sheep given a low-quality-roughage diet [J].Bri J Nutri,1979,(42):63-80.
江苏高校品牌专业建设工程项目(PPZY2015C230);国家自然科学基金项目(No.30771568);国家973计划项目(No.2011CB100801)
卢劲晔(1983—),男,江苏扬州人,讲师,博士,主要从事动物营养生理研究。
沈赞明

