(S)-N-甲基脯氨醇的合成与表征
罗年华,王勇,钟瑜红,蔡久彪,朱顺桃,郑劼
(1.上饶师范学院 化学与环境科学学院,江西 上饶 334001;2. 上饶师范学院 教育技术与实验中心,江西 上饶 334001;3. 新建二中,江西 南昌 330100)
(S)-N-甲基脯氨醇的合成与表征
罗年华1,王勇1,钟瑜红2,蔡久彪3,朱顺桃1,郑劼1
(1.上饶师范学院 化学与环境科学学院,江西 上饶 334001;2. 上饶师范学院 教育技术与实验中心,江西 上饶 334001;3. 新建二中,江西 南昌 330100)
以(S)-脯氨酸1为原料,在酸性条件和金属锌的催化还原作用下,通过与甲醛反应,高收率获得了(S)-N-甲基脯氨酸2。然后在N,N-二甲基乙酰胺(DMAc)和CH2Cl2体系中,(S)-N-甲基脯氨酸2与SOCl2在0 ℃下反应20 min,制得的酰氯不经提纯直接与加入的甲醇在25 ℃下反应5 h,获得中间产物(S)-N-甲基脯氨酸甲酯3。最后以LiAlH4为还原剂,四氢呋喃为溶剂,高收率(87.3 %)地获得了(S)-N-甲基脯氨醇4。产物结构经1H NMR、13C NMR、HRMS确证。
(S)-脯氨酸;(S)-N-甲基脯氨酸;(S)-N-甲基脯氨醇;合成与表征
(S)-N-甲基脯氨醇在有机合成中是一类重要的反应中间体,具有独特的药理和生物活性[1-2]。它是许多手性药物的中间体,具有很重要的医药价值[3]。许多重要化合物含有该结构片段,如柴胡皂甙B1。此外,(S)-N-甲基脯氨醇在不对称催化反应中也有其重要的应用,如作为手性辅剂参与不对称Heck反应可获得较好的催化结果[4]。同时,以(S)-N-甲基脯氨醇为前提,经过简单的结构修饰后也可直接用于不对称催化反应,如使用(S)-N-甲基脯氨醇衍生的硅醚化合物A[5]与手性季铵盐B[6]用于不对称催化磺酰氯酯化及不对称氢化(图1)。
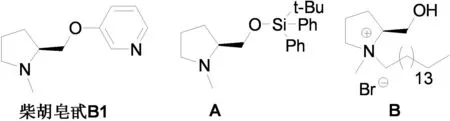
图1 (S)-N-甲基脯氨醇衍生的手性化合物
目前(S)-N-甲基脯氨醇的合成主要有以下几种途径:(1) 以N-Boc脯氨醇为原料,以LiAlH4为还原剂还原获得目标产物[7];(2) 以N-Cbz脯氨酸为原料,以LiAlH4为还原剂还原获得目标产物[8];(3) 以脯氨醇为原料,先与甲醛加成,再以Cu催化还原获得目标产物[9];(4) 以脯氨醇为原料,低温条件下,在n-BuLi作用下与碘甲烷反应获得目标产物[10];(5) 以脯氨酸甲酯为原料,与甲醛加成后再还原获得目标产物[11];(6) 以脯氨醇为原料,先与甲醛加成,再以Pd催化还原获得目标产物[12]。然而上述几种方法有明显的不足:(1) 上述六种合成方法的产率都很低;(2) 方法4中采用的反应条件比较苛刻;(3) 方法6中使用Pd作为还原金属,价格昂贵。
为了解决上述方法的不足,本文发展了一种新型的合成(S)-N-甲基脯氨醇的方法。以(S)-脯氨酸1为原料,在金属Zn催化还原下,与甲醛反应获得了(S)-N-甲基脯氨酸2;然后在N,N-二甲基乙酰胺(DMAc)和CH2Cl2体系中[13-17],(S)-N-甲基脯氨酸2与SOCl2在0 ℃下反应20 min,制得的酰氯不经提纯直接与加入的甲醇在25 ℃下反应5 h,获得中间产物(S)-N-甲基脯氨酸甲酯3;最后3以LiAlH4为还原剂,四氢呋喃为溶剂,高收率地获得了(S)-N-甲基脯氨醇4(图2)。采用该合成路线,在反应过程中获得的中间产物无需进行柱层析纯化可直接用于下步合成反应,直至得到目标产物,具有合成线路短,操作简单,易放大,总收率高(87.3 %)等优点,是一种值得推广的合成方法。

图2 (S)-N-甲基脯氨醇的合成
1 实验部分
1.1 主要仪器与试剂
Avance 400型核磁共振仪(CDCl3与DMSO-d6为溶剂,TMS为内标,德国Bruker公司);Techologies 5975C型质谱仪(美国安捷伦公司)。
(S)-脯氨酸、氯化亚砜、Zn粉、NaH2PO4·2H2O、40%(质量分数)甲醛、碳酸钾、SOCl2、LiAlH4均为AR,均由上海阿拉丁试剂有限公司生产,无需处理,直接使用;DMAc、 CH2Cl2等为市售分析纯。
1.2 合成与表征
1.2.1 化合物2的合成
在室温下,将11.5 g ( 0.1 mol )脯氨酸、13 g ( 0.2 mol ) Zn粉、31.2 g ( 0.2 mol ) NaH2PO4·2H2O加入到500 mL圆底烧瓶中,加入100 mL H2O和11.15 mL ( 0.15 mol ) 40%(质量分数) HCHO, 室温(35oC )下反应20 h。反应结束后过滤,加入CH3OH 与滤液共同旋蒸后得白色固体2。所得产物不需提纯,直接用于下一步反应。
1.2.2 化合物3的合成
在室温下,加入12.9 g ( 0.1 mol )白色固体2、4 mL DMAc和6 mL CH2Cl2,搅拌溶解后,冷却到0 ℃,再慢慢滴加8.70 mL (0.12 mol) SOCl2,维持0 ℃下反应20 min。接着加入9.73 mL(0.1 mol)甲醇,升温并维持在25 ℃下再反应5 h。反应结束,往反应混合物中依次加入80 mL蒸馏水和140 mL乙酸乙酯,转入分液漏斗,分出的水层用乙酸乙酯萃取(140 mL × 2)。合并的有机层依次用2.5%的NaHCO3水溶液洗涤(90 mL*3),饱和食盐水洗涤(60 mL*2)。有机层经无水MgSO4干燥,过滤,旋蒸有机溶剂后,可得13.6 g (0.095 mol )浅黄色油状液体3 (V(CH2Cl2)∶V(CH3OH)=20∶1, Rf=0.24 ) (收率=95 %)。1HNMR (400 MHZ, CDCl3)δ= 1.75-1.84 (m, 1H), 1.91-2.00 (m, 2H), 2.11-2.19 (m, 1H), 2.28-2.34 (m, 1H), 2.41 (s, 3H), 2.95-2.99 (m, 1H), 3.13-3.16 (m, 1H), 3.74 (s, 3H).13C NMR (100 MHz, CDCl3)δ=23.15, 29.66, 40.92, 51.87, 56.32, 67.54, 170.21. HRMS (EI), m/Z: 144.1030, [M+H]+, calcd: 144.1025。
1.2.3 化合物4的合成
室温下将7.41 g (0.18 mol) LiAlH4慢慢加入到装有100 mL THF的250 mL圆底烧瓶中,套上恒压漏斗,往漏斗中加入10.01 g (0.07 mol)上述产物并用25 mL THF溶解。室温下慢慢将其滴入到反应瓶中,滴加完毕后,继续在室温( 35oC )下反应18 h。反应结束后加入50 mL Et2O 稀释反应,慢慢加入25 mL饱和Na2SO4溶液,滴加完毕后,继续在室温下搅拌1 h,抽滤,将所得滤液蒸去溶剂后,减压蒸馏( bp.=106oC, 55 mm Hg) 得8.06 g ( 0.065 mol )无色油状液体4 (收率=92 % ).1HNMR (400 MHZ, CDCl3)δ= 1.61-1.84 (m, 4H), 2.17-2.23 (m, 1H), 2.28 (s, 4H), 2.99-3.02 (m, 1H), 3.37-3.40 (m, 2H), 3.54-3.58 (m, 1H).13C NMR (100 MHz, CDCl3)δ= 22.14, 26.46, 39.81, 56.56, 60.97, 65.42. HRMS (EI), m/Z: 116.107 5, [M+H]+, calcd: 144.107 8。
2 结果与讨论
2.1 产物3的合成
文献[11]已报道的(S)-N-甲基脯氨酸甲酯3的合成,主要是通过(S)-脯氨酸甲酯为原料,然后与甲醛反应接着用NaBH3CN还原获得目标产物2,但是还原剂NaBH3CN价格昂贵,且在后处理过程中也较为繁琐。而本文中使用Zn粉作为还原剂,由于Zn粉便宜易得,同时后处理过程操作简单,过滤后蒸去溶剂后即可获得较干净的产物,有利于该产品的大量合成及工业化生产。
2.2 产物4的合成
文献[10,12]已报道的(S)-N-甲基脯氨醇4的合成,主要是以脯氨醇为原料,然后与甲醛反应,接着用Cu催化还原得到(S)-N-甲基脯氨醇4;或直接以脯氨醇为原料,在n-BuLi作用下与碘甲烷反应获得目标产物。文献已报道的合成(S)-N-甲基脯氨醇4的方法存在一些不足:例如使用Cu为还原剂,反应的收率不高;而在n-BuLi作用下与碘甲烷的反应需在较低的反应温度下进行,反应的操作性较为复杂。以上两个主要原因大大限制了上述合成方法的应用。本文以脯氨醇为原料,通过N-甲基化和羧基甲酯化首先获得(S)-N-甲基脯氨酸甲酯,然后以LiAlH4为还原剂将酯基还原,从而获得目标产物。在该过程中反应只需在室温进行,操作简单,同时反应的后处理直接淬灭后抽滤,蒸去溶剂后进行减压蒸馏获得目标产物。有利于该产品的大量合成及工业化生产。
3 结论
发展了一种新型的合成(S)-N-甲基脯氨醇的方法。以(S)-脯氨酸1为原料,在酸性条件和金属锌的催化还原作用下,通过与甲醛反应,高收率获得了(S)-N-甲基脯氨酸2;然后N,N-二甲基乙酰胺(DMAc)和CH2Cl2体系中,(S)-N-甲基脯氨酸2在氯化亚砜作用下,与甲醇进行酯化获得中间产物(S)-N-甲基脯氨酸甲酯3;最后,以LiAlH4为还原剂,四氢呋喃为溶剂,高收率(87.3 %)地获得了(S) -N-甲基脯氨醇4。该方法具有合成线路短,操作简单,易放大,总收率高等优点,是一种值得推广的合成方法。
[1] MANUEL F P,NICOLASI F R,JUANP G G,et al.Neonicotinic analogues:selective antagonists for α4β2 nicotinic acetylcholine receptors[J].Bioorg Med Chem,2013,21(10):2687-2694.
[2] WITTY D R,BATESON J,HERVIEN G J,et al.Discovery of potent and stable conformationally constrained analogues of the MCH R1 antagonist SB-568849[J].Bioorg Med Chem Lett,2006,16(18):4872-4878.
[3] WEI Z L,XIAO Y,YUAN H,et al.Novel pyridyl ring C5 substituted analogues of epibatidine and 3-(1-methyl-2-(S)-pyrrolidinylmethoxy)pyridine(A-84543)as highly selective agents for neuronal nicotinic acetylcholine receptors containing2 subunits[J].J Med Chem,2005,48(6):1721-1724.
[4] (a)NILSSON P,LARHED M,HALLBERG A.A new highly asymmetric chelation-controlled Heck arylation[J].J Am Chem Soc,2003,125(12):3430-3431.(b)TREJOS A,VMARKER J S,SCHLUMMER S,et al.Stereoselective Heck arylation of a functionalized cyclopentenyl ether using (S)-N-methyl-pyrrolidine as the stereochemical controller[J].Tetrahedron,2008,64(37):8746-8751.(c)DATTA G K,NORDEMAN P,DACKENBERG J,et al.Enantiopure 2-aryl-2-methyl cyclopentanones by an asymmetric chelation-controlled Heck reaction using aryl bromides:increased preparative scope and effect of ring size on reactivity and selectivity[J].Tetrahedron Asymmetry,2008,19(9):1120-1126.(d)DATTA G K,LARHED M.High stereoselectivity in chelation-controlled intermolecular Heck reactions with aryl chlorides,vinyl chlorides and vinyl triflates[J].Org Biomol Chem,2008,6(4):674-676.
[5] PELTIER H M,EVANS J W,ELLMAN J A.Catalytic enantioselective sulfinyl transfer using cinchona alkaloid catalysts[J].Org Lett,2005,7(9):1733-1736.
[6] BIL E G,CORTELAZZO P E,DENICOURT N A,et al.Chiral ammonium-capped rhodium(0) nanocatalysts:synthesis,characterization,and advances in asymmetric hydrogenation in neat water[J].Chem Sus Chem,2012,5(1):91-101.
[7] LI X,WANG B.Pharmaceutically acceptable salts of (E)-N-[4-[[3-chloro-4-(2-pyridylmethoxy)phenyl]amino]-3-cyano-7-ethoxy-6-quinolyl]-3-[(2R)-1-methylpyrrolidin-2-yl]prop-2-enamide as protein kinase inhibitors and their preparation,pharmaceutical compositions and use in the treatment of cancer:EP 2684877 A2[P].2014-01-15.
[8] MIZUNO A,HAMADA Y,SHIOIRI T.New methods and reagents in organic synthesis:a simple one-pot conversion of primary alcohols to nitriles having one carbon atom more[J].Synthesis,1980,(12):1007-1009.
[9] ZHU L,CHENG L,ZHANG Y,et al.Highly efficient copper-catalyzedN-arylation of nitrogen-containing heterocycles with aryl and heteroaryl halides[J].J Org Chem,2007,72(8):2737-743.
[10] LIU X,FOX J M.Enantioselective,facially selective carbomagnesation of cyclopropenes[J].J Am Chem Soc,2006,128(17):5600-5601.
[11] TANG P C,LI X,WANG B,et al.Preparation of 6-aminoquinazoline or 3-cyanoquinoline derivatives as protein kinase inhibitors for treating cancer:WO 2011029265 A1[P].2011-03-17.
[12] LEETE E,BJORKLUND J A,COULADIS M,et al.Late intermediates in the biosynthesis of cocaine:4-(1-methyl-2-pyrrolidinyl)-3-oxobutanoate and methyl ecgonine[J].J Am Chem Soc,1991,113(24):9286-9292.
[13] 罗年华,郑大贵,祝显虹,等.N,N-二甲基乙酰胺促进N-取代肉桂酰胺的合成[J].合成化学,2016,24(5):445-449.
[14] 罗年华,郑大贵,周安西,等.DMAc促进取代肉桂酰吗啉的合成[J].精细化工,2016,33(8):956-960.
[15] 罗年华,郑大贵,祝显虹,等.N,N-二甲基乙酰胺促进取代苯甲酰苯乙胺的合成[J].化学世界,2016,57(8):487-492.
[16] 郑大贵,周安西,祝显虹,等.二甲基乙酰胺高效促进由醇制备氯代烃[J].有机化学,2016,36(1):137-142.
[17] 罗年华,郑大贵,钟瑜红,等.DMAc促进乙酰苯胺的合成[J].化学试剂,2017,39(1):827-830.
Synthesis and Characterization of (S)-(1-methylpyrrolidin-2-yl)- methanol
LUO Nianhua1, WANG Yong1, ZHONG Yuhong2,CAI Jiubiao3, ZHU Shuntao1, ZHENG Jie1
(1. School of Chemistry and Environmental Science, Shangrao Normal University, Shangrao Jiangxi, 334001; 2. Educational Technology & Expenimental Center, Shangrao Normal University, Shangrao Jiangxi 334001; 3. The Second Middle School of Xinjian, Nanchang Jiangxi, 330100)
With (S)-proline 1 and formaldehyde as raw material, (S)-N-methylpyrrolidine-2-carboxylic acid 2 was obtained in high yield catalytized by zinc under acidic conditon. Then, the intermediate product (S)-N-methyl proline ester 3 was synthesized by the chlorination of (S)-1-methylpyrrolidine-2-carboxylic acid 2 with thionyl chloride in dimethylacetamide-dichloromethane at 0 ℃ for 20 min,followed by esterificationsituwith methanol at 25 ℃ for 5 h. Finally, using LiAlH4as a reducing agent, tetrahydrofuran as solvent, (S)-N-methyl prolinol 4 was obtained high yield (up to 87.3 %). The structure of the products was characterized by1H NMR,13C NMR and HRMS spectra.
(S)-Proline; (S)-N-methylpyrrolidine-2-carboxylic acid; (S)-(N-methylpyrrolidin-2-yl) methanol; synthesis and characterization
2017-02-22
江西省教育厅科技项目(GJJ151052);江西省自然科学基金(20161BAB213059);江西省大学生创新创业训练计划资助项目 (201510416006)
罗年华(1982-),男,江西吉安人,副教授,博士,主要研究方向为不对称合成和方法学研究。E-mail: luoxiaoge102@163.com
O626
A
1004-2237(2017)03-0080-04
10.3969/j.issn.1004-2237.2017.03.016

