黄瓜侧蔓扦插技术及其枯萎病抗性鉴定
刘峻蓉,钱春桃
(1.云南农业职业技术学院,云南 昆明 650031;2.南京农业大学新农村发展研究院有限公司,江苏 常熟 210095)
黄瓜枯萎病是我国乃至世界黄瓜生产上的主要病害之一,其常年发病率为10%~30%,病重年份可达80%~90%[1]。而且,由于连年种植,土壤中枯萎病菌大量积累,发病率逐年增加,发病期亦有提前趋势[2]。黄瓜枯萎病病原菌主要为尖孢镰刀菌黄瓜专化型[Fusarium oxysporum(Sch1.)Emend. Snyd. & Hans.]。在我国流行的菌系为尖孢镰刀菌4号生理小种(F. oxysporumf.sp.cucumerinum)[3]。
最安全、最有效的防止黄瓜枯萎病的方法是开展抗病育种,对黄瓜材料枯萎病抗性进行鉴定评价则是黄瓜抗病育种的前提。有人研究利用同工酶酶谱的变化[4]和愈伤组织的离体鉴定来评价抗性,但是这些方法对技术和设备的要求很高,在生产上无法推广;而目前在生产上广泛应用的苗期胚根和蘸根接种鉴定方法结果最可靠,但是工作量大、周期长,而且,这2种方法都容易导致被接种黄瓜资源的死亡、丢失,这无疑在一定程度上阻碍了黄瓜育种。因此,如何构建一套实用安全、可靠的鉴定方法,仍是黄瓜抗性种质资源创制和抗性育种的重要基础工作。
扦插技术可以增加繁殖系数,缩短育种进程,降低育苗费用,所以在黄瓜实际生产上具有一定推广价值。如果能够利用侧枝进行抗性接种鉴定,即使侧枝发生枯萎病而死亡,仍能避免植株接种死亡。目前,对于黄瓜扦插的研究报道还较少。试验通过不同基质及激素对比研究了对黄瓜侧蔓基质扦插和水扦插的影响,旨在探索适宜黄瓜侧蔓扦插成活的条件和方法,并探索利用这些扦插苗进行黄瓜枯萎病的接种鉴定研究。
1 材料和方法
1.1 试验材料
1.1.1 植物材料
基质扦插所用材料:试验用黄瓜品种为北京截头。待该品种进入抽蔓期,选取健壮无病的侧蔓顶端部位作插穗。
水扦插所用材料:试验用黄瓜品种分别选用了抗、感黄瓜枯萎病的品种。第1批取样品种为CC2、5409F、5237F、5238F、5713F、5203F、5707F;第2批取样品种为5702F、5703F、5704F、5705F、5706F、5338F、5237F、5201F、5202F、5207F、5208F、5218F、5219F,每品种各取10株。2014年5月份待品种进入抽蔓期,选取健壮无病的侧蔓顶端部位作插穗。
1.1.2 病原物
病原物为云南农业职业技术学院蔬菜课题组实验室自培养。
1.2 试验方法
选取健康植株的侧蔓作为材料。将侧蔓用经75%酒精消毒的刀片在紧靠茎节处用直角切法切取7~10 cm长的插穗(要求切口平滑);去掉基部叶片,上部保留2~3片叶片。
1.2.1 基质扦插
1.2.1.1 基质及容器准备
选取颗粒较大的河沙,清洗后进行高压灭菌,盛装于规格为45 cm×30 cm×20 cm的穴盘中。将花泥进行切割,盛装于另一相同规格的穴盘中,然后用无菌水灌透。每小块花泥均为相同的等腰梯形,在上方预先打孔(约2 cm深),待插入插穗后用河沙填满孔隙。
1.2.1.2 扦插
将用NAA 1、2 mL/L,ABT 1、2 mL/L及清水浸蘸的插穗各14枝分为2组,一组扦插于花泥中,一组扦插于河沙中。自然环境下试验于5月17日开始,培养室环境下只进行清水处理,试验于5月27日开始;试验均于6月5日结束。
1.2.1.3 扦插后管理
自然环境下,扦插后3 d适当遮阴,4~6 d中午前后遮阴,7 d后不必遮阴。白天气温保持在25 ℃左右,夜间气温为16~18 ℃,空气相对湿度为80%~90%,湿度过高可打开穴盘盖上的天窗通风。培养室环境下,恒温26 ℃,日光灯持续光照,适时喷水,保持相对湿度为80%~90%。
1.2.2 水插
将插穗取下后立即用NAA 1、2 mL/L,ABT 1、2 mL/L及清水(对照)浸蘸基部约3~5 s,待稍干后供扦插用。利用高压灭菌的三角瓶进行无菌水扦插培养,扦插后将三角瓶置于培养室。每天早晚观测1次,晚上把扦插苗从26 ℃组织培养室里移至室温条件下(18~20 ℃),每天换1次水,防止烂根。
1.2.3 利用水插生根侧蔓进行接种鉴定
在扦插基础上,挑取保存的黄瓜枯萎病病原菌,用无菌水稀释到约1×(105~106)个/L,把已经生根的扦插苗在病原菌溶液中浸泡大约30 min,然后再放入原容器中,观察扦插苗后续症状。
2 结果与分析
2.1 基质扦插效果及其影响因素分析
2.1.1 生长调节剂对插穗的影响
表1试验结果表明,河沙组扦插苗的生根和生长情况均优于花泥组(表1)。在同一种类同一浓度生长调节剂ABT(1 mL/L)处理下,河沙组插穗生根率(57.1%)明显大于花泥组(28.6%),且最大根长可达花泥组的2.2倍左右。另外,河沙组插穗生长旺盛,其株高明显大于花泥组。
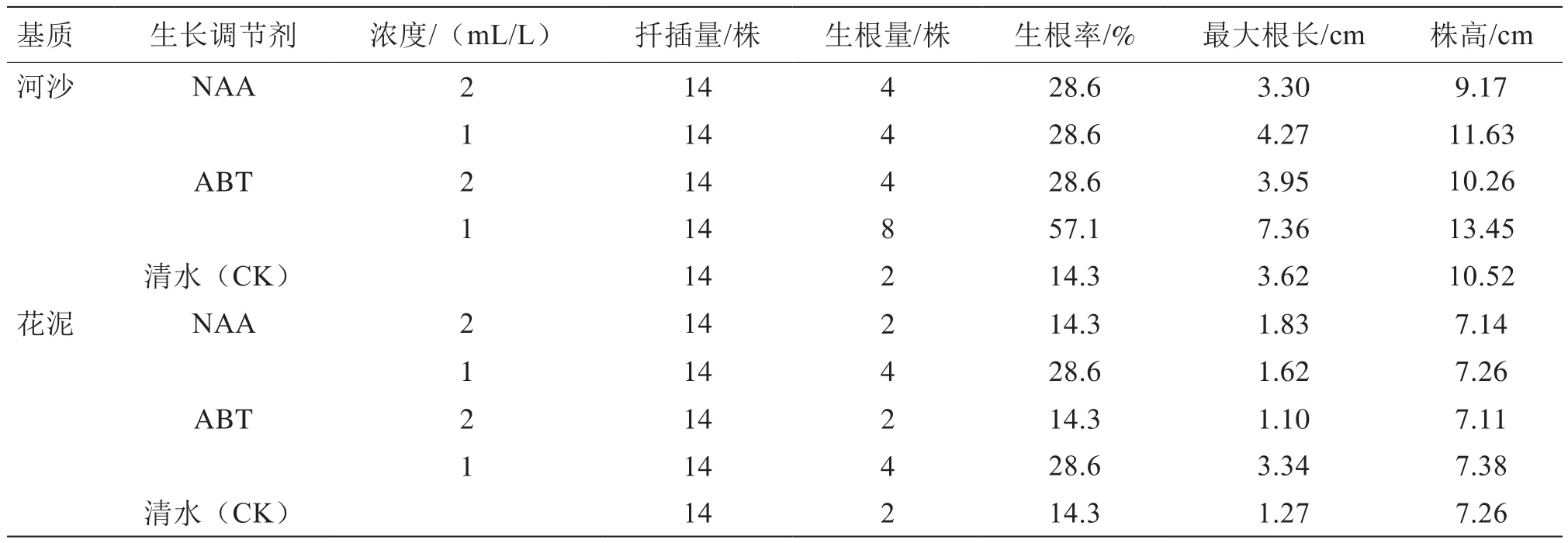
表1 自然条件下生长调节剂对插穗的影响
2.1.2 生长调节剂对插穗再生根的影响
试验结果表明,花泥组插穗易形成愈伤组织,并在愈伤组织基础上萌生乳白色的根,这种根粗短而光滑,而河沙组插穗未形成愈伤组织,直接形成细长而且表面粗糙的根。另外,除了在茎节下部周围发根,也偶见在节间长出根的现象,表明黄瓜插穗易生出不定根。
正常情况下,叶和根是同时萌发的。在试验中发现,成活的插穗中仍有部分尚无发根迹象,但其长势良好,可能是假活现象,即插穗在一定温度和湿度条件下即便不生根也可萌发叶和芽,这时叶和芽生长所需养分来源于插穗中原有的养分。
2.1.3 影响因素分析
2.1.3.1 生长调节剂的影响
从表1可以看出,清水对照处理的插穗有一定的成活率,但其生根率及最大根长明显小于经生长调节剂处理的插穗,说明使用生长调节剂处理是必要的,而且不同浓度的NAA和ABT溶液对用河沙和花泥2种基质扦插的插穗均具有一定的生根促进作用。河沙组表现尤为明显,各生长调节剂处理下的生根率可达对照的2~4倍。生长调节剂处理的效果以ABT更优。另外,从2种浓度看,低浓度生长调节剂处理效果反而优于高浓度,其中ABT 1 mL/L对刺激生根效果最好,其次为NAA 1 mL/L。经ABT 1 mL/L处理后的插穗最大根长可达对照的2倍左右。
2.1.3.2 环境的影响
培养室条件下(26 ℃,光周期16 h/8 h),扦插后3 d可见根,且根系生长迅速,在试验期的20 d内生根率高达68.3%(表2),最大根长为13.6 cm;而自然环境下温度不易控制,夜间温度较低,根系发育缓慢,扦插后10 d才见根,在试验期的20 d内生根率仅为25.7%,其成活率也明显低于培养室组。另外,在不同环境下,仍表现为河沙组扦插效果优于花泥组。当长至1片真叶展开、根系发育良好时,便可以育苗移栽。

表2 不同环境对扦插的影响
2.1.3.3 基质性质的影响
花泥虽然持水力强,保湿性好,但因其质地细密,不利于根系生长;而河沙疏松、通透性较好,能满足黄瓜生育环境要求,有利于根的萌发和伸展。
2.1.3.4 侧枝状况及操作要点
从健壮无病的植株上取长l0 cm、有2~3个节的侧枝。侧枝要用锋利的刀片斜切取,而不要用钝剪或手折,保持切口整齐,防止侧枝表皮造成较大伤口,不易愈合。把切取的侧枝上展开的叶片全部去掉,只剩下生长点处的小叶片,在阴凉背风处放30 min,以利伤口自然愈合。
扦插苗由于没有主根,只有侧根,根层较浅,所以栽培管理上要比种子苗更要注意勤追肥严浇水,少量多次进行。而且扦插苗在生长前期的5节以下的幼瓜要及早摘除,以促进植株健壮生长。
2.2 水插效果及其影响因素分析
与基质扦插一样,水插也可以获得扦插苗,但是扦插苗比较细长,茎端发出的根细而长(图1),而基质扦插所获得的苗多、短且较密,茎端发根多,也较粗。水插生根所需要的时间大致为3~7 d内可以从切取的部位看见白色气生根。

图1 侧蔓扦插效果
扦插母本植株的带菌情况对插条的成活率影响非常大。如果插条已经发病,枝条发病死亡的扦插苗多散发恶臭,而且镜检时多检测不到孢子,表明导致扦插苗死亡的可能主要是细菌性病害。
插穗的生理状态不同,对扦插成活率也存在显著影响。幼嫩插穗很难成活,常在3~5 d内就腐烂死亡,生根成活率仅约1%左右。然而衰老植株,如“花打顶”的植株,插穗同样不容易生根,在扦插后2周左右叶片枯黄死亡,生根存活率也常低于5%。只有健壮的枝条容易生根存活,常在1~2周内生根存活,生根成活率可以超过50%。
2.3 利用水扦插苗进行枯萎病抗性鉴定可行性分析
试验发现,水扦插生根成活苗接种黄瓜枯萎病原菌后出现了病征。从第3天起,其不定根基部开始变褐色,在第5~7天茎表面出现明显褐色,同时叶片萎蔫,渐渐干枯死亡。镜检扦插苗的不定根及茎基部的维管束,只检查到少量的大型或小型分生孢子,未发现大量菌丝。抗、感品种在发病时间和镜检分生孢子在茎基部维管束中扩散速度的表现不同:感病品种发病时间较抗病品种短,同时感病品种镜检分生孢子在茎基部维管束中的扩散速度也较抗病品种快。在湿度恰当的条件下,侧枝存活的时间一般都在15~20 d,采用枯萎病接种鉴定仅需7~10 d即可。因此利用黄瓜侧蔓扦插苗进行接种鉴定枯萎病抗性,可以节省大量资源。
3 结论与讨论
试验以清水为对照,用2种浓度的NAA和ABT溶液分别对插穗进行处理,结果得出不同浓度的2种生长调节剂均能促进插穗生根,而以ABT 1 mL/L处理效果最好。从试验结果可得:黄瓜侧蔓扦插的成活率和生根率都不高。影响其生根的因素目前尚不明确,可能和品种自身有关[11],也可能与扦插使用的基质[12]、生长调节剂[13]及环境有关,而且还可能与扦插液中的微量元素的种类和含量有关[14],因此,要精确优化侧蔓扦插系统,还需要开展更加严格的试验。
试验发现,黄瓜侧蔓扦插的效果受基质的理化特性影响很大。黄瓜插穗在花泥和河沙2种基质中均能生根,但在花泥中生根数量少而弱,而在河沙中根系相对生长旺盛。此外,花泥中的插穗易腐烂,成活率低,这与其疏松透气性不同有关,而水插则易受扦插母本的带菌情况及插条生理状态的干扰。利用水扦插苗进行黄瓜枯萎病抗性鉴定研究,侧枝存活的时间较枯萎病接种鉴定所需要时间长;同时抗、感品种在发病时间和镜检分生孢子在茎基部维管束中扩散速度的表现不同,因此利用黄瓜侧蔓扦插苗进行接种鉴定枯萎病具有可行性。在透明的容器中进行侧蔓水插,容易观察到发根过程以及随后的发病进程,因此,扦插再生蔬菜的病害抗性鉴定值得进一步研究开发。
[1]侯安福,尹彦.黄瓜枯萎病抗性遗传规律的研究//李树德.中国主要蔬菜抗病育种进展[M].北京:科学出版社,1995:439-444.
[2]李怀智.我国黄瓜栽培的现状及其发展趋势[J].蔬菜,2003(8):3-4.
[3]闫敏,李平,李凤梅,等.黄瓜根际镰刀菌的分离及初步鉴定[J].西南农业学报,2004,17(3):345-347.
[4]NETZER D,NIEGRO S, GALUN F. A dominant gene conferring resistance toFusarium wiltin cucumber[J].Phytopathology,1977,67:525-527.
[5]森下义郎,大山浪雄.植物扦插理论与技术[M].云森,译.北京:中国林业出版社,1998:89-102.
[6]高志奎,王梅.黄瓜四季高效栽培技术[M].石家庄:河北科学技术出版社,2008:38-45.
[7]徐爱东.蔬菜扦插育苗技术[J].蔬菜,2000(9):10-11.
[8]张德纯,王德槟.不同基质及生根粉对菜用枸杞扦插苗生长的影响[J].蔬菜,1999(9):31-32.
[9]李曙轩.植物生长调节剂与蔬菜生产[M].上海:上海科学技术出版社,1992:112-129.
[10]崔永华.水果黄瓜的发展现状及大棚高效栽培技术[J].吉林蔬菜,2013(10):6-7.
[11]王关林,苏冬霞,吴海东.代谢调节剂对嫩枝扦插繁殖成活率的影响及其机理[J].园艺学报,2006,33(2):395-398.
[12]张树振,金樑,周虹.生长调节剂和基质对紫花苜蓿扦插繁殖效率的影响[J].草业科学,2013(6):74-79.
[13]BALESTRI E, LARDICCI C. Stimulation of root formation inPosidonia oceanicacuttings by application of auxins (NAA and IBA) [J]. Marine Biology,2006,149(2):393-400.
[14]ASAHINA M, GOCHO Y, KAMADA H, et al.Involvement of inorganic elements in tissue reunion in the hypocotyl cortex ofCucumis sativus[J]. Journal of Plant Research,2006,119:337.

