蔡司LSM 7DUO NLO激光共聚焦显微镜的应用和管理
许佳玲, 王晓红, 罗剑文, 龙 钊, 陈云凤, 张以顺
(中山大学 生命科学学院, 广州 510275)
蔡司LSM 7DUO NLO激光共聚焦显微镜的应用和管理
许佳玲, 王晓红, 罗剑文, 龙 钊, 陈云凤, 张以顺
(中山大学 生命科学学院, 广州 510275)

介绍了蔡司LSM7DUO NLO激光扫描共聚焦显微镜三个组成部分单光子、双光子和快速扫描的硬件配置和软件功能以及成像和图像分析的应用,例如单、双光子图像叠加,多视野拼接拍摄、三维重构等功能在生命科学研究中的应用。介绍管理该仪器的一些方法和心得,保障仪器为教学和科研工作提供更好的服务。
激光共聚焦显微镜; 双光子; 图象采集
0 引 言
激光共聚焦显微镜是一种图像采集和分析的大型仪器,传统的单光子激光共聚焦显微镜是利用连续光激光器作为光源对荧光样品进行激发后经过一系列光电成像部件进行信息采集和信号放大,由于光路中的共轭聚焦装置使得焦平面以外的杂散光无法进入探测器从而得到较高分辨率的图像[1-3]。双光子激光共聚焦成像是利用飞秒激光器发射的脉冲光对荧光样品进行激发,只有分布在样品焦平面的荧光素分子能获得足够的光量子发射出荧光,这就避免了非焦平面荧光的干扰,从而提高成像的亮度和信噪比[4-7]。快速扫描的部分是利用线扫描的成像模式提高成像速度,可应用于钙火花或者微生物运动这类快速反应的拍摄,利于捕捉更多的动态细节。
整台仪器具备点扫描和线扫描两种扫描模式,配备由紫外到红外不同波长的激光器以及高灵敏度探测器;另外配备活细胞工作站可用于长时间对细胞的监测,压电陶瓷Z轴纳米级载物台等硬件为实验解决方案提供了更多的选择。由于该仪器实行校内外共享服务,是生物学实验教学中心公用仪器平台中使用频率最高的仪器之一,在管理和维护方面需要达到更高的标准[8-9]。
1 配置参数
(1) 光源。整机配有8根独立的激光器,激发光源覆盖范围较广,能够满足多种荧光样品成像需求。单光子激光器波长分别是405 nm、458 nm、 488 nm 、514 nm、561 nm、633 nm;双光子使用的飞秒激光器波长为 690~1 060 nm;快速扫描部分配备的高功率激光器波长为405 nm、488 nm和532 nm。
激光器发出的激光通过AOTF声光控制器动态调节激光输出的强度,调节范围为0.1%~100%,从而实现扫描范围内的激光强度控制。
(2) 检测器。点扫描成像检测器由2个PMT通道和32个高灵敏GaAsP通道组成,成像最大分辨率可达6 144×6 144,扫描速度最高为8幅/s,可探测单光子和双光子信号。外置的2个NDD探测器专用于探测双光子荧光信号,其光路直接由侧向收集避免荧光传输在多个棱镜和光学器件中过多损耗,成像最大分辨率6 144×6 144,扫描速度最高为8幅/s。快速扫描部分的线扫描检测器由2个CDD组成,成像最大分辨率为1 536×1 536,扫描速度最高可达到120幅/s。
(3) 显微镜。研究级电动倒置显微镜Observe Z1,物镜10×(NA 0.45)、20×(NA 0.8);水镜32×(NA 0.85)、63×(NA 0.85);油镜40×(NA 1.3),100×(NA 1.4)。配置高数值孔径的物镜可为成像带来更高的分辨精度。
(4) 压电陶瓷Z轴纳米级载物台和活细胞工作站。压电陶瓷Z轴纳米级载物台Z-Piezo stage最大扫描范围250 μm,resolution 5 nm,配合LIVE快速扫描探测器可实现更精准和细致的成像效果。活细胞工作站incubator PM S1带有培养皿和6孔恒温样品槽,温度控制范围为室温-60 ℃,精度可达0.1 ℃;加湿加热模块、二氧化碳浓度控制在0%~8%和氧气浓度控制在0%~21%,保证细胞生长的环境,适合长时间观察。
(5) 软件。ZEN2011,包含基础模块、生理学模块、拼图和多点取图模块、FRAP模块可满足多种实验图像摄取和分析。
2 主要功能特点及在生命科学研究中的应用
2.1 单光子、双光子高精度多通道成像及图像分析
单光子共聚焦显微原理是利用短波长高能量的激发光激发样品发射出长波长较低能量的荧光实现成像,样品所发出的荧光经过针孔过滤焦平面以外的杂散光使荧光成像更精确,其平面分辨率可达200 nm,成像质量可达到6 144×6 144;而双光子激光共聚焦成像则是利用长波长的红外脉冲光进行激发,荧光样品仅在焦平面能够得到足够的光子才能受激发射出较短波长的荧光,所以双光子激光共聚焦无需针孔就能够实现焦平面成像,其平面分辨率可达180 nm,图像的Z轴分辨率较高,其成像质量可达到6 144×6 144。单光子和双光子荧光图像以及DIC多通道叠加效果如图1所示。得到2维图像可以做荧光半定量、共定位分析,在zen2011软件中可以在histo和coloc中进行相应操作,分别如图2、3所示。
2.2 三维重构
样品在激光共聚焦显微镜下可进行连续的光学切片,在软件中设置光切的起始点和结束点以确定扫描范围并设置好光学切片之间的间隔,需要注意的是如果进行多个荧光通道的层切,在软件中选择“matchpinhole”进行多通道拍摄厚度的校准,较厚的样品可对不同深度的激发光和PMT电压可以进行优化;针对小鼠胚胎和器官等超大样品的三维重构,建议先对样品进行透明化处理[10-11],再用双光子部分进行光切成像。某些荧光容易淬灭的样品又需要做三维重构时,我们建议使用Piezo载物台并选择快速扫描模式进行成像,尽量减少激光在样品上停留的时间,最大程度降低光漂白效应;得到的连续多张光学切片图像之后可在软件中进行3维重构。重构效果可根据样品的需求和特性在软件的3D高级应用模块中进行相应的选择及调整,最后输出图片或视频,如图4所示。
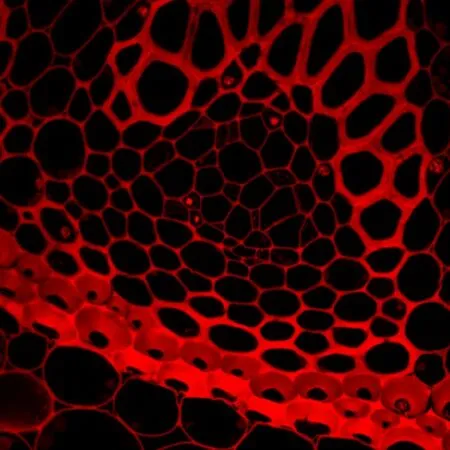

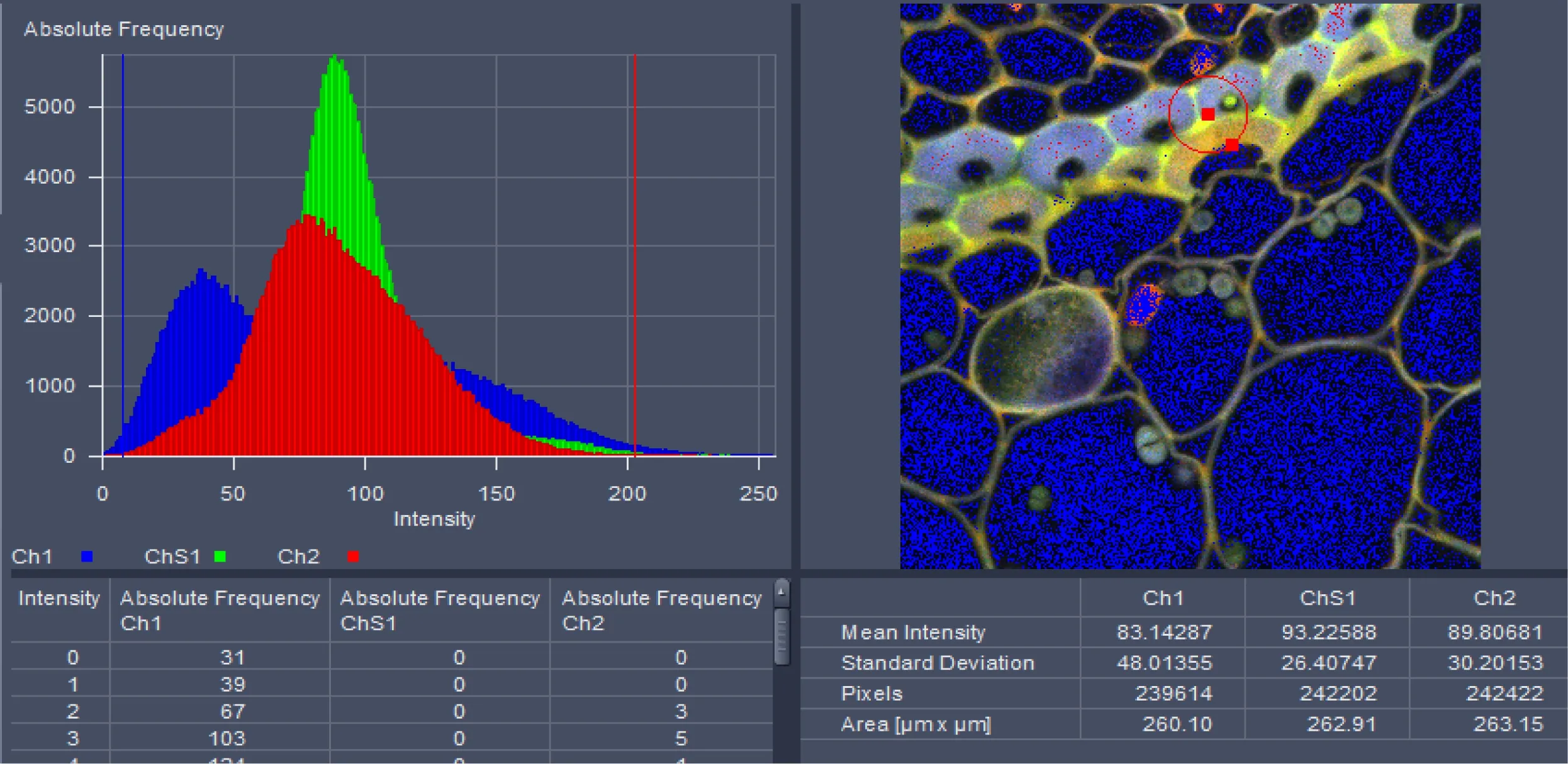
图2 Histo功能及分析结果示意图
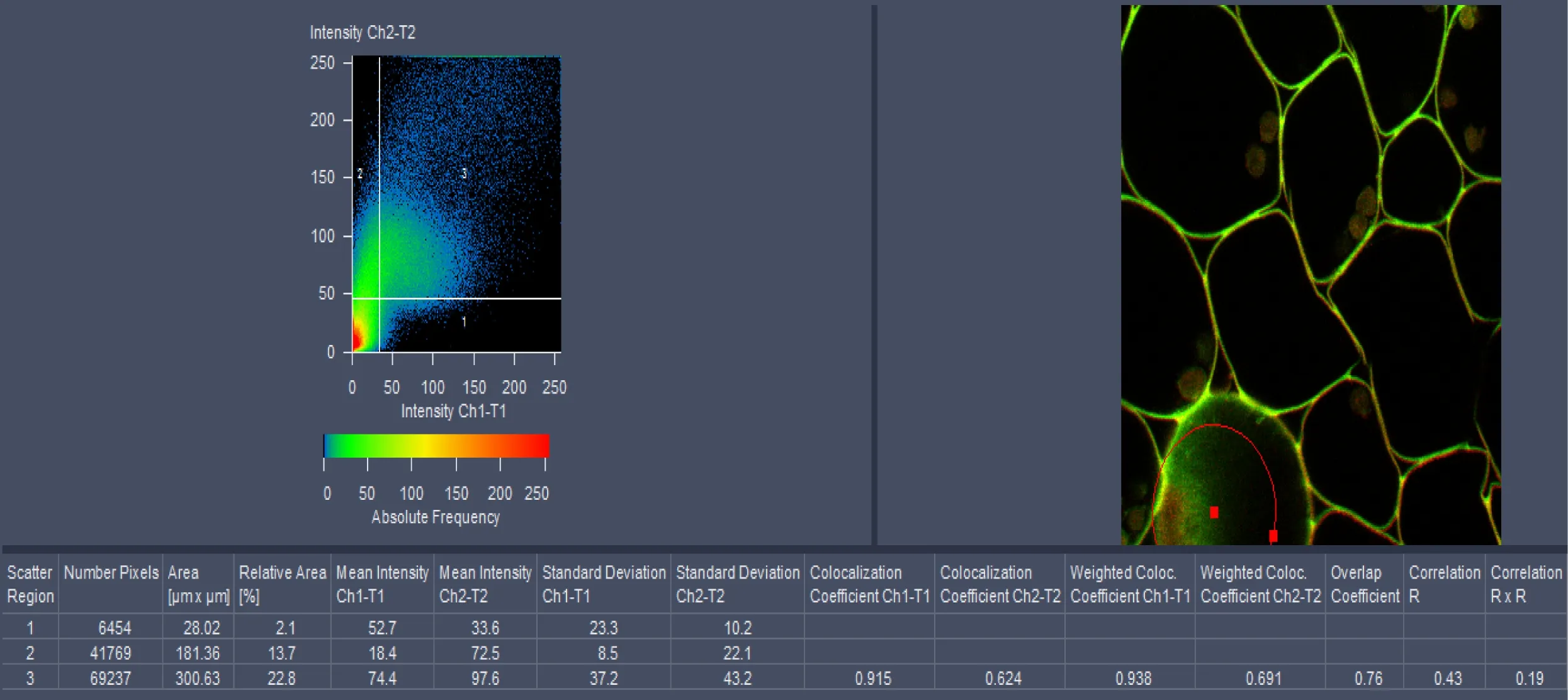
图3 Coloc功能及分析结果示意图
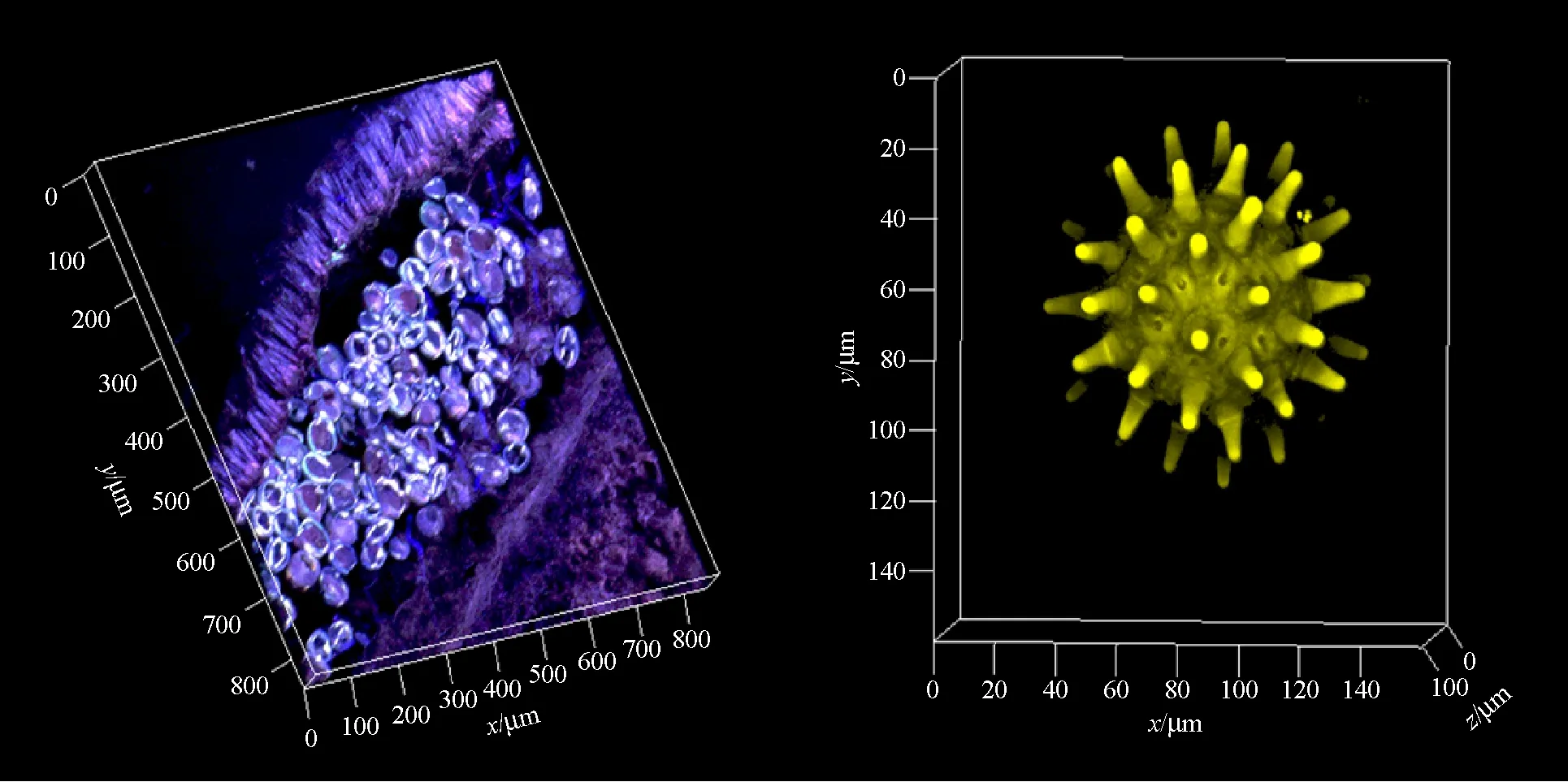
图4 3维重构示意图
对于一些需要三维重构之后进行分析的特殊样品,拍摄之后可在Orth功能下进行三维定位分析判断不同荧光样品在空间分布的相互关系,如图5所示。
2.3 图像拼接
利用zen2011软件中tile scan模块可对脑片、动物胚胎、斑马鱼、植物组织等生物样品的显微图像拼接进而完成整体成像(见图6)。除了在平面上进行拼图,还可以结合z-stack进行大样品整体三维重构。拍摄图像时需要在软件中设置小图之间overlap,保证图像拼接柔和过渡,避免拼接痕迹过于明显。

图5 Orth功能下图像的3D分析图图6 拼接拍摄植物根部横切图
2.4 长时间活细胞培养观察
使用zen2011软件中time series可实现时间序列的拍摄,在菜单中进行时间序列的设置除了设置拍摄数量和时间间隔之外还有多重选择,比如拍摄的起始、停顿等以及加药可以设置marker并接通灌流装置进行触发等等,使实验的操作更具人性化。
结合活细胞工作站实现较长时间观察细胞的形态、记录细胞内的荧光变化(如钙离子、PH值的监测),为了避免细胞多次扫描出现光漂白的情况,建议设置拍摄条件中使用较低激光强度和较高的PMT电压进行成像。针对特殊样品,比如一些反应极为迅速或抗淬灭能力较弱的样品进行相关的图像采集,建议使用快速扫描模块进行拍摄。
2.5 激发光谱扫描和发射光谱扫描
激发光谱和发射光谱扫描能够全面地检测样品的荧光特性,为荧光采集和后期图像处理提供依据。双光子激光共聚焦是基于非线性光学一种成像模式,荧光素在与生物样品结合之后可能会出现不同程度的蓝移或红移,可以利用飞秒激光器的连续可调的特点,利用excitation fingerprinting功能模块进行激发光谱的全面扫描,帮助找寻到最高效成像的激发波长,这种方法同样适用于对未知样品的检测。
发射光光谱扫描则是对样品在特定波长激光的激发下所发射的荧光分布情况,这类功能适用于解决激发光串扰的荧光样品,比如解决植物的叶绿体自发荧光、动物切片中的血细胞自发荧光对图像的干扰[12]。激光共聚焦显微镜配备的高灵敏探测器在lambda mode下能够实现波长8.9 nm每幅图像一次成像,提高发射光谱扫描的准确性。扫描得到多张不同波长接收到的图片后在软件Unmixing功能下可以得到样品不同部位的发射光光谱曲线,如图7所示。
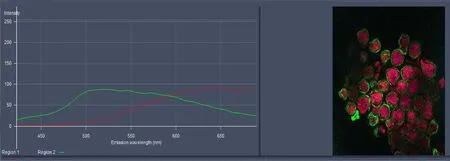
图7 双光子激发光下样品不同部位的发射光光谱图
2.6 光漂白恢复、荧光能量共振转移
光漂白恢复的实验用于量化分子流动性,可用于测定细胞膜蛋白的流动性、细胞之间的缝隙连接通信功能[13]。在软件中需要设置漂白的区域、用于漂白的激光强度、光漂白的次数、拍摄时间序列图片完整呈现光漂白和恢复的过程等。双光子激光器的能量较高,针对需要对某些荧光分子较稳定难以漂白的样品进行光漂白实验时可以选用;若荧光分子的流动性极好,漂白后恢复的时间非常短,可以用快速扫描模块进行快速图像采集尽可能捕捉更多的动态细节。软件中有相应的数据分析功能,针对集中较常见的情况也给出了拟合的曲线可供选取。
荧光能量共振转移用于测量分子之间的相互作用,常用的方法有受体漂白法和受体发射测定法;另外双荧光互补载体系统(BIFC)则更多地被应用于植物细胞的研究中[14-16]。zen2011软件中配有专门处理荧光能量共振转移这一类实验的FRET模块,便于用户对采集到的图像进行分析。
3 维护要点
(1) 规范操作。日常操作严格按照操作规程,遵守仪器的开关机流程,做好物镜的清洁,使用结束后保证激光器充分散热才能关闭仪器。设置缓冲间将实验操作区域和成像区域严格分开,避免有毒有害药物试剂污染显微镜房。
(2) 仪器室内洁净度。显微镜这类光学仪器,对室内洁净度要求较高,定期对实验室内进行除尘和净化,保持室内空气洁净;并要求进入显微镜房的人员必须穿实验服,更换专用的鞋套或拖鞋。
(3) 温湿度控制。显微镜房内为了进行温度控制,安装了2台高功率的冷暖空调,保证室内温度常年维持在18~22 ℃;南方的天气比较潮湿,特别是每年的梅雨季节,为了保护光学镜头避免霉变,安装了3台大容量抽湿机轮流工作,将湿度控制在40%~60%之间。
(4) 遮光。荧光样品必须避光保护,而双光子激光共聚焦专用的NDD探测器极容易受外界光线干扰,所以在仪器的避光方面,准备了针对单光子和双光子成像两套避光方案,双光子成像方案利用环保遮光布在显微镜不同工作区域进行避光处理,其避光率达到98%以上,图像采集时尽量减少外界光线干扰。
4 管理模式探讨
(1) 通过公用仪器平台的网站进行网络预约。用户必须经过管理员培训合格之后方能获得预约权限;提前2~7天进行网上预约,用户严格按照预约时间进行实验,爽约或迟到会有相应处罚,避免用户超时预约,造成机时浪费。
(2) 培训方式。用户首次使用仪器时,由管理人员陪同拍摄图像直至用户能够自行操作,管理人员也提供相应的前期样品处理和后期数据分析指导并在网络上提供了相关操作指南和软件操作视频。用户按照操作规程正规使用仪器和软件,能够避免人为错误操作造成仪器和人身损害,例如使用结束之后必须让激光器彻底散热之后才能关机,保证激光器的正常使用寿命;使用双光子成像时,更换样品必须切换到肉眼观察模式,避免灼伤。
根据使用情况,每学期开展显微成像技术相关讲座,对用户遇到的各种问题进行分析和探讨,增进管理人员和用户之间的交流。
(3) 后期数据分析。提供zen2011离线软件可自行安装使用,针对一些较大图像,提供台式工作站级别电脑供给用户进行高级数据分析,安装Imaris 3D图像分析软件可进一步描绘和计算。
(4) 为校内外提供测试服务。本仪器已被纳入广州地区大型科学仪器协作网为校外单位提供测试服务,每年对外提供服务的机时约为50~100 h。
(5) 定期整理仪器使用情况。定期整理用户使用的情况,包括用户所拍摄的样品和激光器的使用等情况,制定相应的仪器保养计划,并对激光器的寿命进行预估,及时做好激光器的更新申报。及时收集用户使用的反馈情况,包括使用出现的疑问和应用发面的需求以及文章发表情况。
5 结 语
激光共聚焦显微镜广泛应用于生命科学、材料学、医学研究等领域,LSM7DUO NLO 由点扫描共聚焦780LSM与双光子共聚焦NLO和线扫描共聚焦live三部分组成,搭载这3种不同类型检测器为用户提供更多的图像采集方式;激发光范围覆盖紫外到红外之间,能为更多的荧光样品提供匹配的激发光;图像拼接和三维层切等多种拍图模式性能互补使其在相关研究应用中更加灵活。如此庞大的显微成像仪器,如何做好维护和管理并且更好地开发利用是仪器管理人员需要继续研究和深入的问题。
[1] 刘爱平,郭 振,王琦琛.细胞生物学荧光技术原理和应用[M].合肥:中国科学技术大学出版社,2012.
[2] 袁 兰.激光扫描共聚焦显微镜技术教程[M].北京:北京大学医学出版社,2004.
[3] 王春梅.激光扫描共聚焦显微镜技术[M].西安:第四军医大学出版社,2004.
[4] P. Michael Conn.共聚焦显微技术[M].北京:科学出版社,2012.
[5] Alberto Diaspro. Confocal and Two-photon Microscopy: Foundations, Applications ,and Advances [M].New York: Wiley-Liss,Inc,2002.
[6] Denk W,Strickler J H,Webb W W . Two-photon laser scanning Microscopy [J].Science,1990,248:73-76.
[7] 张祥翔.现代显微成像技术综述[J].光学仪器,2015,37(6):550-560.
[8] 张以顺,冯 双,罗剑文,等.实验教学示范中心大型设备共享平台建设探索与实践[J].中国现代教育装备,2010(21):15-18.
[9] 冯 双,张以顺,吴卓华.提升高校贵重仪器管理与服务水平途径的探讨[J].实验技术与管理,2011,28(11):239-247.
[10] Hiroshi Hama,Hiroshi Kurokawa,Hiroyuki Kawano. Scale: A chamical approach for fluorescence imaging and reconstruction of transparent mouse brain[J].Nature neuroscience,2011,14(11):1481-8.
[11] Costantini I, Ghobril J P, Giovanna A P D,etal. A versatile clearing agent for multi-modal brain imaging[J]. Scientific Reports,2015(5): 9808.
[12] 段 妍,关苑君,蓝秀健,等.Zeiss LSM710激光扫描共聚焦显微镜的使用和管理[J].实验室研究与探索,2012,31(8):228-230.
[13] 赵莉敏,杜兰平,高宇翔,等.人脐动脉内皮细胞和平滑肌细胞体外培养鉴定及缝隙连接通讯功能测定[J].心肺血管病杂志,2013,23(4):503-506.
[14] Fan J Y. Splitm Cherry as a new red bimolecular fluorescence complementation system for visualizing protein-protein interactions in living cells[J]. Biochem Biophys Res Commun, 2008,367:47-53.
[15] Helms Volkhard. Fluorescence resonance energy transfer. Principles of computational cell biology[M]. Wiley-VCH,2008:202.
[16] Morell M. Monitoring the interference of protein-protein interactions in vivo by bimolecular fluorescence complementation: the DnaK case[J]. Proteomics,2008(8):3433-3442.
Application and Administration of Laser Scanning Confocal Microscopy Zeiss LSM 7DUO NLO
XUJialing,WANGXiaohong,LUOJianwen,LONGZhao,CHENYunfeng,ZHANGYishun
(School of Life Science, Sun Yat-Sen University, Guangzhou 510275, China)
This paper introduces the components and biological applications of the confocal laser scanning microscopy Zeiss LSM 7DUO NLO. Because of three difference kinds of scanning pattern, we have the flexibility of choice in using the microcopy. For example, they are multichannel fluorescence image acquisition overlays with one photon and two-photon images, Multiple view mosaic scanning with huge sample,3D reconstruction, and so on. This paper also introduces the administration and maintenance of the confocal laser scanning microscopy Zeiss LSM 7DUO NLO.
laser scanning microscopy; two-photon; image acquisition
2016-10-15
广东省自然科学基金项目(2014A030313376);广州市科技计划项目(201510010270);中山大学实验教学研究(改革)项目(201650,201658)
许佳玲(1986-),女,广东潮州人,硕士,助理实验师,主要从事激光扫描共聚焦显微镜等大型光学仪器的应用和管理。
Tel.:020-84113685; E-mail:jasxu@foxmail.com
张以顺(1966-),男,贵州毕节人,博士,正高级工程师,实验教学中心副主任,主要从事本科教学实验建设与管理、大型设备共享平台建设与管理工作。
Tel.:020-84110797; E-mail:lsszys@sysu.edu.cn
Q 334
A
1006-7167(2017)06-0281-05

