罗红霉素纳米脂质体包封率的测定
曾朝晖++林明越


[摘要] 目的 建立羅红霉素纳米脂质载体包封率测定的高效液相色谱法。 方法 色谱条件:Diamonsil-C18柱(200mm×4.6mm,5μm);柱温30℃;流动相:0.067mol/L磷酸二氢铵水溶液(三乙胺调PH为7.5)-乙腈(3∶2);检测波长205nm;体积流量1.0mL/min;进样量20μL。对该色谱条件下测定罗红霉素的方法学进行考察,建立超滤离心法测定罗红霉素纳米脂质载体的包封率。 结果 在此色谱条件下罗红霉素与辅料及溶剂峰均得到良好分离,罗红霉素在50.00~1000μg/mL浓度范围内线性关系良好(r=0.9995,n=7),超滤离心法测得罗红霉素纳米脂质载体的包封率为(88.7±0.2)%。 结论 该方法准确可靠、简单快速,可用于罗红霉素纳米脂质载体包封率的测定。
[关键词] 罗红霉素;包封率;高效液相色谱法;超滤离心法
[中图分类号] R283 [文献标识码] A [文章编号] 2095-0616(2017)07-31-04
Determination of entrapment efficiency of roxithromycin nano-liposomes
ZENG Zhaohui1 LIN Mingyue2
1.Department of Pharmacy,Foshan Nanhai District Eighth People's Hospital,Foshan 528216,China;2.Pharmaceutical Preparation Center,Foshan Hospital of TCM,Foshan 528200,China
[Abstract] Objective To establish high performance liquid chromatography(HPLC)method for determination of entrapment efficiency of roxithromycin nano-liposomes. Methods Chromatographic conditions:diamonsil-C18 column(200mm×4.6mm,5μm);column temperature 30℃;mobile phase:0.067mol/L ammonium dihydrogen phosphate solution(adjusting pH to 3.0 with triethylamine)-acetonitrile(3:2);detection wavelength 205nm;volume flow rate 1.0mL/min;injection volume 20μL.The method for determination of roxithromycin in the chromatographic conditions was investigated and centrifugal ultrafiltration method was established to determine entrapment efficiency of roxithromycin nano-liposomes. Results In this chromatographic condition,roxithromycin,excipient and solvent peaks were all well separated. Roxithromycin in the concentration range of 50.00-1000μg/mL had a good linear relationship(r=0.9995,n=7).Entrapment efficiency of roxithromycin nano-liposomes determined by centrifugal ultrafiltration method was(88.7±0.2)%. Conclusion The method is accurate,reliable,simple and quick.It can be used for determination of entrapment efficiency of roxithromycin nano-liposomes.
[Key words] Roxithromycin;Entrapment efficiency;High performance liquid chromatography;Centrifugal ultrafiltration method
罗红霉素是新一代的抗生素,其主要结构是大环内酯类,通过药理实验发现其主要活性表现在对于革兰氏阳性菌、衣原体、厌氧菌等的抑制上[1-2]。根据最新研究进展,对于大环内酯类的抗生素的含量测定的方法主要包括高效液相色谱法和生物法。而作为生物法,由于它的周期比较长、操作不够简便等因素从而被高效液相色谱法所逐渐所替代。而紫外分光光度法的测定主要缺点是其紫外吸收不强,只有在紫外的210nm末端处有一些吸收,而在该波长下,大多数的溶剂都有一定的吸收,对实验结果的干扰比较大[3-7]。
由于罗红霉素具有一定的毒副作用,包括了一些过敏反应以及神经毒性等,这些毒副作用严重影响了罗红霉素的广泛使用[8]。本研究采用一种全新的方法制备了罗红霉素纳米脂质体(NLC),该脂质载体能显著的提高其在水中的溶解度,达到延长药物在体内作用时间的目的,有效改善药物的吸收,分布,代谢以及排泄,从而有效的提高了罗红霉素的治疗效果,与此同时,也能有效降低药物的毒副作用[9-10]。本研究对罗红霉素纳米脂质体的分离通过超速离心的方法,同时,采用HPLC法测定纳米脂质载体中的含量,现报道如下。
1 仪器与试药
Zetasizer激光粒度测定仪(英国Malvern 公司);Eppendorf 5810R高速冷冻离心机(北京博仪恒业科技发展有限公司);DF-101S恒温磁力搅拌器(巩义市予华仪器);FA2004N电子天平(上海精密科学仪器);PH仪(上海谷雨环保科技有限公司);超滤离心管(MW30000)(美国Milipore公司);透析袋(截留分子量14000Da)(上海绿鸟科技发展有限公司);Waters2695高效液相色谱仪(美国沃特斯公司);Diamonsil C18色谱柱(迪马科技有限公司);罗红霉素(批号130405)成都普思生物科技有限公司;甲醇、乙腈均为色谱纯购自德国默克;无水乙醇、三乙胺、磷酸二氢铵、2%磷钨酸均购自天津市福晨化学试剂厂。
2 方法与结果
2.1 罗红霉素纳米脂质载体的制备
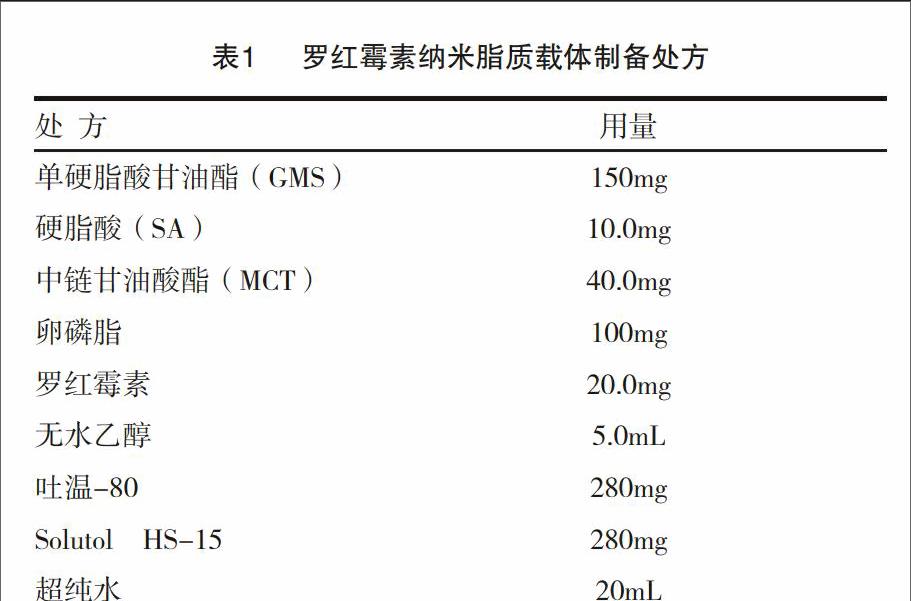
2.1.1 罗红霉素纳米脂质载体的处方 根据预实验结果筛选罗红霉素纳米脂质载体的处方,得出最优处方见表1。
2.1.2 红霉素纳米脂质载体的制备 根据筛选处方,采用高温乳化低温固化法,依处方量精密称取罗红霉素、GMS、SA、MCT、卵磷脂作为油相;取吐温-80、HS-15作为水相。将有机相在800r/min搅拌下缓慢加入水相中,70℃条件下,将有机溶剂尽可能挥发,2h后,半透明乳液倒入40mL冰水中,置于冰浴下搅拌,1h后得罗红霉素NLC混悬液。
2.2 HPLC测定罗红霉素NLC包封率方法的建立
2.2.1 色谱条件和系统适用性试验 选择迪马-C18柱(200mm×4.6mm,5μm)为固定相,流动相为0.067mol/L磷酸二氢铵水溶液(三乙胺调PH为7.5)-乙腈(60∶40),柱温30℃,检测波长205nm,体积流量1.0mL/min,进样量20μL。结果表明各项测试数据均符合方法学要求,从图谱可看出药物与杂质峰分离明显,见表2和图1。
2.2.2 标准曲线的建立 精密量取罗红霉素50.0mg置于50mL容量瓶中,加流动相定容至刻度,配成50.00~1000μg/mL一系列浓度的罗红霉素溶液。在205nm波长处进行HPLC测定。以峰面积(Y)为纵坐标和浓度(X)为横坐标进行线性回归,绘制罗红霉素标准曲线得标准曲线方程为:Y=3254.3X-26198,r=0.9995。结果表明在50.00~1000μg/mL范围内罗红霉素的线性关系良好。见图2。
2.2.3 专属性实验 (1)对照品溶液的制备:将罗红霉素对照品储备液10mL置于10mL容量瓶中,得到浓度为1000μg/mL的对照品溶液。(2)供试品溶液的制备:将罗红霉素纳米脂质载体溶液1.0mL置于10mL的容量瓶中,破乳,超声10min,流动相定容;3000r/min离心10min,取上清液经0.22μm滤膜过滤后即得。(3)空白纳米脂质载体溶液的制备 将空白纳米脂质载体溶液1.0mL,照“2.2.3.2”项下方法,即得。将上述三种溶液进行HPLC分析,判断辅料对药物含量测定的影响,色谱图见图3。
2.2.4 精密度实验 精密配制低、中、高3种浓度(50.00、600.0、1000μg/mL)的罗红霉素对照品溶液,在“2.2.1”条件下进样,1d内重复测定3次,连续测定3d,得到峰面积,并计算其RSD值。日内RSD分别为1.4%、0.6%、0.1%,日间RSD分别为1.9%、1.2%、0.5%。日间和日内的精密度均小于2.0%。结果表明该方法具有较好的精密度。
2.2.5 重复性实验 将所制备的样品,按照“2.2.3.2”项下制备3份供试品溶液,在“2.2.1”条件下分别进样,记录峰面积,得出RSD值,结果罗红霉素浓度为401.2μg/mL,其RSD为1.7%。表明该方法重复性良好。见表3。
2.2.6 稳定性试验 精密吸取“2.2.3.2”项下的罗紅霉素NLC供试品溶液,分别在0、4、8、12、24h进样测定,测得其RSD为1.0%,小于2.0%。表明罗红霉素纳米脂质载体供试品在24h内具有较好的稳定性。
2.2.7 回收率实验 精密称取罗红霉素对照品适量,加入空白纳米脂质载体适量配成浓度为500.0、6000、10000μg/mL的溶液,各三份,精密量取上述各溶液1.0mL,加无水乙醇1.0mL破乳。超声10min用流动相定容,分别配成浓度为50.00、600.0、1000μg/mL的供试液,3000r/min离心10min,上清液经0.22μm滤膜过滤后取续滤液20μL进样测定。结果显示低、中、高3种浓度的平均回收率分别为98.4%、99.6%、99.7%;RSD分别为1.9%、0.7%、0.2%。结果表明回收率实验中,罗红霉素与空白纳米脂质载体不发生吸附作用。对包封率测定基本没影响,此法符合要求。
2.3 罗红霉素纳米脂质载体包封率的测定
2.3.1 罗红霉素膜透过率试验
2.3.1.1 低温超滤离心温度的选择 采用低温超滤法测定包封率,采取单因素考察,改变不同温度,考察温度的不同对超滤离心的影响,结果显示温度在4℃左右离心效果最好。
2.3.1.2 低温超滤离心转速的选择 采用低温超滤法测定包封率,改变不同转速,考察转速的不同对超滤离心的影响,结果显示转速在8000r/min左右离心效果最好。
2.3.1.3 低温超滤离心离心时间的选择 采用低温超滤法测定包封率,改变不同离心时间,考察时间的不同对超滤离心的影响,结果显示超滤时间在20min左右离心效果最好。
2.3.1.4 罗红霉素膜透过率测定 取低、中、高(50.00、600.0、1000μg/mL)3种浓度的对照品溶液,量取各溶液500μL置于离心超滤管(截留相对分子量为30K)中,8000r/min离心30min,超滤液过滤后进样,采用HPLC测定含量,结果显示低、中、高3种浓度的平均透过率分别为98.5%、99.5%、99.6%;RSD分别为0.7%、0.4%、0.3%。表明罗红霉素的浓度对其膜透过率无明显影响。
2.3.2 超滤回收率 取适量对照品溶液,加入适量的空白纳米脂质载体配成浓度为50.00、600.0、1000μg/mL的溶液各3份。精密量取各溶液500μL置于离心超滤管(截留相对分子量为30K)中,8000r/min离心30min,超滤液过滤后进样,采用HPLC测定含量,结果显示低、中、高3种浓度的平均回收率分别为96.9%、98.9%、99.4%;RSD分别为1.9%、0.4%、0.2%。表明实验中,空白纳米脂质载体对包封率的测定没影响。
2.3.3 包封率的测定 取纳米脂质载体乳液500μL置于离心超滤管中,8000r/min离心30min,然后取超滤液过滤后进样,采用HPLC法测定,得游离的罗红霉素含量,即W游;另取纳米脂质载体乳液1.0mL,破乳,超声,流动相定容至10mL,离心10min,上清液过滤后进样测定得W测。按2015版
中国药典[11]计算脂质体包封率的公式进行计算,包封率=(W总-W游)/W总×100%;W总=W测×10/2,为总投入药量,W游为未包入脂质体的游离药量。对其进行包封率的测定,结果表明罗红霉素纳米脂质载体的包封率符合要求,见表4。
3 讨论
对于纳米脂质体中的游离药物的分离方法有很多报道,主要包括了凝胶过滤法[12]、微型柱离心法[13]、透析法、冷冻超速离心法、低温超滤离心法等[14-15]。而综合分析这些方法,超滤法具备了操作简单、分离快速等优势,所以受到研究者们越来越多的重视[16]。
在预实验中,研究者们试图采用超速离心法,但得到的样品包封率均低于20%。分析失败的可能原因為超速离心法的原理,而本研究所采用的主要材料相对密度均较小,因此导致在实验中悬浮液中有大量的载药纳米粒没有完全沉淀,导致测定结果不符合要求。
所以本研究选用超滤法对罗红霉素纳米脂质体的包封率进行测定,同时对其进行了方法学的初步考察,表明本方法符合测定要求。
[参考文献]
[1] 杨德智,徐维盛,张丽,等.优化《中国药典》罗红霉素HPLC含量测定方法研究[J].中国药房,2011,22(17):1604-1606.
[2] M arkhamA,Fau idsD.Roxithromyciny:an update of its antimicrobial activity,pharmacaok in etic propert iesand therapeutic use[J].Drugs,1994,48(2):297.
[3] 张玉英.罗红霉素的药理与临床[J].中国医院药学杂志,2001,21(2):103-104.
[4] 于慧娟,蔡友琼,顾润润.高效液相色谱法测定红霉素、甲红霉素和罗红霉素的研究[J].分析试验室,2006,25(6):63-66.
[5] 傅得兴,谢荣瑞.罗红霉素的药理及临床应用[J].中国新药杂志,1992(5):15-17.
[6] 秦永平,黄英,梁茂植,等.血清中罗红霉素的反相高效液相色谱法测定[J].药物分析杂志,1997(4):249-252.
[7] 王建华.罗红霉素与阿奇霉素不良反应的对比研究[J].中国保健营养,2016,26(18):210.
[8] Ruan G,Feng SS.Preparation and characterization of poly(lactic acid)-poly(ethylene glycol)-poly(lactic acid)(PLAPEG-PLA)microspheres for controlled release of paclitaxel[J].Biomaterials,2003,24(27):5037-5044.
[9] S.K. Han,K.Na,B.Y.H.Sulfonamide based pH-sensitive polymeric micelles:physicochemical character-istics and pH-dependent aggregation[J].Colloids Surf,A Physicochem,2003,214:49-59.
[10] Souto EB,Wissing SA,Barbosa CM,et al.Development of a controlled release formulation based on SLN and NLC for topical clotrimazole delivery[J].Int J Pharm,2004,278:71-77.
[11] 国家药典委员会.中华人民共和国药典(二部) [S].2015年版.北京:中国医药科技出版社,2010:462.
[12] 雷国锋,陈琳,邓英杰,等.超滤法-HPLC法测定灯盏花素脂质体包封率[J].沈阳药科大学学报,2006,23(4):237-239.
[13] 耿思聪,龚昊宇,许航,等.微柱离心法测定克拉霉素离子对脂质体注射液的包封率[J].中国药剂学杂志:网络版,2016(1):18-25.
[14] 张自强,许玫,姚静,等.超滤法测定伊立替康脂质体包封率的研究[J].药物分析杂志,2008(12):2081-2084.
[15] 蔡晓瑶,张莉,任翔,等.离心法和透析法测定蟾皮提取物固体脂质纳米粒包封率的比较[J].国际药学研究杂志,2016,43(4):744-747.
[16] 陈锋,金日显,陈燕军.纳米结构脂质载体的研究进展[J].中国新药杂志,2008,17(6):456-460.
(收稿日期:2017-02-27)

