cis-[(trans-1,2-双(氨甲基)环丁烷) (3-羟基-1,1-环丁烷二羧酸根)合铂(Ⅱ)]的合成和抗癌活性
高安丽 邱洁 侯树谦 姜婧*, 楼丽广 刘伟平*,
(1昆明贵金属研究所,稀贵金属综合利用新技术国家重点实验室,昆明650106)
(2临沧市妇幼保健中心,临沧677000)
(3中国科学院上海药物研究所肿瘤药理研究室,上海201203)
cis-[(trans-1,2-双(氨甲基)环丁烷) (3-羟基-1,1-环丁烷二羧酸根)合铂(Ⅱ)]的合成和抗癌活性
高安丽1邱洁2侯树谦1姜婧*,1楼丽广3刘伟平*,1
(1昆明贵金属研究所,稀贵金属综合利用新技术国家重点实验室,昆明650106)
(2临沧市妇幼保健中心,临沧677000)
(3中国科学院上海药物研究所肿瘤药理研究室,上海201203)
通过对洛铂和卡铂的结构进行重组和优化,合成了一种新型洛铂衍生物cis-[(trans-1,2-双(氨甲基)环丁烷)(3-羟基-1,1-环丁烷二羧酸根)合铂],采用元素分析、红外光谱、质谱和核磁共振表征了其化学结构,并考察了此化合物的水溶性和稳定性。应用标准SRB法测试了目标化合物对人肺癌细胞株(NCI-H460、A549)、人乳腺癌细胞株(DU4475)、人白血病细胞株(Sup-B15)生长的抑制活性,评价了它对人肺癌细胞NCI-H460裸鼠移植瘤的治疗作用。结果表明:目标化合物水溶性好、稳定,对多种癌细胞的生长有明显的抑制活性,IC50均小于10 μmol·L-1。更重要的是,其体内对人肺癌细胞NCI-H460裸鼠移植瘤的治疗效果明显,与洛铂相当。
铂类配合物;合成;表征;抗癌活性
0 引言
铂类抗癌药物属于一类结构独特的无机配合物,目前已批准上市的有顺铂、卡铂、奥沙利铂、奈达铂、庚铂、洛铂(图1),是目前治疗常见恶性肿瘤(肺癌、胃癌、结肠癌、卵巢癌等)的一线药物,在临床上得到广泛使用,对改善癌症患者的生活质量、延长寿命起了重要的作用[1-4]。然而,与其他细胞毒性药物一样,存在两大缺陷:毒副反应和出现耐药性。铂类药物属于细胞毒类化合物,对癌细胞缺乏足够的选择性,在杀伤癌细胞的同时,对正常的组织细胞也产生不同程度的损伤作用,通常导致骨髓抑制、肾损伤、神经毒性、恶心呕吐,毒性反应成为肿瘤化疗时药物用量受限的关键因素,同时亦影响了患者的生命质量;在化疗过程中,癌细胞先天或后天对铂类药物不敏感、产生耐药性是化疗失败的重要原因,也是铂类药物化疗急需解决的难题。因此,发展疗效高、毒性小的新型铂类配合物是目前国际抗癌药领域研发的主要方向之一[5-7]。

图1 已上市的铂类抗癌药物Fig.1Platinum-based drugs currently in clinical use
在目前已批准上市的6种铂类抗癌药物中,洛铂为最新上市的第三代铂类药物,由德国Asta Medica AG公司开发,对乳腺癌、小细胞肺癌和白血病有显著的疗效,优于顺铂、卡铂和奥沙利铂,且对耐受顺铂/卡铂的癌细胞仍显效[8-9],2005年获得国家CFDA的上市批准。洛铂的主要毒性是骨髓抑制和消化道反应,同时,洛铂水溶液化学性质不稳定,临床上配制成注射液后要求4 h内使用完毕(存放温度2~8℃),给联合用药带来诸多的不方便[10-11]。因此,研制水溶性高且溶液化学性质稳定、疗效与洛铂相当、毒性不增加的洛铂衍生物具有重要的临床应用价值。
通过研究和试验,我们认为洛铂的水溶液不稳定性在于离去基团L-乳酸根。乳酸上的羟基配位能力相对较弱,与Pt的键合不稳定,易离解。而卡铂的离去基团1,1-环丁烷二羧酸是一个优良的配体,能与Pt稳定配位,从而赋予卡铂水溶液具有作为注射用药要求的足够稳定性。为此,我们尝试对洛铂和卡铂进行结构重组,既保留洛铂独特的载体基团,又引入卡铂稳定的离去基团,得到洛铂的一种稳定衍生物cis-[(trans-1,2-双(氨甲基)环丁烷)(1,1-环丁烷二羧酸根)合铂]。然而,这种衍生物水溶性差(小于1 mg·kg-1),明显不如洛铂(26 mg·mL-1)和卡铂(17.5 mg·mL-1),成药性差。因此,我们对它进一步结构优化,在离去基团上引入亲水性的羟基,获得一种稳定、水溶性好(15 mg·mL-1)、抗癌活性高的新型的洛铂衍生物cis-[(trans-1,2-双(氨甲基)环丁烷) (3-羟基-1,1-环丁烷二羧酸根)合铂](代号:LLC-1801)(图2)。本文将报道LLC-1801的合成、结构表征和抗癌活性。
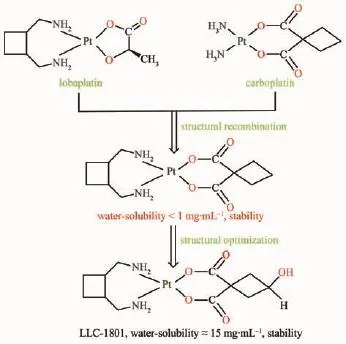
图2 LLC-1801的设计路线Fig.2Analoguing scheme for LLC-1801
1 实验部分
1.1 化学合成
1.1.1 试剂和仪器
Vario ELⅢ型元素分析仪(德国);金属铂的含量采用热重法测定,差热热重谱由STA449F3耐弛综合同步热分析仪(德国)测定;BRUKER Tensor-27傅立叶变换红外光谱仪(德国,KBr压片);Agilent G6230飞行时间质谱仪(日本);AutoSpec Premier高分辨磁质谱气质联用仪(美国);BRUKER DRX-500核磁共振仪(瑞士,TMS内标);DZG-6050型真空干燥箱(国产);所有试剂均为市售AR产品,实验用水为二次去离子水,22.6℃电阻率ρ≥3.7 MΩ·cm。
1.1.2 cis-[trans-1,2-双(氨甲基)环丁烷·二碘合铂]的制备
称取5 g(12 mmol)K2PtCl4溶于80 mL的蒸馏水中,称取12 g(72 mmol)KI溶于20 mL的蒸馏水中,将两溶液在35~40℃下避光混合,2 h后,在搅拌下滴加1.37 g(12 mmol)trans-1,2-双(氨甲基)环丁烷的水溶液(20 mL),析出棕黄色的沉淀,继续搅拌4 h,过滤收集,依次用蒸馏水和无水乙醇洗涤,在45℃下真空干燥,得到6.28 g棕黄色粉末状固体,产率为93%。元素分析按C6H14N2I2Pt计算(%):C 12.8,H 2.49,N 4.97,Pt 34.6;实测值(%):C 12.7,H 2.52,N 4.96,Pt 34.7。
1.1.3 3-羟基-1,1-环丁烷二羧酸银的制备
称取3 g(19 mmol)3-羟基-1,1-环丁烷二羧酸溶于50 mL的蒸馏水中,在室温下加入KHCO3(3.8 g,38 mmol)中和,然后滴加过量10%的AgNO3(7.1 g)水溶液(20 mL),析出白色沉淀,过滤收集,分别用水和无水乙醇洗涤,在45℃下真空干燥,得到6.8 g 3-羟基-1,1-环丁烷二羧酸银,产率为96%。
1.1.4 LLC-1801的合成
准确称取6.00 g(10.66 mmol)的cis-[trans-1,2-双(氨甲基)环丁烷·二碘合铂]溶于100 mL的蒸馏水中,加入3.95 g(10.56 mmol)3-羟基-1,1-环丁烷二羧酸银,在40~45℃下搅拌反应48 h后,用KI水溶液检查反应物中无游离的银离子存在,示意反应完毕。过滤除去所生成的AgI沉淀,母液冷冻干燥,得到近白色的产物,经体积比为1∶1的甲醇水溶液重结晶提纯后,在45℃下真空干燥6 h,获得3.7 g含1个结晶水的cis-[(trans-1,2-双(氨甲基)环丁烷) (3-羟基-1,1-环丁烷二羧酸)合铂]白色结晶,产率72%。再在105~120℃真空干燥8 h,失去1个结晶水,得到3.5 g cis-[(trans-1,2-双(氨甲基)环丁烷)(3-羟基-1,1-环丁烷二羧酸)合铂]白色结晶。1H NMR (DMSO-d6,500 MHz):δ 1.58~1.88(m,4H),2.24~2.37(m, 6H),2.63~3.08(m,4H),3.82(m,1H),4.26(m,1H),5.00~5.28(m,4H)。13C NMR(DMSO-d6,500 MHz):δ 22.3, 22.4,41.2,41.9,42.3,48.2,50.4,60.2,61.5,176.6,176.8。IR(KBr):3 426(s,νO-H),3 235,3 139(m,νN-H),2 941,2 875(m,νC-H),1 623(vs,νas(COO)),1 376(vs,νa(COO)),485 (w,νPt-N),449(w,νPt-O)cm-1。ESI-MS m/z:985([2M+Na+],30%),490([M+Na+],90%),468([M+H+],25%)。元素分析按C12H20N2O5Pt计算(%):C 30.8,H 4.28,N 5.99,Pt 41.8;实测值(%):C 30.5,H 4.30,N 5.98,Pt 41.4。HRMS-EI按C12H20N2O5Pt计算:467.102 0(194Pt),实测值:467.101 7。
1.2 LLC-1801配合物的水溶性和稳定性试验
采用常规方法测定室温下目标化合物在水中的溶解度。
LLC-1801的水溶液稳定性采用核磁共振谱的方法测定:取4 mg LLC-1801样品,溶于0.5 mL D2O中,室温放置,在不同时间点采用Bruker DRX-500核磁共振仪测定1H NMR,比较各个时间点测得的1H NMR与起始的1H NMR之间的差异。
1.3 LLC-1801配合物的生物活性试验
1.3.1 体外抗癌活性
RPMI-1640、F-12培养基购自Gibco BRL公司,胎牛血清购自SAFC公司,SPECTRA MAX 190型酶标仪购自Molecular Devices公司,SRB购自Sigma公司。人肺癌细胞株NCI-H460、人肺癌细胞株A549、人乳腺癌细胞株DU4475和人白血病细胞株Sup-B15均购自ATCC。
应用磺酰罗丹明B蛋白染色法(SRB法)检测目标化合物对癌细胞(NCI-H460、A549、DU4475和Sup-B15)增殖生长的抑制作用。主要步骤如下:接种对数生长期细胞于96孔培养板,加入不同浓度的药物,每个浓度设3个复孔,同时设相应浓度的溶媒对照。癌细胞在37℃、5%CO2条件下培养72h。细胞用SRB室温中染色,最后加入Tris溶液溶解,酶标仪于510 nm波长下测定OD值,以下列公式计算细胞生长抑制率:
Inhibitory rate=(ODcontrol-ODdosing)/ODcontrol×100%(1)
根据各浓度抑制率,采用非线性回归方法计算半数抑制浓度IC50。结果见表1。
1.3.2 体内抑瘤作用
BALB/cA-nude裸小鼠,6~7周,♀,购自上海西普尔-必凯实验动物有限责任公司,在SPF级环境下饲养。裸小鼠皮下接种人肺癌NCI-H460细胞,待肿瘤生长至80~160 mm3后,将动物随机分组(D0)。测试的化合物和对照药品洛铂均用5%葡萄糖溶液配制,腹腔注射给药,给药剂量和给药方案见表2。每周测2~3次瘤体积,称鼠重,记录数据。
肿瘤体积V和相对肿瘤增值率T/C的计算公式为:

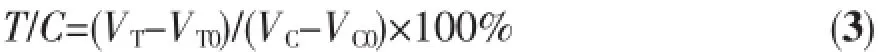
其中a、b分别表示肿瘤的长、宽;VT、VC分别表示实验结束时治疗组、对照组的肿瘤体积;VT0、VC0分别表示实验开始时治疗组、对照组的肿瘤体积。
2 结果与讨论
2.1 LLC-1801的合成
cis-[(trans-1,2-双(氨甲基)环丁烷)(3-羟基-1,1-环丁烷二羧酸根)合铂]是以trans-1,2-双(氨甲基)环丁烷为载体基团、3-羟基-1,1-环丁烷二羧酸为离去基团的铂配合物。其中,trans-1,2-双(氨甲基)环丁烷购自海南长安国际制药有限公司,而3-羟基-1,1-环丁烷二羧酸则按我们已报道的方法进行制备[12-13]。目标化合物的合成采用经典的路线进行[14],即以K2PtCl4为起始原料,加入过量KI,转化成K2PtI4后,与trans-1,2-双(氨甲基)环丁烷反应,制备出相应的cis-[trans-1,2-双(氨甲基)环丁烷·二碘合铂],二碘中间体再与等物质的量的3-羟基-1,1-环丁烷二羧酸银反应,反应完全后过滤分离AgI,母液冷冻干燥得到粗品,粗品经体积比为1∶1的水/甲醇混合液重结晶得到纯品,产率约68%,合成路线如图3所示。LLC-1801为纯白色晶状粉末,室温下,在水中的溶解度约为15 mg·mL-1,与卡铂相当(17.5 mg·mL-1),小于洛铂(26 mg·mL-1),已满足临床注射用药的要求。采用核磁共振谱方法[15-16]测得LLC-1801在水溶液中能够稳定至少72 h,与卡铂相当,明显高于洛铂,提示LLC-1801具有很好稳定性和相当的水溶性。
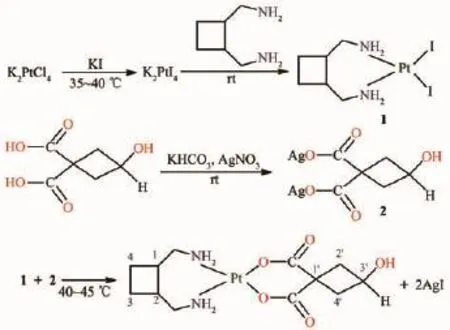
图3 LLC-1801的合成路线Fig.3Synthetic route of LLC-1801
2.2 LLC-1801的结构表征
采用元素分析、红外光谱、质谱和核磁共振谱测定(谱图见Supporting Information)和解析目标化合物的化学结构。元素分析实验数据与理论计算值非常接近,符合C12H20N2O5Pt的量式。在ESI-MS上,出现985(RI 30%)、490(RI 90%)、468(RI 25%)峰,可分别归属于2M+Na+、M+Na+、M+H+,示意分子量为467,高分辨质谱测定精确分子量为467.102 0,与C12H20N2O5Pt的计算分子量(467.101 7)一致。从主要红外光谱数据可以看出,3 426 cm-1附近出现的宽而强的吸收峰,归属于O-H键伸缩振动;3 235和3 139 cm-1附近的峰认为是N-H键伸缩振动峰;2 941和2 875 cm-1附近吸收峰是C-H键伸缩振动峰;1 623和1 376 cm-1两处非常强的吸收峰,为羧基的特征吸收峰,分别归属于羧基反对称和对称伸缩振动;此外,在485和449 cm-1处分别出现典型的Pt-N键、Pt-O键伸缩振动吸收峰,确认了配合物中Pt-N键、Pt-O键的存在。
LLC-1801的1H和13C NMR谱与其结构相对应。1H NMR谱中,δ 1.60,1.88处峰归属于载体基团环丁基环上2个亚甲基的氢;δ 2.24~2.38之间的多重峰为载体基团环丁基环上2个次甲基氢和离去基团环丁基环上2个亚甲基氢的共振峰;δ 2.63~3.08之间3个峰,积分面积之比约为2∶1∶1,应该是与氨基相连的2个亚甲基上氢的共振峰;δ 3.82处共振峰为与羟基相连的次甲基上的氢,δ 4.26处峰归属于羟基氢,δ 5.00~5.28之间的峰则归属为2个氨基上的氢。在离去基团3-羟基-1,1-环丁烷二羧酸根3′位点碳上引入羟基后,导致CH2的氢发生分裂,与文献报道[17-19]的结果一致,原因是羟基的引入使得CH2上的2个氢相对羟基位置有不同的空间指向[20]。13C NMR谱图中,δ 22.3,22.4处共振峰归属于载体基团环丁基环上2个亚甲基的碳;δ 41.2处峰为载体基团环丁基环上2个次甲基碳的共振峰;δ 41.9,42.3处归属于离去基团环丁基环上2个亚甲基的碳;δ 48.2处峰为与2个羧基相连的季碳的峰;δ 50.4处共振峰则为与羟基相连的次甲基碳的峰;δ 60.2,61.5处峰归属于与氨基相连的2个亚甲基的碳;δ 176.6,176.8处峰是2个羧基碳的共振峰。
综上结构测试和解析的结果,采用本合成方法获得的化合物为本论文的目标化合物LLC-1801。
2.3 LLC-1801配合物的抗癌活性评价
2.3.1 体外抗癌活性
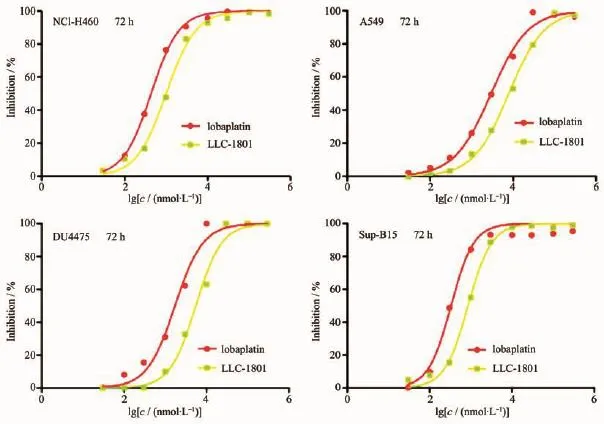
图4 LLC-1801抑制癌细胞增殖抑制的量-效曲线Fig.4Dose-response curves of the inhibitory effect of the LLC-1801 on cancer cells
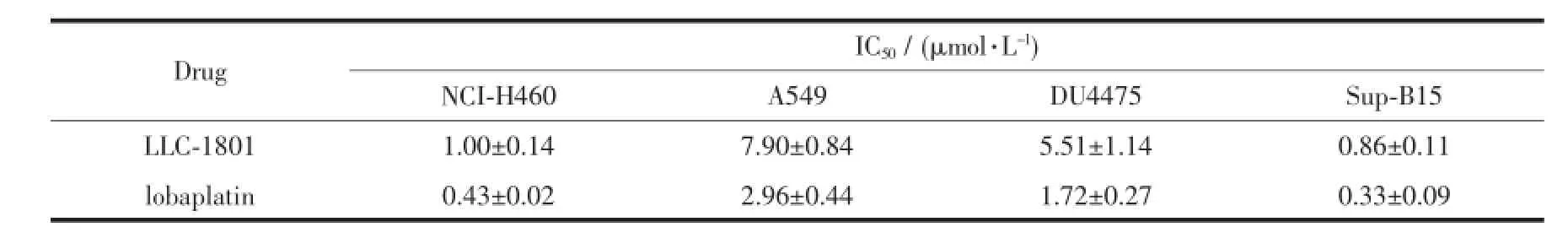
表1 目标化合物的体外抗癌活性Table 1In Vitro anticancer activity of the target compound
根据洛铂的临床适应症,选择2株肺癌细胞株(NCI-H460、A549)、1株乳腺癌细胞株(DU4475)、1株白血病细胞株(Sup-B15)为细胞模型,采用标准的SRB法测定目标化合物LLC-1801对癌细胞增殖的抑制作用,从浓度-抑制率曲线(见图4)计算半数抑制浓度IC50,结果见表1。从图表可知,LLC-1801对选定的4株癌细胞的增殖均有很高的抑制活性,IC50均小于10 μmol·L-1,并显示出较好的量效关系。但是,与洛铂比较,目标化合物的体外抗癌活性低于洛铂。
2.3.2 体内抑瘤作用
基于目标化合物体外抗癌活性的测试结果,我们以人肺癌NCI-H460裸小鼠皮下移植瘤为模型,腹腔给药评价LLC-1801抑制肿瘤生长的效应,测定结果见表2。LLC-1801(30、60 mg·kg-1,IP,Q4D×3)剂量依赖性地抑制人肺癌NCI-H460裸小鼠皮下移植瘤的生长,抑瘤率分别为31%和54%;参比药物洛铂的剂量选择7.5 mg·kg-1,为动物试验常用的有效剂量,对NCI-H460的抑瘤率为43%;从给药后小鼠体重变化来看,LLC-1801和洛铂对小鼠的生长影响不大,小鼠均能很好耐受,示意在给药的剂量下毒性较小。综合抑瘤率和体重变化来看,LLC-1801和洛铂体内对人非小细胞肺癌的疗效是相当的。
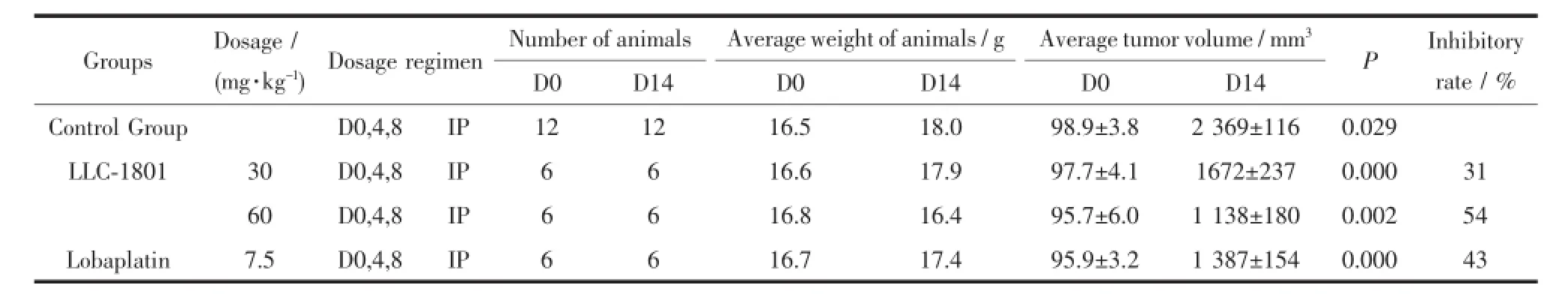
表2 目标化合物对人肺癌NCI-H460裸小鼠皮下移植瘤的抑制作用Table 2Inhibitory effect of the target compound on NCI-H460 xenograft in nude mice
3 结论
设计和合成了一种水溶性好、溶液性质稳定的洛铂衍生物cis-[(trans-1,2-双(氨甲基)环丁烷)(3-羟基-1,1-环丁烷二羧酸根)合铂],采用现代分析测试手段表征了其化学结构。生物学评价试验表明:与洛铂比较,虽然体外抗癌活性不如洛铂,但其对人肺癌NCI-H460裸小鼠皮下移植瘤的治疗效果与洛铂相当,有较好的疗效。基于目标化合物还具有稳定的水溶性性质优势,我们认为它具有进一步研究的价值。
Supporting information is available at http://www.wjhxxb.cn
[1]Kelland L.Nat.Rev.Cancer,2007,7(8):573-584
[2]Jakupec M A,Galanski M,Keppler B K.Rev.Physiol. Biochem.Pharmacol.,2003,146:1-54
[3]Nial J W,Shonagh W,Gemma E C,et al.J.Chem.Soc., Dalton Trans.,2010,39(35):8113-8127
[4]Wang X.Anti-Cancer Agent Med.Chem.,2010,10(5):396-411
[5]Han X P,Sun J,Wang Y J,et al.Med.Res.Rev.,2015,35 (6):1268-1299
[6]Chen X,Wu Y,Dong H,et al.Curr.Mol.Med.,2013,13 (10):1603-1612
[7]Wang X Y,Guo Z J.Chem.Soc.Rev.,2013,42(1):202-224
[8]Voegeli R,Schumacher W,Engel J,et al.J.Cancer Res. Clin.Oncol.,1990,116(5):439-442
[9]McKeage M J.Expert Opin.Invest.Drugs,2001,10(1):119-128
[10]Guchelaar H J,Uges D R,Aulenbacher P,et al.Pharmacol. Res.,1992,9(6):808-811
[11]OUYANG Dan-Wei(欧阳丹薇),SHAO Yan(邵燕),KONG De-Yun(孔德云),et al.Chin.J.Pharm.(中国医药工业杂志),2015,46(2):119-203
[12]Liu W P,Chen X Z,Ye Q S,et al.Inorg.Chem.,2011,50 (12):5324-5326
[13]Liu W P,Jiang J,Xie C Y,et al.J.Inorg.Biochem.,2014, 140:126-130
[14]Wilson J J,Lippard S J.Chem.Rev.,2014,114(8):4470-4495
[15]Liu W P,Ye Q S,Jiang J,et al.ChemMedChem,2013,8(9): 1465-1467
[16]Jiang J,Lei J,Chen X Z,et al.Res.Chem.Intermed.,2015, 41:6149-6155
[17]Zhao J,Gou S H,Sun Y Y,et al.Chem.Eur.J.,2012,18 (45):14276-14281
[18]Zhao J,Gou S H,Sun Y Y,et al.Inorg.Chem.,2012,51 (19):10317-10324
[19]Xie M J,Liu W P,Lou L G,et al.Inorg.Chem.,2010,49 (13):5792-5794
[20]Liu W P,Chen X Z,Ye Q S,et al.Platinum Met.Rev., 2012,56(4):248-256
Synthesis and Anticancer Activity of cis-[Pt(trans-1,2-bis(methylamino)cyclobutane) (3-hydroxyl-1,1-cyclobutanedicarboxylate)]
GAO An-Li1QIU Jie2HOU Shu-Qian1JIANG Jing*,1LOU Li-Guang3LIU Wei-Ping*,1
(1Platinum-Based Drug Lab,Kunming Institute of Precious Metals,Kunming 650106,China)
(2Lincang Maternal and Child Health Care Hospital,Lincang,Yunnan 677000,China)
(3Tumor PharmacologyLab,Shanghai Institute of Materia Medica,Chinese Academy of Sciences,Shanghai 201203,China)
A new water-soluble and more water-stable analogue of lobaplatin,cis-[Pt(trans-1,2-bis(methylamino) cyclobutane)(3-hydroxyl-1,1-cyclobutanedicarboxylate)],was designed,with an attempt to improve the water-stability of lobaplatin while retaining its excellent anticancer profile,via the structural recombination and optimization of lobaplatin and carboplatin.The analogue was synthesized by the direct reaction between cis-[Pt(trans-1,2-bis (methylamino))I2]as an intermediate and the silver salt of 3-hydroxyl-1,1-cyclobutanedicarboxylic acid,and characterized by elemental analysis,ESI-MS,IR and1H,13C NMR.The anticancer activity was evaluated by both in vitro cyotoxicity against four human cancer cell lines and in vivo antitumor efficiency in human lung carcinoma NCI-H460 xenografts in nude mice.The biological tests revealed that the analogue produced significant inhibition of the tumor growth,resulting in an inhibitory rate of 54%at the dose of 60 mg·kg-1and more importantly,it had in vivo anticancer activity comparable to that of lobaplatin.
platinum complexes;synthesis;characterization;anticancer activity
O614.82+6
A
1001-4861(2017)05-0837-06
10.11862/CJIC.2017.096
2016-12-01。收修改稿日期:2017-03-14。
国家自然科学基金(NO.21661018)和云南省科技计划项目(No.2014BC010,2016BC021)资助。
*通信联系人。E-mail:dianaair@126.com,liuweiping1963@126.com
- 无机化学学报的其它文章
- 火焰辅助热解方法制备Ag2O/TiO2及其光催化制氢性能
- Tm3+/Er3+/Ho3+共掺SiO2-Bi2O3-AlF3-BaF2玻璃发光性能
- 一种三足四齿Schiff碱的Cu(Ⅱ)、Co(Ⅲ)配合物的合成、晶体结构与表征
- Syntheses, Crystal Structures and Insulin-like Activity of Maltolato- and Ethylmaltolato-Coordinated Oxovanadium(Ⅴ) Complexes Derived from 4-Fluoro-N′-(3-ethoxy-2-hydroxybenzylidene)benzohydrazide
- Electrochemically Self-Assembled Fe/Cu Nanocomposite with Improved High-Rate and Low-Temperature Performances for Nickel-Iron Alkaline Battery
- 碳化硅衍生碳的制备及其超级电容性能

