细叶云南松幼苗对不同光照条件的生理响应
黄则月,曾庆尖,赵毅辉,贲 园,杨 梅*
(1.广西大学 林学院,广西 南宁 530004; 2.广西雅长林场,广西 百色533209)
细叶云南松幼苗对不同光照条件的生理响应
黄则月1,曾庆尖2,赵毅辉1,贲 园2,杨 梅1*
(1.广西大学 林学院,广西 南宁 530004; 2.广西雅长林场,广西 百色533209)
为了研究细叶云南松幼苗对不同光照强度的生理响应,以1月生和1年生细叶云南松幼苗为研究对象,采用人工模拟不同光照条件(100%、50.3%、15.0%、4.2%全光照)的方法,对其在不同光照条件下的叶绿素含量、可溶性蛋白含量、丙二醛(MDA)含量、超氧化物歧化酶(SOD)等抗氧化酶活性进行研究。结果表明:随着光照强度的减弱,1月生幼苗叶绿素a、b和总叶绿素含量先上升后下降;可溶性蛋白含量在50.3%全光照时最高;SOD、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)活性以及MDA含量均呈上升趋势,15.0%全光照时达到最大值。随着光照强度的减弱,1年生幼苗叶绿素a、b和总叶绿素含量持续上升;可溶性蛋白含量逐渐下降;SOD活性先上升后下降,15.0%全光照时活性最强;APX、CAT活性以及MDA含量均呈上升趋势,15.0%全光照时达到峰值。1月生和1年生幼苗的POD活性均在50.3%全光照下最大。综合分析得出,50.3%全光照有利于细叶云南松幼苗生理代谢活动的提高,此时,1月生和1年生幼苗的叶绿素和可溶性蛋白含量较高,MDA含量和SOD、CAT等抗氧化酶活性均保持低水平。因此,细叶云南松幼龄时期培育中应适当遮荫。
细叶云南松; 光照环境; 叶绿素; 可溶性蛋白; 抗氧化酶; 生理响应
细叶云南松(Pinusyunnanensisvar.)是云南松的一个变种,具有耐干旱、耐火、生长快、天然更新能力强等特性。细叶云南松出材率高、材质优良、结构细腻,有一定抗病虫害能力,是我国西南省区主要的用材树种,也是一种重要的南方材脂两用树种[1-2]。目前,对于细叶云南松的研究主要集中于地理分布与环境的关系、遗传多样性、天然林生长规律、松针挥发油的化学成分等方面[1-8]。光是影响植物生长发育的重要环境因子,对植物的生长、发育有重要作用。不同的光照环境对植物的生理生化特性和形态结构都有不同影响,进而影响植物的生长发育[9-10]。目前,有关细叶云南松对光强的需求和适应性研究较少。陈诗等[11]认为,云南松苗木对光照条件都有着一定的忍耐限度或范围,超出这个限度或范围则会对植物的生长有抑制作用,同时建议在云南松幼苗培育过程中,应给予适当遮荫以利于苗木生长。在前人研究的基础上,以1月生和1年生细叶云南松幼苗为研究对象,研究其在不同光照强度下叶绿素含量、可溶性蛋白含量、丙二醛(MDA)含量、超氧化物歧化酶(SOD)等抗氧化酶活性的变化规律,探讨细叶云南松幼苗对不同光照的生理响应,为不同苗龄的细叶云南松苗木人工栽培提供理论依据。
1 材料和方法
1.1 试验材料和试验地概况
选取广西国有雅长林场提供的生长良好、长势基本一致的1月生和1年生实生细叶云南松幼苗,移栽至黄心土、沙子(体积比为5∶1)混合成的育苗基质中适应15 d后进行试验处理。
试验在广西大学林学院苗圃基地(108°22′E,22°48′N)进行,历时4个月(2013年12月初至2014年3月底)。该地处于亚热带,是典型的亚热带季风气候。全年最低气温-2.4 ℃,最高气温40.4 ℃。
1.2 试验方法
搭建不同密度遮荫网以控制光照,光照条件共设置4个处理,分别为全光照(100%NS)、50.3%全光照(50.3%NS)、15.0%全光照(15.0%NS)、4.2%全光照(4.2%NS)。每个处理重复3次,每个重复10株。试验期间每天苗床自动淋水,定时每2 h喷雾3 min;每7 d浇灌20 g/L普通复合肥营养液。试验结束后测定各项生理指标。
1.2.1 生理生化指标的测定 选出各处理5株长势基本一致的植株,采集植株上部当年新生成熟健壮叶片为样本,各叶片在植株的部分基本一致,进行生理生化指标的测定。叶绿素含量采用分光光度法测定[12];可溶性蛋白含量采用考马斯亮蓝G-250法测定[13];MDA含量采用硫代巴比妥酸法测定[14];SOD活性采用NBT法测定[15];过氧化氢酶(CAT)活性采用紫外分光法测定[16];过氧化物酶(POD)活性采用愈创木酚法测定;抗坏血酸过氧化物酶(APX)活性采用紫外吸收法测定[17-19]。
1.2.2 数据处理 采用Excel、SPSS 20.0等对所得数据进行整理、方差分析及多重比较(LSD最小差异显著法)。
2 结果与分析
2.1 细叶云南松幼苗针叶叶绿素含量变化
随着光照强度的减弱,1月生幼苗的叶绿素a、b和叶绿素总量均明显地呈先升后降的趋势,15.0%NS处理时达到最大,叶绿素a、b和叶绿素总量比最小值(100%NS处理)分别高出0.29、0.63、0.92 mg/g(图1)。1年生幼苗随光照强度的减弱逐渐增加,叶绿素a、b及叶绿素总量均在4.2%NS处理时显著或极显著高于其他处理(图2)。在4.2%NS处理时,1月生幼苗的叶绿素a、b和叶绿素总量极显著下降(P<0.01),而1年生幼苗极显著或显著上升。
2.2 细叶云南松幼苗针叶可溶性蛋白含量变化
由图3可知,随着光照强度的减弱,1月生幼苗可溶性蛋白含量呈先增加后急速下降的趋势,在50.3%NS处理时显著增加,达到最大值(48.0 mg/g)。1年生幼苗可溶性蛋白含量随光照强度减弱逐渐下降,100%NS处理时极显著或显著高于其他处理组。2类幼苗在15.0%NS和4.2%NS处理下差异不显著(P>0.05)。
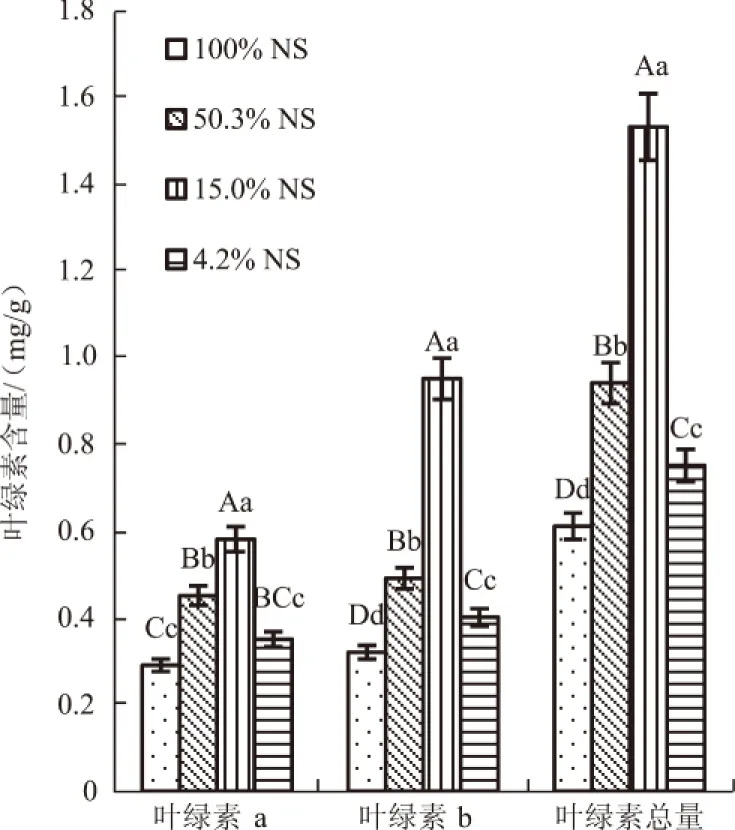
不同大、小写字母分别表示差异在0.01、0.05水平显著,下同

图2 1年生细叶云南松幼苗叶绿素含量

不同大、小写字母分别表示同一类幼苗不同处理在0.01、0.05水平上差异显著,下同
2.3 细叶云南松幼苗针叶MDA含量变化
MDA是脂质过氧化的产物,会使细胞膜膜脂过氧化,从而损伤细胞,MDA含量的多少可以体现出植物遭受胁迫伤害的程度[10]。由图4可知,1月生和1年生幼苗的MDA含量均随着光照强度的减弱而增加,在15.0%NS处理时陡速增高,15.0%NS和4.2%NS处理无显著差异(P>0.05)。说明1月生和1年生细叶云南松幼苗均在15.0%NS以下的弱光照时针叶细胞膜脂过氧化加剧,细胞膜受到严重伤害。

图4 细叶云南松幼苗针叶MDA含量
2.4 细叶云南松幼苗针叶SOD活性变化
由图5可知,1月生幼苗SOD活性在光照强度减弱时呈上升趋势,15.0%NS处理时有明显上升,在4.2%NS处理时达到最高值(590.2 U/g),与15.0%NS处理无显著差异(P>0.05)。1年生幼苗SOD活性随光照的降低先增加后减少,总体呈上升趋势,在15.0%NS处理时达到最大值(229.1 U/g)。1年生幼苗SOD活性在各处理阶段均低于1月生幼苗。
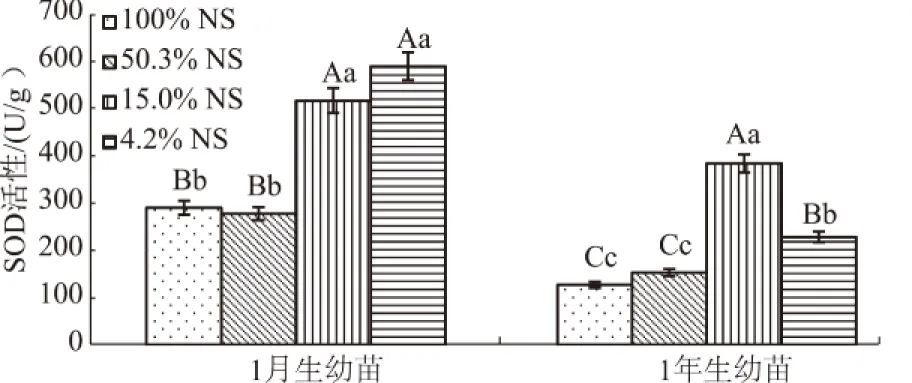
图5 细叶云南松幼苗针叶SOD活性
2.5 细叶云南松幼苗针叶CAT活性变化
CAT催化植物体内有毒害作用的过氧化氢分解为水和氧分子,进而避免膜脂过氧化的危害,有预防衰老的功效[20]。由图6可知,不同光照强度处理下,1月生和1年生幼苗遮荫处理的CAT活性均极显著高于全光照(P<0.01),且均在4.2%NS下达到最大值,分别为131.5 U/g和90.1 U/g,分别是100%NS的3.39倍和3.33倍。
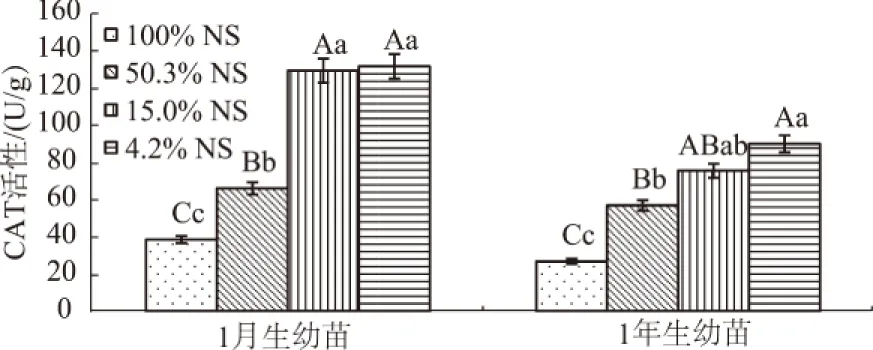
图6 细叶云南松幼苗针叶CAT活性
2.6 细叶云南松幼苗针叶POD活性变化
由图7可知,1月生和1年生幼苗的POD活性都随着光照强度的减弱呈先上升后下降的变化趋势,在50.3%NS下达到最高值,比最低值(100%NS)分别高出4.9倍和14.9倍,各处理的POD活性均极显著高于100%NS(P<0.01),15.0%NS和4.2%NS处理下无显著差异(P>0.05)。
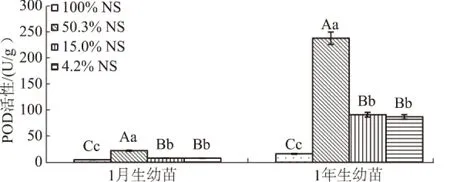
图7 细叶云南松幼苗针叶POD活性
2.7 细叶云南松幼苗针叶APX活性变化
由图8可知,1月生和1年生幼苗的APX活性均随光照强度减弱而增加,在弱光照(15.0%NS和4.2%NS)下的APX活性极显著高于强光照(100%NS和50.3%NS,P<0.01),15.0%NS与4.2%NS差异不显著(P>0.05)。1月生幼苗在4.2%NS达到峰值(200.62 U/g),1年生幼苗在15.0%NS时达到峰值(261.03 U/g)。
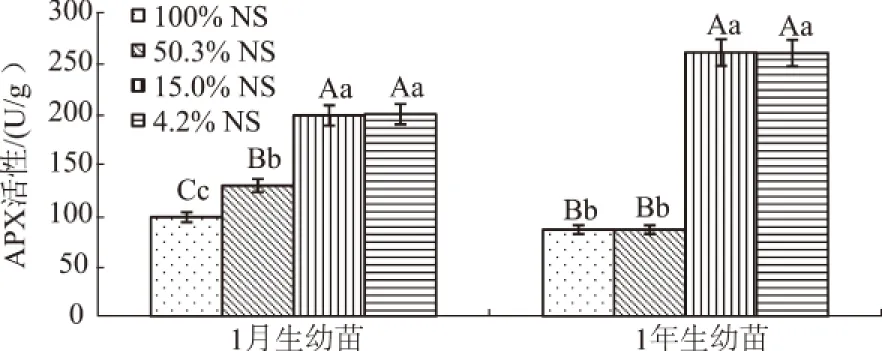
图8 细叶云南松幼苗针叶APX活性
3 结论与讨论
光照是植物生存的外在环境,光照环境的不同对植物生理产生的影响也不同[21]。植物体内叶绿素含量和比例是植物适应和利用环境因子的重要指标。随着光照强度的减弱,植物为了更好地利用环境光能,通常会通过增加叶绿素含量来对生长进行补偿[22]。在不同光照强度处理下,1月生幼苗针叶中叶绿素a、b和叶绿素总量随着光照强度的减弱先增加后减少,1年生幼苗针叶中叶绿素a、b和叶绿素总量随着光照强度的减弱呈增加的趋势,说明2类幼苗均在提高自身的叶绿素含量来增强捕光能力,提高光能利用率以适应弱光环境[23-24]。但1月幼苗比1年生幼苗的叶片形态及生理形态发育更幼嫩,同时在4.2%NS极弱光照时,1月生幼苗MDA含量达到最大值,其细胞膜已遭受严重伤害,所以,此时1月生幼苗体内各叶绿素含量会明显减少。1月生幼苗可溶性蛋白含量先上升后下降,在50.3%NS处理时最高,且叶绿素a、b和叶绿素总量较高,表明此时苗木光能利用率高,光合作用强,有利于蛋白质的产生[25]。而1年细叶云南松可溶性蛋白随光照强度的减弱逐渐下降,但各叶绿素含量逐渐增加。说明,1年生幼苗的可溶性蛋白作为植物细胞内一种重要的渗透调节物质,与叶绿素含量形成一种动态平衡来提高苗木对光环境的抗逆性[24-25]。因为可溶性蛋白是植物细胞内的重要渗透调节物质,其含量维持在一定水平有利于植物抗逆性提高,同时蛋白质也是植物光合作用产物之一,其含量的高低与植物光合作用有关。多种研究也表明,光生境变化对可溶性蛋白影响因树种不同变化不同,幅度也不相同[26-27]。

综上所述,50.3%NS处理有利于细叶云南松幼苗体内生理代谢活动,此时,1月生和1年生细叶云南松幼苗的叶绿素含量和可溶性蛋白含量较高, SOD、CAT、APX活性及MDA含量均保持低水平。当光照下降至15.0%NS以下时,1月生和1年生细叶云南松幼苗体内的生理代谢会受到抑制。建议在细叶云南松幼苗培育过程中给予适当的遮荫,这有利于苗木的生理代谢从而促进植物生长。
[1] 李治基,王献溥.广西细叶云南松的地理分布和环境的关系[J].植物生态学与地植物学丛刊,1981,5(1):28-37.
[2] 余茂源.云南松种质资源与遗传多样性研究进展[J].林业调查规划,2011,36(3):39-42.
[3] 杨章旗,冯源恒,吴东山.细叶云南松天然种源林遗传多样性的SSR分析[J].广西植物,2014,34(1):10-14.
[4] 冯源恒,吴东山,王德俊,等.拉雅松遗传多样性及同域分布种间亲缘关系分析[J].广西植物,2014,34(3):320-325.
[5] 庞圣江,张培,贾宏炎,等.细叶云南松群落物种多样性与种群空间分布格局[J].南方农业学报,2015,46(4):645-651.
[6] 杨秀星,严理,黄毅翠,等.广西百色细叶云南松天然林生长规律研究[J].黑龙江农业科学,2015(3):76-82.
[7] 吴敏,李春叶,秦武明,等.72年生细叶云南松天然林生长规律研究[J].广东农业科学,2014,41(2):61-65.
[8] 田玉红,李梓,梁才.拉雅松和细叶云南松松针挥发油的化学成分[J].中国实验方剂学杂志,2012,18(1):51-55.
[9] Sims D A,Pearcy R W.Response of leaf anatomy and photosynthetic capacity inAlocasiamacrorrhiza(Araceae) to a transfer from low to high light[J].American Journal of Botany,1992,79(4):449-455.
[10] 王松,蔡艳飞,李枝林,等.光照条件对高山杜鹃光合生理特性的影响[J].西北植物学报,2012,32(10):2095-2101.
[11] 陈诗,李根前,孙睿.不同光照处理对云南松苗木生长的影响[J].广东林业科技,2013,29(2):37-39.
[12] 杨敏文.快速测定植物叶片叶绿素含量方法的探讨[J].光谱实验室,2002,19(4):478-481.
[13] 曲春香,沈颂东,王雪峰,等.用考马斯亮蓝测定植物粗提液中可溶性蛋白质含量方法的研究[J].苏州大学学报(自然科学版),2006,22(2):82-85.
[14] 许长成,赵世杰,邹琦.植物组织内丙二醛的分离与鉴定[J].浙江大学学报(理学版),2011,38(3):207-210.
[15] 时连辉,牟志美,姚健.不同桑树品种在土壤水分胁迫下膜伤害和保护酶活性变化[J].蚕业科学,2005,31(1):13-18.
[16] 刘凤权,王金生.水杨酸对水稻叶片抗氧化酶系的影响[J].农业生物技术学报,2001,9(4):396-399.
[17] 江萍,孙向宁.华北落叶松酶活性及抗逆性机理研究[J].山西林业科技,2004(1):11-13.
[18] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2004:214-217.
[19] 沈文飚,徐朗莱,何茂柄,等.抗坏血酸过氧化物酶活性测定的探讨[J].植物生理学通讯,1996,32(3):203-205.
[20] 张坤生,田荟琳.过氧化氢酶的功能及研究[J].食品科学,2007(1):8-10.
[21] 刘晓宇.遮阴处理对华北落叶松幼苗生长的影响[J].山西林业科技,2012,41(1):31-33.
[22] 林凡,马松亚,潘锋,等.不同光照强度对格木苗木生长和生理生化特性的影响[J].安徽农业科学,2016,44(8):170-173.
[23] 周忆堂,马红群,梁丽娇,等.不同光照条件下长春花的光合作用和叶绿素荧光动力学特征[J].中国农业科学,2008,41(11):3589-3595.
[24] 陈菊艳,杨远庆.遮光对野扇花生长特性和生理指标的影响[J].西北植物学报,2010,30(8):1646-1652.
[25] 於艳萍.秋枫幼苗耐荫性及光合特性研究[D].南宁:广西大学,2013.
[26] 李远发.低温胁迫对四个不同种源麻风树幼苗生理特性的影响[D].南宁:广西大学,2010.
[27] 阳圣莹.虎舌红对不同光照强度的响应[D].雅安:四川农业大学,2009.
[28] 孙文越,王辉,黄久常.外源甜菜碱对干旱胁迫下小麦幼苗膜脂过氧化作用的影响[J].西北植物学报,2001,21(3):487-491.
[29] 晁天彩,周守标,常琳琳,等.光照强度对大花旋蒴苣苔叶形态和生理指标的影响[J].生态学杂志,2013,32(5):1161-1167.
[30] 刘柿良,马明东,潘远智,等.不同光强对两种桤木幼苗光合特性和抗氧化系统的影响[J].植物生态学报,2012,36(10):1062-1074.
Physiological Responses ofPinusyunnanensisvar.Seedlings to Different Light Intensities
HUANG Zeyue1,ZENG Qingjian2,ZHAO Yihui1,BEN Yuan2,YANG Mei1*
(1.College of Forestry,Guangxi University,Nanning 530004,China; 2.Yachang Forest Farm of Guangxi,Baise 533209,China)
To study the effects of light intensity on the physiological feature ofPinusyunnanensisvar.seedlings,1-month-old and 1-year-old seedlings were planted under different light conditions(100%,50.3%,15.0%,4.2% natue sunsine).And their physiological indexes were tested such as the contents of chlorophyll,soluble protein,and antioxidant enzyme activities of SOD and so on.The results showed that with the gradual decrease of light intensity,the chlorophyll-a,chlorophyll-b and total chlorophyll contents of 1-month-old seedlings increased initially and then decreased.The content of soluble protein reached the maximum at 50.3% natue sunsine(NS).The SOD activity,CAT activity,APX activity and MDA content increased with the decrease of light intensity,and reached the maximum at 15.0%NS.The chlorophyll-a,chlorophyll-b and total chlorophyll contents of 1-year-old seedlings gradually increased with the decrease of light intensity,while the soluble protein content decreased gradually.The SOD activity increased firstly and then decreased,which was the highest under the treatment of 15.0%NS.The CAT activity,APX activity and MDA content increased with the decrease of light intensity,and the maximum values were presented at 15.0%NS.The POD activity of the both seedlings was the highest at 50.3%NS.In conclusion,50.3%NS was beneficial to the increase of physiological metabolic activity ofPinusyunnanensisvar. seedlings.At this time,the contents of chlorophyll and soluble protein were higher in 1-month-old and 1-year-old seedlings,and the content of MDA,antioxidant enzyme activities of SOD,CAT and so on remained low.Therefore,moderate shade is needed forPinusyunnanensisvar.at juvenility period.
Pinusyunnanensisvar.; illumination environment; chlorophyll; soluble protein; antioxidant enzyme; physiological response
2017-01-28
广西林业厅科技项目(桂林科字[2016]第20号)
黄则月(1994-),女,湖南郴州人,在读硕士研究生,研究方向:森林培育。E-mail:huangzedou@126.com
*通讯作者:杨 梅(1970-),女,吉林长春人,教授,博士,主要从事森林培育领域的科研与教学工作。 E-mail:fjyangmei@126.com
S791.257
A
1004-3268(2017)06-0108-05

