草地贪夜蛾Sf9细胞对饥饿诱导自噬的响应
谢 昆,王丽仙,王 靖,朱灵明,尹建华,叶青霞,孙 艳
(1.红河学院 生命科学与技术学院,云南 蒙自 661199;2.云南省高校农作物优质高效栽培与安全控制重点实验室,云南 蒙自 661199)
草地贪夜蛾Sf9细胞对饥饿诱导自噬的响应
谢 昆1,2,王丽仙1,王 靖1,朱灵明1,尹建华1,叶青霞1,孙 艳1
(1.红河学院 生命科学与技术学院,云南 蒙自 661199;2.云南省高校农作物优质高效栽培与安全控制重点实验室,云南 蒙自 661199)
为研究草地贪夜蛾对饥饿诱导自噬的响应。从草地贪夜蛾EST数据库中筛选到一段核苷酸序列,设计特异性引物,RT-PCR技术从草地贪夜蛾Sf9细胞中扩增该核苷酸序列,经过生物信息学分析该序列与昆虫自噬相关基因ATG8同源性最高,命名为SfATG8基因,并构建了pIEX-4-mCherry-EGFP-SfATG8载体转染Sf9细胞。Sf9细胞经饥饿(PBS)诱导4 h后,Lyso-Tracker染色、Western Blotting、共聚焦显微镜检测细胞对自噬的响应程度。结果表明,经饥饿(PBS)诱导4 h的Sf9细胞中出现SfAtg8-PE的表达,共聚焦显微镜检测到Sf9细胞膜上的自噬小体。以上证据证实饥饿(PBS)能诱导Sf9细胞发生自噬,为深入研究Sf9细胞对自噬的响应奠定了基础。
草地贪夜蛾;Sf9;饥饿;自噬
细胞自噬被称为Ⅱ型程序性细胞死亡(Program cell death Ⅱ,PCDⅡ),以降解细胞器和细胞大分子组分形成自噬小体为特点,细胞自噬水平的增加通常由诸如饥饿信号和激素信号诱导,而过度水平的自噬可以引起自噬性细胞程序性死亡[1]。昆虫纲是节肢动物门中最大的一个纲,也是动物界中种类最多的一个纲,以黑腹果蝇(Drosophilamelanogaster,Dm)为代表的果蝇作为昆虫纲的一种模式生物被广泛应用于细胞自噬(Autophagy)的研究[2-10]。草地贪夜蛾(Spodopterafrugiperda,Sf)为鳞翅目类害虫,对禾本科作物危害巨大,细胞自噬是其变态发育时期的一个重要生理过程,通过自噬调控草地贪夜蛾等有害昆虫的变态发育过程有重要意义,对控制草地贪夜蛾对作物的危害具有重要作用。
营养信号和生长因子的存在能够促进 PI3KⅠ-TOR分子通路的活性,抑制细胞发生自噬[11],轻度饥饿信号则抑制PI3KⅠ-TOR 分子通路的活性,诱导细胞发生低水平自噬,使细胞处于不可逆死亡前的一种早期保护机制[12-13]。当哺乳动物细胞受到的环境胁迫压力超过一个安全的阈值时,比如过度的饥饿信号,细胞通过 PI3K Ⅲ 与 Atg6 的结合(PI3K Ⅲ-Atg6分子通路)和 Atg8-PE、Atg12-Atg5 两大泛素系统发生高水平的自噬,大量积累自噬体,使细胞走向不可逆死亡(PCD)[14]。即过度饥饿、生长因子剥夺、氧化胁迫、感染、蛋白积聚体的积累能导致自噬高水平上调,通过抑制mTORC1能触发高水平自噬的发生[15]。在昆虫细胞中对自噬的研究主要集中在果蝇和家蚕细胞中,昆虫细胞的自噬机理与哺乳动物细胞自噬相似,昆虫的蜕皮和变态发育由20-羟基蜕皮酮(20-hydroxyecdysone,20E)激素和保幼激素(Juvenile hormone,JH)协同调控,20E和饥饿信号通过诱导细胞自噬等生理事件来降解细胞内储存的能量和营养物质为昆虫变态发育所利用。饥饿能够通过抑制PI3KⅠ/Akt-Tor途径诱导变态发育时期果蝇幼虫组织细胞发生自噬[10,16]。
自噬蛋白质Atg8-PE是自噬体(Autophagosome)形成后唯一存留的自噬蛋白质,可以作为检测细胞自噬发生程度的直接证据[17-20],本研究以鳞翅目昆虫草地贪夜蛾Sf9细胞为研究对象,经饥饿(PBS)诱导4 h后,应用Lyso-Tracker染色自噬溶酶体、BmAtg8多克隆抗体检测Sf9细胞中SfAtg8-PE的含量变化等证据来评价自噬强度。再根据已报道的家蚕ATG8(BmATG8)、黑腹果蝇ATG8(DmATG8)、斜纹夜蛾ATG8(SlATG8)、棉铃虫ATG8(HaATG8)、粉纹夜蛾ATG8(TnATG8)基因序列和草地贪夜蛾EST数据库(Spodobase),设计特异性引物,采用RT-PCR技术从Sf9细胞总RNA中扩增SfATG8基因,构建pIEX-4-mCherry-EGFP-SfATG8过表达载体转染Sf9细胞,经饥饿(PBS)诱导4 h后,倒置荧光显微镜检测EGFP-SfAtg8-PE绿色荧光斑点和mCherry-SfAtg8-PE红色荧光斑点及融合情况,为饥饿诱导Sf9细胞自噬的检测提供新的依据和方法。
1 材料和方法
1.1 供试细胞
草地贪夜蛾Sf9卵巢细胞来自于华南师范大学邓会敏老师,于含有5%胎牛血清(Hyclone,SV30087.01,USA)的昆虫完全培养基SFX(Hyclone,AXL50928,USA)27 ℃细胞培养箱中继代培养。
1.2SfATG8的RT-PCR扩增
应用TRIzol试剂(Invitrogen,15596-026)提取Sf9卵巢细胞总RNA,进一步采用反转录试剂盒合成cDNA(TaKaRa,DRR047A),根据BmATG8(GenBank accession number:FJ416330.1 )、HaATG8(GenBank accession number:JQ739159)、SlATG8 (GenBank accession number:JX183217)、TnATG8 (GenBank accession number:JX183216)、DmATG8 (GenBank accession number:NM_167245.2)基因ORFs同源性比较,在草地贪夜蛾EST数据库中搜索到与上述昆虫ATG8基因核苷酸序列同源性较高的序列(Spodobase:Sf2M09420-5-1),以该序列ORF区设计特异性引物,以Sf9卵巢细胞cDNA为模板,应用PrimeSTAR高保真DNA聚合酶(TaKaRa,R010A)PCR扩增SfATG8基因,PCR反应条件如下: 98 ℃变性10 s,55 ℃退火5 s,72 ℃退火30 s,30个循环。琼脂糖凝胶电泳检测PCR产物大小,胶回收试剂盒回收纯化大小正确的核苷酸片段,将回收产物送交上海生工进行序列测定。
1.3SfATG8的生物信息学分析
应用DNAStar生物信息学软件,将扩增的SfATG8核苷酸序列与EST数据库中Sf2M09420-5-1核苷酸序列进行同源性比较,分析SfATG8与Sf2M09420-5-1的同源性。继续对SfATG8核苷酸序列与BmATG8、HaATG8、SlATG8、TnATG8、DmATG8核苷酸序列进行进化树分析,分析SfATG8的亲缘性。
1.4 Lyso-Tracker
Sf9细胞经PBS饥饿诱导4 h后,2 000 r/min离心10 min,先用PBS洗2次,3.7%甲醛处理5 min,再用50 nmol/L Lyso-Tracker DND-99(Life Tech,L7528,美国)于37 ℃染色10 min,染色结束后用PBS清洗3次,在激光共聚焦显微镜(Zeiss,LSM510,德国)最大激发波长577 nm处检测呈红色荧光标记的自噬溶酶体。
1.5 过表达载体构建和细胞转染
应用基因工程手段构建pIEX-4-mCherry-EGFP-SfATG8过表达载体,mCherry基因来源于pmCherry-N1载体,EGFP基因来源于pEGFP-N1载体,mCherry和EGFP分别在pIEX-4载体的SacⅠ/BamHⅠ和BamHⅠ/PstⅠ位点插入,SfATG8在SalⅠ/Hind Ⅲ位点插入。应用Effectence Transfection Reagent转染试剂盒(QIAGEN,301425,德国)将构建的pIEX-4-mCherry-EGFP-SfATG8过表达载体转染Sf9细胞48 h后,再经PBS饥饿诱导4 h,使用倒置荧光显微镜(Life Tech,AMF4302,美国)镜检诱导的细胞中mCherry红色荧光斑点和EGFP绿色荧光斑点及融合情况。
1.6 Western Blotting
Sf9细胞经PBS饥饿诱导4 h后,应用蛋白质提取试剂盒(Beyotime Co,P0013D,中国)提取细胞总蛋白,蛋白定量后(Beyotime Co,P0010S,中国)进行SDS-PAGE电泳,每个泳道10 μg总蛋白,电泳结束后将胶上蛋白转印至PVDF膜(Bio-Rad,162-0177,美国),然后将膜与含5%脱脂奶粉的家蚕BmAtg8多克隆抗体(1∶1 000)孵育过夜,再经TBST清洗3次,每次10 min,与含5%脱脂奶粉HRP标记的羊抗兔IgG(Beyotime Co,A0208,中国)孵育2 h,经TBST清洗3次,每次10 min,ECL化学发光显色(Applygen Co,P1010,中国)检测蛋白分子量大小。
2 结果与分析
2.1SfATG8的RT-PCR扩增
根据核苷酸同源性比对结果,从草地贪夜蛾EST数据库中筛选到同源性较高的一段核苷酸序列(Sf2M09420-5-1)(图1),该序列大小357 bp,进化树分析表明与SlATG8亲缘关系最为接近(图2)。以该段序列为依据设计特异性引物,RT-PCR扩增结果得到SfATG8大小约为357 bp(图3),与EST数据库中的核苷酸序列(Sf2M09420-5-1)同源性高达98.3%(图4)。进化树分析显示SfATG8基因与SlATG8亲缘关系最为接近(图5)。

图1 草地贪夜蛾EST数据库中筛选到的Sf2M09420-5-1核苷酸序列
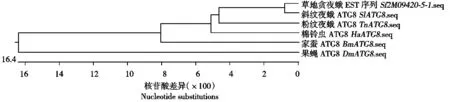
图2 Sf2M09420-5-1核苷酸序列与其他昆虫ATG8核苷酸序列进化树分析
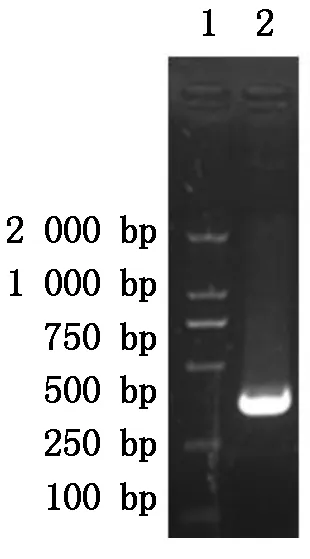
图3 SfATG8的RT-PCR扩增
2.2 Lyso-Tracker
Lyso-Tracker染色检测细胞自噬溶酶体来评价自噬程度的方法已广泛应用于昆虫细胞[5]。Sf9细胞经PBS饥饿诱导4 h后,Lyso-Tracker染色结果表明细胞中自噬溶酶体数量明显比对照组多,说明PBS饥饿能诱导Sf9细胞自噬(图6)。
2.3 SfAtg8-PE的Western Blotting检测
Atg8-PE(哺乳动物LC3-Ⅱ同源物)蛋白含量的高低已被用于评价自噬程度强弱最为直接的证据[18]。Sf9细胞经PBS饥饿诱导4 h后,提取细胞总蛋白,以兔抗BmAtg8多克隆抗体为一抗,经Western Blotting检测发现PBS饥饿诱导4 h后的Sf9细胞自噬程度增强(图7)。

图4 SfATG8核苷酸序列与Sf2M09420-5-1核苷酸序列同源性比较
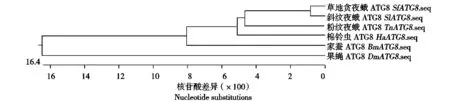
图5 SfATG8核苷酸序列与其他昆虫ATG8核苷酸序列进化树分析
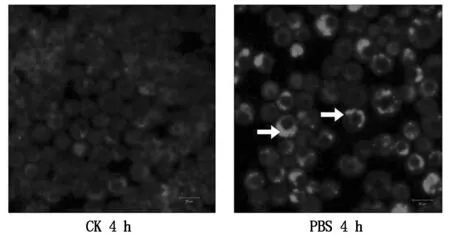
图6 饥饿诱导Sf9细胞的Lyso-Tracker染色检测

图7 SfAtg8-PE的Western Blotting检测
2.4 过表达载体构建和细胞转染
分别以pmCherry-N1和pEGFP-N1质粒为模板,设计特异性引物PCR扩增mCherry和EGFP基因(图8,9),与SfATG8构建pIEX-4-mCherry-EGFP-SfATG8过表达载体,分别经PCR和双酶切鉴定正确后将无内毒素重组质粒转染Sf9细胞,经PBS饥饿诱导4 h后,倒置荧光显微镜检测自噬体膜上的荧光斑点,结果表明,处理组红色荧光斑点和绿色荧光斑点明显多于对照组(图10),说明处理组自噬程度强于对照组。

图8 mCherry基因的PCR扩增
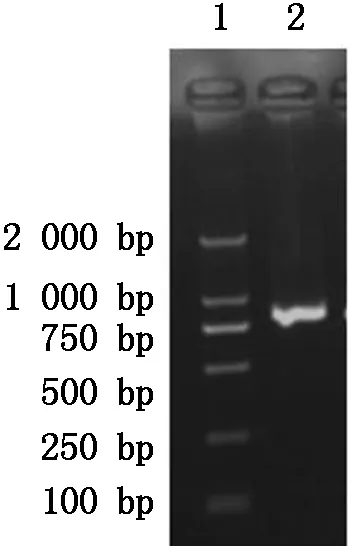
图9 EGFP基因的PCR扩增
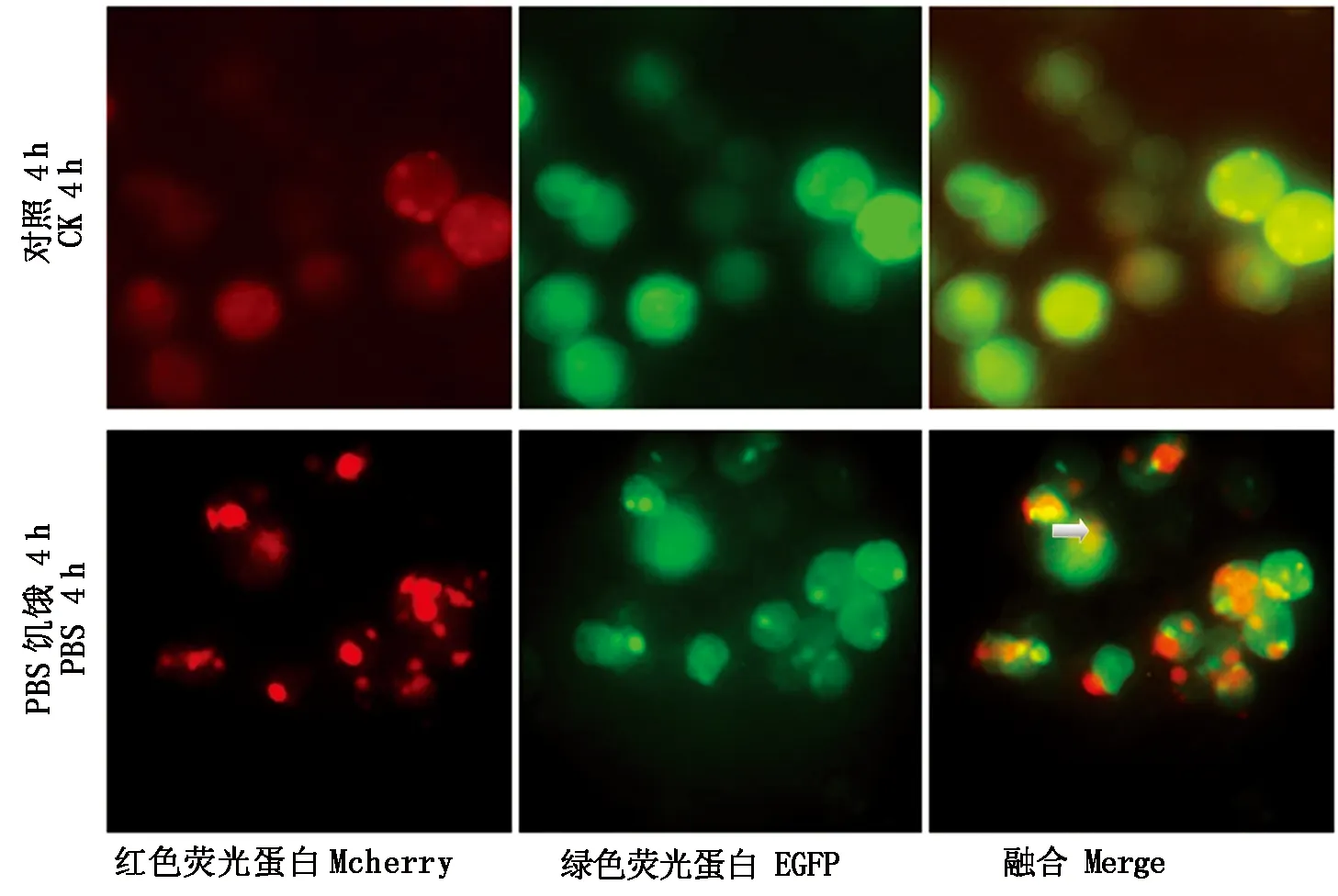
图10 倒置荧光显微镜检测自噬体膜上的荧光斑点
3 讨论
3.1SfATG8基因与其他昆虫ATG8基因高度同源
克隆的SfATG8基因与其他昆虫ATG8基因同源性比较后发现,SfATG8基因与其他昆虫ATG8基因具有较高的同源性,特别是与鳞翅目昆虫ATG8基因同源性极高,与SlATG8同源性达到98.3%。
3.2 PBS饥饿能诱导Sf9细胞对自噬的响应
参照PBS饥饿诱导家蚕Bm-12细胞响应自噬的时间点,选择PBS饥饿诱导Sf9细胞4 h作为检测自噬的时间点。以自噬检测指南中的检测方法为标准[17],采用Lyso-Tracker染色、SfAtg8-PE的Western Blotting检测、mCherry-SfAtg8-PE和EGFP-SfAtg8-PE的倒置荧光显微镜检测自噬小体等方法检测Sf9细胞对自噬的响应,结果表明,3种方法均能检测到Sf9细胞对自噬的应答。而且通过Western Blotting方法,应用自制的兔抗BmAtg8多克隆抗体能检测到Sf9细胞中的SfAtg8蛋白,证明BmAtg8多克隆抗体能够用于检测PBS饥饿诱导Sf9细胞自噬。
本研究通过生物信息学分析,利用RT-PCR技术从Sf9卵巢细胞中成功克隆出SfATG8基因;应用Lyso-Tracker染色、SfAtg8-PE的Western Blotting检测、mCherry-SfAtg8-PE和EGFP-SfAtg8-PE的倒置荧光显微镜检测自噬小体等方法能检测到草地贪夜蛾Sf9细胞对饥饿诱导自噬的响应情况。
[1] Otomo G,Metlagel Z,Takaesu G,et al.Structure of the human ATG12-ATG5 conjugate required for LC3 lipidation in autophagy[J].Nature Structural & Molecular Biology,2013,20(1):59-67.
[2] Chang Yu,Neufeld T.Autophagy takes flight inDrosophila[J].FEBS Letters,2010,584(7):1342-1349.
[3] Liu Kai,Xia Yu,Zhou J,et al.Molecular characterization of autophagy-related gene 5 fromSpodopteraexiguaand expression analysis under various stress conditions[J].Archives of Insect Biochemistry and Physiology,2016,92(4):225-241.
[4] Delanoue R,Slaidina M,Léopold P.The steroid hormone ecdysone controls systemic growth by repressing dMyc function inDrosophilafat cells[J].Developmental Cell,2010,18(6):1012-1021.
[5] Tian L,Ma L,Guo E,et al.20-hydroxyecdysone up regulatesAtggenes to induce autophagy in the Bombyx fat body[J].Autophagy,2013,9(8):1172-1187.
[6] Wei W,Gai Z,Ai H,et al.Baculovirusinfection triggers a shift from amino acid starvation-induced autophagy to apoptosis[J].PLoS One,2012,7(5):e37457.
[7] Gai Z,Zhang X,Islam M,et al.Characterization of Atg8 in lepidopteran insect cells[J].Archives of Insect Biochemistry and Physiology,2013,84(2):57-77.
[8] Guo E,He Q,Liu S,et al.Met is required for the maximal action of 20-hydroxyecdysone during Bomby×Metamorphosis[J].PLoS One,2012,7(12):e53256.
[9] Tracy K,Baehrecke E.The role of autophagy inDrosophilametamorphosis[J].Current Topics in Developmental Biology,2013,103(103):101-125.
[10] Wang Chuan,Zheng Wei,Liu Peng,et al.The steroid hormone 20-hydroxyecdysone upregulated the protein phosphatase 6 for the programmed cell death in the insect midgut[J].Amino Acids,2012,43(2):963-971.
[11] Wu F,Li Y,Wang F,et al.Differential function of the two Atg4 homologues in the aggrephagy pathway inCaenorhabditiselegans[J].The Journal of Biological Chemistry,2012,287(35):29457-29467.
[12] Wirawan E,Berghe T V,Lippens S,et al.Autophagy:for better or for worse[J].Cell Research,2012,22(1):43-61.
[13] Yang Zhifen,Klionsky D J.Eaten alive:a history of macroautophagy[J].Nature Cell Biology,2010,12(9):814-822.
[14] Maiuri M C,Zalckvar E,Kimchi A,et al.Self-eating and self-killing:crosstalk between autophagy and apoptosis[J].Nature Reviews Molecular Cell Biology,2007,8(9):741-752.
[15] Yu L,Mcphee C K,Zheng L,et al.Termination of autophagy and reformation of lysosomes regulated by mTOR[J].Nature,2010,465(730):942-946.
[16] Riddiford L,Cherbas P,Truman J.Ecdysone receptors and their biological actions[J].Vitamins and Hormones,2000,60(1):1-73.
[17] Klionsky D J,Abdalla F C,Abeliovich H,et al.Guidelines for the use and interpretation of assays for monitoring autophagy[J].Autophagy,2012,8(4):445-544.
[18] Yu L,Mcphee C,Zheng L,et al.Termination of autophagy and reformation of lysosomes regulated by mTOR[J].Nature,2010,465(730):942-946.
[19] Yuan Hai,Russell R,Guan Kun.Regulation of PIK3C3/VPS34 complexes by MTOR in nutrient stress-induced autophagy[J].Autophagy,2013,9(12):1983-1995.
[20] Zalckvar E,Berissi H,Mizrachy L,et al.DAP-kinase-mediated phosphorylation on the BH3 domain of beclin 1 promotes dissociation of beclin 1 from Bcl-XL and induction of autophagy[J].EMBO Reports,2009,10(3):285-292.
The Response ofSpodopterafrugiperdaSf 9 Cells to Starvation Induced Autophagy
XIE Kun1,2,WANG Lixian1,WANG Jing1,ZHU Lingming1,YIN Jianhua1,YE Qingxia1,SUN Yan1
(1.College of Life Science and Technology,Honghe University,Mengzi 661199,China;2.Key Laboratory of Crops with High Quality and Efficient Cultivation and Security Control,Yunnan Higher Education Institutions,Mengzi 661199,China)
In order to research the response ofSpodopterafrugiperdato starvation induced autophagy, a nucleotide sequences were screened from theSpodopterafrugiperdaEST database, then a pair of specific primers were designed, followed the nucleotide sequences were amplified by RT-PCR technique fromSpodopterafrugiperdaSf9 cells. The bioinformatics analysis showed the nucleotide sequences were high homology with insect autophagy related geneATG8, therefore designed asSfATG8, then constructed the pIEX-4-mCherry-EGFP-SfATG8 recombinant vector and transfected into Sf9 cells. After 4 h induction by starvation (PBS), Lyso-Tracker staining, Western Blotting, confocal microscope experiments detected autophagic response. The results showed that successfully expression of SfAtg8-PE in Sf9 cells after 4 h inducing by starvation (PBS), and the autophagosomes could be detected by confocal microscope. These evidences confirmed starvation (PBS) could induce autophagy in Sf9 cells and constructed the foundation for the deeply research the response of Sf9 cells to starvation induced autophagy.
Spodopterafrugiperda;Sf9;Starvation;Autophagy
2017-04-19
红河学院大学生创新创业训练计划项目(DCXL151016);红河学院大学生科技创新项目(SZ1520);红河学院应用型科学研究项目(XJY15Z07);红河学院博士专项(XJ15B13)
谢 昆(1975-),男,云南富民人,副教授,博士,主要从事动物生物化学与分子生物学研究。
S436;Q78
A
1000-7091(2017)03-0091-05
10.7668/hbnxb.2017.03.014

