猪DDX21基因的克隆、序列分析及原核表达
谢立兰,安 康,陈 力,孙紫德,方六荣
( 1.武汉生物工程学院 应用生物技术研究中心,湖北 武汉 430415;2.湖北省病毒载体工程技术研究中心,湖北 武汉 430415;3.河北北方学院 医学检验学院,河北 张家口 075000;4.华中农业大学 农业微生物学国家重点实验室,湖北 武汉 430070)
猪DDX21基因的克隆、序列分析及原核表达
谢立兰1,2,安 康3,陈 力1,2,孙紫德1,2,方六荣4
( 1.武汉生物工程学院 应用生物技术研究中心,湖北 武汉 430415;2.湖北省病毒载体工程技术研究中心,湖北 武汉 430415;3.河北北方学院 医学检验学院,河北 张家口 075000;4.华中农业大学 农业微生物学国家重点实验室,湖北 武汉 430070)
DEAD-box解旋酶21(DExD-box helicase 21, DDX21)是含DEAD-box的RNA解旋酶家族成员之一,不仅参与RNA的合成和加工过程,同时还参与机体的天然免疫应答,调控病毒的复制。为了研究猪DDX21基因的结构和功能,以猪肾传代细胞(PK-15)总cDNA为模板,根据GenBank 公布的预测序列(XM_005657387.2)设计引物扩增猪源DDX21基因,并采用分子生物学软件将其编码的氨基酸序列进行生物信息学分析。结果显示,首次成功克隆了猪DDX21基因的cDNA序列(GenBank登录号为KX396051),其开放读码框全长为2 355 bp,编码784个氨基酸;与牛、斑马鱼、人、小鼠、大鼠和非洲爪蟾的氨基酸序列同源性分别为91.7%,57.5%,88.0%,82.3%,83.8%和48.9%;该基因编码的蛋白结构域和人、牛、小鼠、大鼠一样,其C端都具有保守的GUCT结构域;系统进化树分析表明猪DDX21与牛DDX21的亲缘关系最近。进一步构建原核表达质粒pET28a-DDX21,经测序鉴定正确后,将其转化感受态细胞BL21(DE3),对DDX21基因进行原核表达。经 SDS-PAGE 分析显示重组菌可表达分子量约为 90 kDa的融合蛋白,与预期相符;在IPTG诱导浓度一定的条件下,重组菌的最佳诱导时间为5 h。猪DDX21基因的克隆和原核表达,为进一步研究DDX21蛋白的结构和生物学功能奠定了基础。
猪;DDX21基因;克隆;序列分析;原核表达
DEAD-box(DEAD-box proteins/DEAD-box helicases)家族蛋白是一类兼具有ATP酶活性和RNA解旋酶活性的RNA解旋酶,属于细胞RNA解旋酶超家族2型(SF2)。该家族蛋白广泛存在于从细菌到哺乳动物的许多物种中,通常含有9个保守的氨基酸基序,分别为基序Ⅰ、Ⅰa、Ⅰb、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ 和Q,并因其基序Ⅱ中的保守氨基酸序列Asp-Glu-Ala-Asp(D-E-A-D)被命名为DEAD-box蛋白[1-2]。DEAD-box蛋白家族成员众多,在各种涉及RNA的细胞进程中均发挥重要作用,包括转录、mRNA前体剪接、mRNA输出、核糖体生成、翻译起始、细胞器基因表达、RNA降解等[3-4]。
1993年,Flores-Rozas等[5]最先在Hela细胞的细胞核提取物中鉴定了一种新的具有打开双链RNA分子和改变ssRNA形成等双重功能的RNA解旋酶-RNA helicase Ⅱ。随后Valdez 等[6]利用自身抗体从西瓜胃(Watermelon stomach)病人的血清中分离到一种核仁RNA 解旋酶,命名为Gu蛋白。经鉴定,RNA helicase Ⅱ蛋白和Gu蛋白实为同一种蛋白,属于DEAD-box蛋白家族成员,并将其命名为DDX21 (DEAD-box helicase 21)或RH Ⅱ/Ga(RNA helicase Ⅱ/Gua)[7]。后来的多项研究表明DDX21不仅参与RNA的生成和加工过程[8-9],在不同类型肿瘤的发生发展以及机体的炎症反应和信号传递中DDX21也起到非常重要的作用[10-11],同时DDX21也参与了多种病毒(包括InfluenzaAvirusV(IAV)[12-13]、Humanimmunodeficiencyvirus1(HIV)[14]和Denguevirus(DENV)[15]等)的增殖过程。
迄今为止,仅人、小鼠和非洲爪蟾的DDX21基因被鉴定,尚未有关于猪源DDX21基因的研究报道。本研究利用RT-PCR技术克隆了猪DDX21的全长CDs区序列,利用生物信息学软件分析了该基因的保守结构域及其与其他物种DDX1基因的同源性。同时,构建了猪DDX21的原核表达质粒,并在宿主菌BL21中成功进行了诱导表达,为今后深入研究猪DDX21蛋白的结构和功能奠定了基础。
1 材料和方法
1.1 菌株、载体和细胞系
大肠杆菌(E.coli)DH5α菌株和BL21(DE3)菌株、原核表达载体pET-28a(+)、猪肾传代细胞系(PK-15)均由武汉生物工程学院应用生物技术研究中心保存。克隆载体pMD18-T购自大连宝生物(TaKaRa)公司。
1.2 主要试剂
RNA提取试剂RNAiso Plus、TaKaRa RNA PCR Kit (AMV) Ver.3.0试剂盒、DNA Marker、TaqDNA聚合酶、T4-DNA连接酶及各种限制性内切酶等均购自大连宝生物( TaKaRa)公司。SanPrep柱式质粒DNA小量抽提试剂盒、SanPrep柱式DNA胶回收试剂盒、考马斯亮蓝R250和双色蛋白预染Marker购自上海生工生物工程公司。
1.3 引物设计及合成
根据GenBank预测的猪DDX21基因序列(XM_005657387.2),利用Pinmer Premier 5.0 软件设计引物用于克隆DDX21,包括上游引物DDX21-2F(GAATTCATGCCGGGGAAACTTCGTAGT,下划线部分为EcoR Ⅰ酶切位点) 和下游引物DDX21-2R(CTCGAGTTACTGTCCAAACGCTTTGC,下划线部分为XhoⅠ酶切位点)。引物由生工生物(上海) 股份有限公司合成。
1.4 猪DDX21基因的克隆
利用RNAiso Plus 法提取猪肾传代细胞(PK-15)总RNA,参照反转录试剂盒(TaKaRa RNA PCR Kit (AMV) Ver.3.0)说明书,以DDX21-2F和DDX21-2R为引物,利用RT-PCR方法扩增猪DDX21基因编码区(CDs)序列。PCR反应体系:5×PCR Buffer 10 μL,Taq聚合酶1 μL,上下游引物各0.5 μL,cDNA模板10 μL,用ddH2O补足至50 μL。PCR反应条件:95 °C预变性5 min;94 ℃变性30 s,58 °C退火30 s,72 ℃延伸2 min 30 s,35个循环;72 °C延伸10 min;4 ℃保存。PCR产物纯化后克隆至pMD18-T 载体,命名为pMD18-DDX21,双脱氧末端终止法进行测序。
1.5 猪DDX21基因序列分析、同源性比对及构建进化树
利用DNAStar软件的EditSeq程序将上述所获得的猪DDX21基因核苷酸序列翻译成氨基酸序列;利用网站http://web.expasy.org/protparam/ 分析DDX21蛋白的理化性质;应用DNAStar的MegAligen工作区和ClustalX软件对不同物种DDX21蛋白的氨基酸序列及RH Ⅱ/ Gu蛋白C端结构域 (The C-terminal domain in the RNA helicase Ⅱ / Gu protein family,GUCT)进行同源性分析和比对,并进一步利用 MEGA 7.0软件构建NJ(Neighbour-joining)系统发育树;SMART服务器(http://smart.embl-heidelberg.de)对猪DDX21蛋白质功能进行分析。
1.6 原核表达载体pET28a-DDX21的构建
用限制性内切酶EcoR Ⅰ和XhoⅠ对pMD18T-DDX21 质粒和pET-28a(+)空载体进行双酶切,分别回收纯化DDX21基因片段和线性化的pET-28a(+)片段并将其连接。将连接产物转化到E.coliDH5α中,挑取单克隆菌落并提取质粒,用SphⅠ进行单酶切鉴定后,将疑似正确的质粒送到上海生工生物有限公司测序。
1.7 pET28a-DDX21的诱导表达
将测序正确的重组质粒(命名为pET28a-DDX21)转入到感受态细胞E.coliBL21(DE3)中,挑取单菌落至含50 mg/mL卡那霉素的LB培养基中,37 ℃摇床振荡培养过夜。取上述菌液200 μL至新配制的5 mL含50 mg/mL卡那霉素抗生素的LB中,37 ℃振荡培养至OD600为0.4~1.0时,取1 mL菌液作为诱导前样品,剩余菌液加入一定浓度的IPTG后37 ℃诱导一定时间。诱导后取1 mL菌液离心,沉淀用40 μL PBS和10 μL 5×SDS上样缓冲液充分混匀,100 ℃水浴5 min,进行SDS-PAGE 电泳检测,考马斯亮蓝染色。
2 结果与分析
2.1 猪DDX21基因的克隆
利用TaKaRa公司的细胞总RNA提取试剂-RNAiso plus 从猪肾传代细胞系(PK-15)中提取细胞总RNA,通过RT-PCR(两步法) 扩增猪DDX21基因的全长cDNA。PCR产物经1%琼脂糖凝胶电泳检测有一条约2 500 bp的条带(图1-A),与预期相符。进一步将上述PCR产物进行胶回收,与pMD18-T 载体连接并转化至大肠杆菌DH5α感受态细胞后,采用EcoR Ⅰ和BamH Ⅰ进行双酶切鉴定,酶切后所得片段大小均与预期结果一致(图1-B)。挑取阳性克隆(命名为pMD18-DDX21)菌液送生工(上海)生物工程有限公司进行测序。对测序结果进行序列比对得到猪DDX21基因的全长编码区由2 355个核苷酸组成(GenBank登录号为KX396051)。
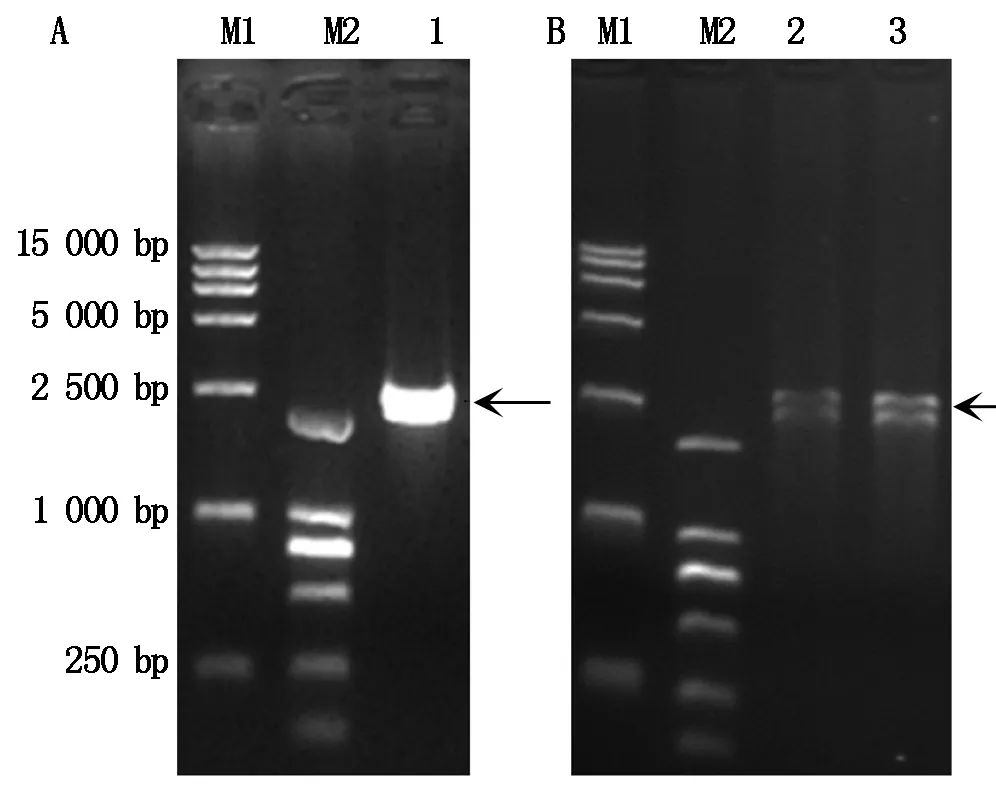
M1和M2.DL1.5 kb和DL2000 DNA Marker;1.猪DDX21扩增产物;2,3.pMD18-DDX21/EcoR Ⅰ+BamH Ⅰ。
2.2 猪DDX21基因的氨基酸序列分析及同源进化树构建
根据DNAStar软件推导出猪DDX21基因编码784个氨基酸,Protparam分析表明其蛋白分子量为87.22,等电点(pI)为9.35,蛋白质稳定性为44.26,为不稳定蛋白。进一步运用DNAStar的MegAligen 工作区将其与已知物种DDX21的氨基酸序列进行同源性分析。结果显示,猪DDX21 与牛(NP_001076996.1)、斑马鱼(NP_001120807.2)、人(NP_004719.2)、小鼠(NP_062426.2)、大鼠(NP_001032278.1)和非洲爪蟾(NP_001039224.1)的氨基酸同源性分别为91.7%,57.5%,88.0%,82.3%,83.8%和48.9% (图2-A),显示哺乳动物DDX21的氨基酸序列具有较高的同源性。根据不同动物DDX21的氨基酸序列绘制遗传进化树,结果显示猪DDX21与牛DDX21 的亲缘关系最近(图2-B)。
进一步利用SMART软件对猪DDX21的氨基酸序列进行结构域预测,结果发现,与其他物种类似,猪DDX21也含有3个保守结构域,分别为位于206-413aa的DEXDc结构域、位于449-533aa的RNA解旋酶(HELICc)结构域和位于621-716aa的RH Ⅱ/ Gu蛋白C端结构域(http://smart.embl-heidelberg.de/smart/job-status.pl?jobid=611832
146647831474358807OmTGQHIGxM),图3-A),且Blast序列比对发现DDX21的GUCT结构域在哺乳动物中高度保守,进一步证明所克隆的序列为猪的DDX21序列(图3-B)。
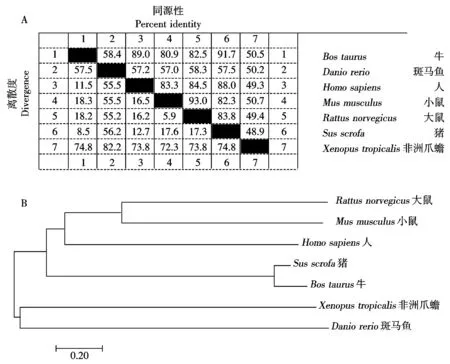
图2 不同物种DDX21的氨基酸序列比较(A)和遗传进化树(B)
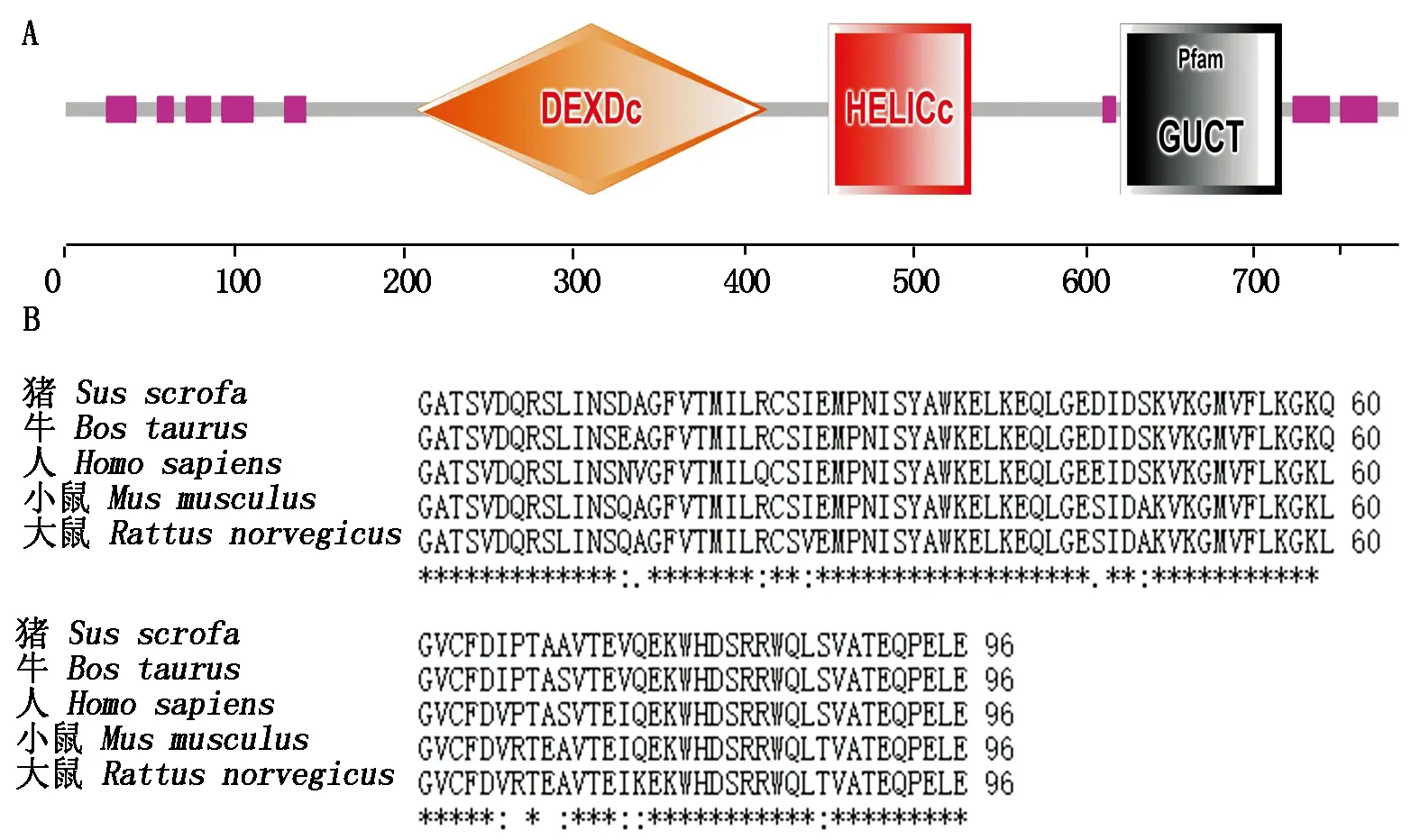
图3 DDX21基因的保守结构域(A)和GUCT区的氨基酸序列比对(B)
2.3 猪DDX21基因原核表达载体的构建及鉴定
根据1.6方法所述构建原核表达质粒pET28a-DDX21。将重组质粒用SphⅠ单酶切鉴定后,产生一条约1 300 bp和一条约6 400 bp的线性条带,与预期结果一致(图4)。在此基础上,进一步对pET28a-DDX21进行测序,也证实无碱基错配,证明原核表达质粒构建成功。
2.4DDX21基因重组蛋白的诱导表达
重组质粒pET28a-DDX21转化BL21感受态细胞,经终浓度为1.0 mmol/L的IPTG在37 ℃分别诱导2,3,4,5 h后进行SDS-PAGE 电泳检测。结果显示重组质粒成功表达出约90 kDa大小的蛋白,并且随着诱导时间的延长,融合蛋白的表达量也逐渐增加。而未诱导的空载体质粒转化菌和未诱导的 pET28a-DDX21重组质粒均没有出现相同的条带(图5)。进一步通过加入不同终浓度的IPTG诱导培养5 h,以筛选最优的IPTG浓度。结果如图6所示,在0.6~1.2 mmol/L的IPTG浓度时,目的蛋白都能表达,但表达量无明显变化。参考《pET System Manual》中提到的“带有T7lac启动子的载体则需要终浓度为1 mmol/L 的IPTG 才能完全诱导。”,而IPTG对细菌也存在一定的毒性,为此进一步选择终浓度为1.0 mmol/L的IPTG在菌液不同吸光值时(分别在菌液OD600为0.4,0.6,0.8或1.0时添加IPTG)对细菌进行诱导,37 ℃培养5 h后运用SDS-PAGE检测蛋白的表达,以探索重组蛋白表达的最佳诱导时机。电泳结果表明(图7),在同样的诱导时间和诱导剂浓度时,初始OD600分别为0.6和0.8时的菌液诱导后表达的重组蛋白基本相当,明显高于OD600为0.4或1.0试验组。
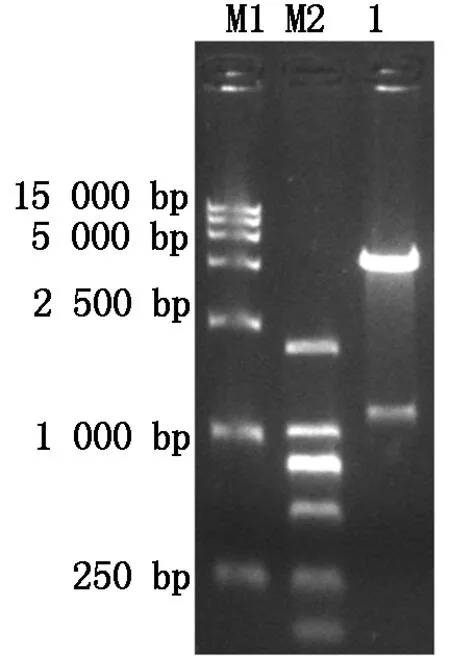
M1和M2.DL1.5 kb和DL2000 DNA Marker;1.pET28a-DDX21/ Sph Ⅰ单酶切鉴定。
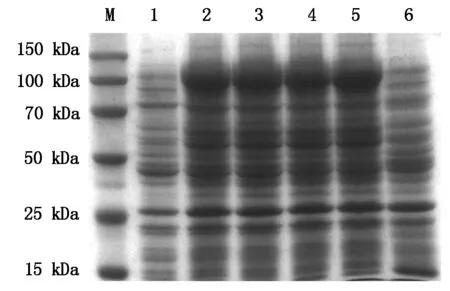
M.蛋白Marker;1.诱导的空载体;2~5.pET28a-DDX21分别诱导2,3,4,5 h;6.未诱导的pET28a-DDX21。
M. Protein molecular weight Marker; 1. Induced the pET28a; 2-5. Induced pET28a-DDX21 for 2, 3, 4, 5 h, respectively; 6. pET28a-DDX21 before inducement.
图5 诱导pET28a-DDX21不同时间后蛋白的表达
Fig.5 SDS-PAGE analysis of pET28a-DDX21 expression product after different induction time
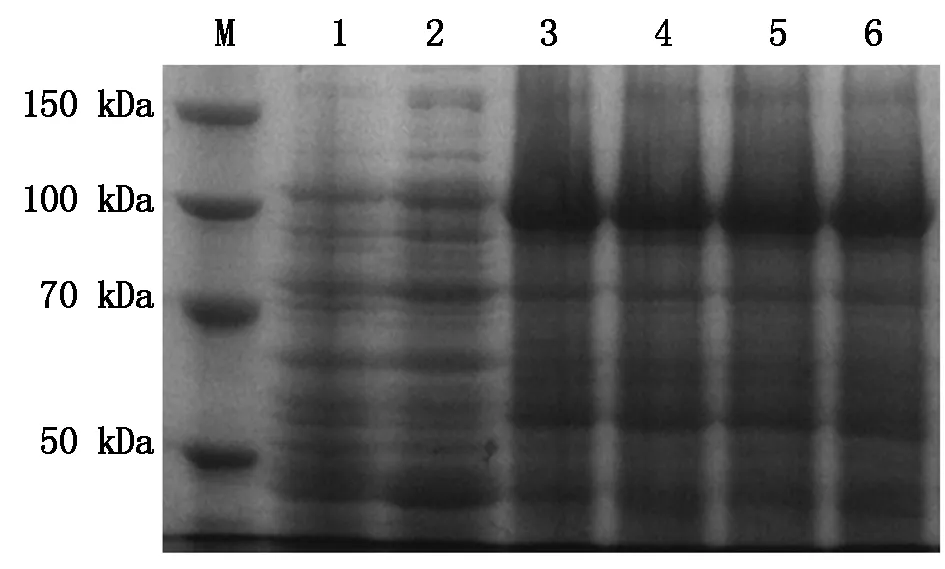
M.蛋白Marker;1.诱导的空载体;2.未诱导的pET28a-DDX21;3~6.分别以0.6 ,0.8,1.0,1.2 mmol/L IPTG 诱导pET28a-DDX1。
M. Protein molecular weight Marker; 1. Induced the pET28a; 2. pET28a-DDX21 before inducement; 3-6.Induced pET28a-DDX21 with 0.6,0.8,1.0,1.2 mmol/L IPTG, respectively.
图6 不同浓度IPTG诱导pET28a-DDX21的表达
Fig.6 SDS-PAGE analysis of pET28a-DDX21 expression with different concentrations of IPTG

M.蛋白Marker;1.诱导的空载体;2~5.菌液吸光值分别为0.4,0.6,0.8,1.0时诱导蛋白的表达;6.未诱导重组质粒。
M. Protein molecular weight Marker; 1. Induced the pET28a; 2-5.Induced pET28a-DDX21 at different OD value 0.4, 0.6, 0.8,and 1.0 respectively; 6. pET28a-DDX21 before inducement.
图7 不同吸光值时诱导pET28a-DDX21的表达
Fig.7 SDS-PAGE analysis of pET28a-DDX21 expression at different OD value
3 讨论和结论
DEAD-box解旋酶是一个包含了与RNA代谢(转录起始、RNA剪切、核运输、前mRNA拼接)等许多过程的蛋白质家族[1]。DDX21作为DEAD-box解旋酶家族的一员,已有多项研究表明其在核糖体RNA的生成、RNA编辑和转录等过程中起到非常重要的作用[8-9],这些可能是由DDX21特殊的核仁定位决定的。此外,近期研究还表明DDX21参与了机体的天然免疫和病毒复制等诸多生物学过程。Zhang等[10]在分离鉴定能够特异性结合poly(I∶C)的蛋白质时,发现DDX21和解旋酶DDX1及DHX36形成一个复合体,且DDX21通过其PRK结构域分别结合DDX1的SPRY结构域和DHX36的C-HA2-DUF解旋结构域,在poly(I∶C)的识别和信号传递过程中起桥梁作用;在IAV感染早期,DDX21通过结合IAV的PB1蛋白和抑制聚合酶的组装,从而抑制IAV病毒RNA和蛋白质的合成,而在病毒感染后期,病毒的非结构蛋白NS1竞争性的与DDX21,从而释放出PB1蛋白并解除DDX21对其病毒的抑制作用[12]。类似的,DDX21还能抑制HIV、登革热病毒和博尔纳病病毒(Bornadiseasevirus,BDV)等病毒的复制,但其具体机制尚不清楚[14-16]。
目前,有关DDX21的功能研究主要是以人[3]、鼠[17]和非洲爪蟾[18]为模型,其他物种却鲜有功能报道。本研究通过RT-PCR方法扩增得到猪DDX21基因的CDs序列。该基因的CDs序列为2 355 bp,编码784个氨基酸,预测其蛋白分子量为87.22 kDa,等电点(pI)为9.35,蛋白质稳定性为44.26(大于40被认为不稳定)。经氨基酸序列比对和进化树分析,猪DDX21基因与其他哺乳动物如牛、大鼠、人和小鼠的氨基酸序列之间的同源性较高,分别为91.7%,83.8%,88.0%和82.3%,且进一步的结构预测表明猪DDX21与其他哺乳动物的DDX21一样,也存在DEXDc、HELICc和GUCT这3个保守结构域,其中GUCT为DDX21蛋白所特有的结构域[19]。不同物种DDX21基因结构域的高度保守性及猪DDX21与人DDX21之间较高的同源性,提示猪DDX21可能与人DDX21具有更相似的作用和功能。
本研究以pET28a(+)为原核表达载体构建了重组质粒pET28a-DDX21,并在大肠杆菌中成功表达了猪DDX21蛋白。进一步的分析表明pET28a-DDX21融合蛋白在IPTG终浓度为0.6~1.2 mmol/L时表达量变化不明显。在IPTG终浓度为1 mmol/L,相同的初始OD值下诱导2~5 h都能表达,以诱导5 h后的表达量最高。在IPTG终浓度一定的条件下,初始OD值不同的菌液在诱导时间相同后蛋白表达差别较大,以初始OD为0.6和0.8时诱导的表达量较理想,初始OD值过低(0.4)或过高(1.0)时蛋白表达量都不高。pET28a(+)融合的his标签分子量小,不会改变目的蛋白自身的可溶性,在pH=8.0时,不携带电荷,对蛋白的折叠、构象形成等影响较小,容易分离纯化[20]。因此,pET28a-DDX21重组质粒的构建及DDX21表达条件的优化可为重组蛋白的生产制备及进一步研究猪DDX21的结构提供基础资料。
综上所述,本研究首次克隆了猪DDX21基因,通过生物信息学分析再次证明DDX21基因在不同物种中的高度保守性,并利用原核表达技术成功诱导表达猪DDX21蛋白,今后拟对猪DDX21蛋白的结构及猪DDX21基因在猪源病毒复制中的作用和参与机体天然免疫的机制进行进一步研究。
[1] Fuller-Pace F V.DEAD box RNA helicase functions in cancer[J].RNA Biology,2013,10(1,SI):121-132.
[2] 张亚楠, 姜 华, 王艳丽, 等.DExD/H-box类RNA解旋酶的结构与功能[J].生命的化学,2013(3):331-337.[3] Fullam A,Schröder M.DExD/H-box RNA helicases as mediators of anti-viral innate immunity and essential host factors for viral replication[J].Biochimica et Biophysica acta,2013,1829(8):854-865.
[4] 刘 琴.猪DDX3X的功能分析及其对猪繁殖与呼吸综合征病毒增殖的影响[D].武汉: 华中农业大学,2011.
[5] Flores-Rozas H,Hurwitz J.Characterization of a new RNA helicase from nuclear extracts of HeLa cells which translocates in the 5′ to 3′ direction[J].The Journal of Biological Chemistry,1993,268(28):21372-21383.
[6] Valdez B C,Henning D,Busch R K,et al.A nucleolar RNA helicase recognized by autoimmune antibodies from a patient with watermelon stomach disease[J].Nucleic Acids Research,1996,24(7):1220-1224.
[7] Valdez B C,Yang H,Hong E,et al.Genomic structure of newly identified paralogue of RNA helicase Ⅱ/Gu:detection of pseudogenes and multiple alternatively spliced mRNAs[J].Gene,2002,284(1/2):53-61.
[8] Calo E,Flynn R A,Martin L,et al.RNA helicase DDX21 coordinates transcription and ribosomal RNA processing[J].Nature,2015,518(7538):249-253.
[9] Sloan K E,Leisegang M S,Doebele C,et al.The association of late-acting snoRNPs with human pre-ribosomal complexes requires the RNA helicase DDX21[J].Nucleic Acids Research,2015,43(1):553-564.
[10] Zhang Z,Kim T,Bao M,et al.DDX1,DDX21,and DHX36 helicases form a complex with the adaptor molecule TRIF to sense dsRNA in dendritic cells[J].Immunity,2011,34(6):866-878.
[11] Zhang Y,Baysac K C,Yee L F,et al.Elevated DDX21 regulates c-Jun activity and rRNA processing in human breast cancers[J].Breast Cancer Research, 2014,16(5):449.
[12] Chen G,Liu C H,Zhou L,et al.Cellular DDX21 RNA helicase inhibitsInfluenzaAvirusreplication but is counteracted by the viral NS1 protein[J].Cell Host & Microbe,2014,15(4):484-493.
[13] Tsai S Y,Segovia J A,Chang T H,et al.DAMP molecule S100A9 acts as a molecular pattern to enhance inflammation during influenza A virus infection:role of DDX21-TRIF-TLR4-MyD88 pathway[J].PLOS Pathogens,2014,10(1):e1003848.doi:10.1371/journal.ppat.1003848.
[15] Dong Y,Ye W,Yang J,et al.DDX21 translocates from nucleus to cytoplasm and stimulates the innate immune response due toDenguevirusinfection[J].Biochemical and Biophysical Research Communications,2016,473(2):648-653.
[16] Watanabe Y,Ohtaki N,Hayashi Y,et al.Autogenous translational regulation of theBornadiseasevirusnegative control factor X from polycistronic mRNA using host RNA helicases[J].PLOS Pathogens,2009,5(11):e1000654.doi:10.1371/journal.ppat.1000654.
[17] Valdez B C,Wang W.Mouse RNA helicase Ⅱ/Gu:cDNA and genomic sequences,chromosomal localization,and regulation of expression[J].Genomics,2000,66(2):184-194.
[18] Yang H,Zhou J,Ochs R L,et al.Down-regulation of RNA helicase Ⅱ/Gu results in the depletion of 18 and 28 S rRNAs inXenopusoocyte[J].The Journal of Biological Chemistry,2003,278(40):38847-38859.
[19] Fuller-Pace F V.DExD/H box RNA helicases:multifunctional proteins with important roles in transcriptional regulation[J].Nucleic Acids Research,2006,34(15):4206-4215.
[20] 王晓晔, 石博妹, 王英群, 等.抗凋亡融合蛋白 PTD-Bcl-xL 原核表达载体的构建及表达纯化[J].华北农学报,2016,31(1):1-7.
Cloning,Sequence Analysis and Prokaryotic Expression of PorcineDDX21
XIE Lilan1,2,AN Kang3,CHEN Li1,2,SUN Zide1,2,FANG Liurong4
( 1.Center of Applied Biotechnology,Wuhan Institute of Bioengineering,Wuhan 430415,China;2.Hubei Engineering Research Center of Viral Vector,Wuhan 430415,China;3.College of Lab Medicine,Hebei North University,Zhangjiakou 075000,China;4.State Key Laboratory of Agricultural Microbiology,Huazhong Agricultural University,Wuhan 430070,China)
DDX21 (DExD-box helicase 21) is a RNA helicase,which belongs to the DEAD-box family of RNA helicases.Previous reports showed DDX21 not only take part in the generation and processing of RNA,but also have functional roles in virus′s replication.This experiment was conducted to obtain sequence of swine DEAD-box helicase 21 gene,and to study its prokaryotic expression.According to the predictedSusscrofaDDX21 gene mRNA sequence in GenBank(XM_005657387.2),proper primers were designed.Total RNA was then extracted from porcine kidney passage cells(PK-15),and CDs sequence of the gene was amplified by RT-PCR using the primers.The sequence analysis results showed that the sequence of porcine DDX21 CDs was in length of 2 355 bp which encoded 784 amino acids (GenBank Accession No.KX396051); Compared withBostaurus,Daniorerio,Homosapiens,Musmusculus,RattusnorgicusandXenopustropicalis,homology of porcine DDX21 was 91.7%,57.5%,88.0%,82.3%,83.8%,and 48.9% at the amino acid level,respectively; Structural analysis with the SMART program indicated that porcine DDX21 contained a putative C-terminal GUCT domain.Similar GUCT domain domains had been identified in cattle,human,mouse and rat DDX21; Phylogenetic tree analysis showed that porcine DDX21 had the closest relationship with cattle DDX21.Additionally,prokaryotic expression vector pET28a-DDX21 was constructed for further study.After sequencing,the recombinant was transformed intoEscherichiacoliBL21 (DE3) competent cells.The SDS-PAGE experiment demonstrated that the recombinant objective protein appeared a molecular mass of approximately 90 kDa which was consistent with the anticipated size.When IPTG concentration was kept constant,5 h induction was optimal.Cloning of porcineDDX21 gene and expression inE.colilaid a foundation for the subsequent structural analysis and function research of this gene.
Porcine;DDX21 gene; Cloning; Sequence analysis; Prokaryotic expression
2017-04-22
国家自然科学基金项目(31402181);湖北省教育厅科学技术研究项目(B2016303)
谢立兰(1984-),女,江西九江人,讲师,博士,主要从事动物病毒分子生物学与免疫学研究。
方六荣(1969-),女,湖北咸宁人,教授,博士,主要从事动物病毒分子生物学与免疫学研究。
Q78;S828
A
1000-7091(2017)03-0042-06
10.7668/hbnxb.2017.03.007

