性别决定基因TASSELSEED2在水稻中的功能歧化性浅析
郭盈盈,候志鹏,钟 鸣,陈丽静,马 慧,张 丽,徐正进, 李浩戈
(1.沈阳农业大学 生物科学技术学院,辽宁省农业生物技术重点实验室,辽宁 沈阳 110866;2.农业部东北水稻生物学与遗传育种重点实验室,辽宁 沈阳 110866)
性别决定基因TASSELSEED2在水稻中的功能歧化性浅析
郭盈盈1,候志鹏1,钟 鸣1,陈丽静1,马 慧1,张 丽1,徐正进2, 李浩戈1
(1.沈阳农业大学 生物科学技术学院,辽宁省农业生物技术重点实验室,辽宁 沈阳 110866;2.农业部东北水稻生物学与遗传育种重点实验室,辽宁 沈阳 110866)
花器官的发育不仅影响农作物的生产,通过性别决定产生单性花的机制亦是重要的基础理论问题。TASSELSEED2基因是与JA合成有关的调控玉米单性雄花产生的性别决定基因,对一些植物中TS2同源基因的表达分析表明TS2蛋白可能在进化过程中产生了功能歧化。为探究TS2蛋白在进化过程中其功能是否发生了歧化,首先通过生物信息学手段对水稻和玉米的TS2基因进行了比较分析,分子进化分析表明,TS2基因在一些植物中可能并不仅仅局限于抑制雌蕊发育的性别决定功能。因此,猜测两性花植物水稻中的TS2可能具有其他功能。利用蛋白质三维结构预测软件,发现水稻TS2基因编码典型的SDR蛋白,含有保守的GASGIG和YTASK基序,其作用底物可能与玉米TS2蛋白类似。启动子分析表明OsTS2和玉米TS2的激素应答元件存在差别。随后,利用RNA-seq数据进行了OsTS2与玉米TS2的组织器官表达分析,并利用实时荧光定量技术考察外源MeJA喷施处理对OsTS2与玉米TS2基因表达的影响。结果表明,OsTS2主要在花序中表达,经外源MeJA处理后其表达量明显升高;而玉米TS2在雄穗分化关键期的叶片中表达量最高,其表达量基本不受外源MeJA影响。OsTS2与玉米TS2表达方面的差异提示水稻TS2可能具有与玉米TS2不同的功能,为深入了解TS2在两性花植物中的功能提供了线索。
水稻;玉米;TS2;茉莉酸甲酯
水稻和玉米是影响国民经济的重要粮食作物,它们的花序发育不仅决定了产量,其分子调控机理研究对提高产量也具有重要的理论研究价值。作为研究发育生物学的模式植物,水稻和玉米的花序在分化产生雄蕊和雌蕊等花器官的发育过程存在着明显的不同[1]。水稻花序分化产生两性花,即一个水稻花内同时包含雄蕊和雌蕊。而玉米是雌雄同株异花植物,玉米具有独立的2种花序,雄花序(Tassel)和雌花序(Ear)最初分化产生的花均为两性花,但随着发育的进行,通过性别决定过程分别形成成熟的雄单性花和雌单性花[2]。目前已有研究表明,一些与茉莉酸(Jasmonic acid,JA)合成有关的性别决定基因在玉米雄花的性别决定过程中起非常重要的作用,而赤霉素(Gibberilin,GA)与玉米雌花的性别决定过程有关[2-5]。
玉米TASSELSEED2 (TS2)编码一个短链脱氢酶(Short-chain dehydrogenase,SDR),该基因通过抑制雄花中雌蕊原基的发育,从而促进产生成熟的单性雄花[6]。另外一个雄穗性别决定基因TASSELSEED1 (TS1) 编码一个脂氧合酶(Lipoxygenase),该基因突变会导致玉米雄花发生雌性化转变进而成为两性花[6]。Acosta等[7]发现,TS1、TS2都通过与JA合成有关的一个共同通路(Pathway)起作用,这表明了JA介导的TS2基因途径在玉米雄穗的性别决定过程中具有重要作用。
Simon等[8]克隆了一些禾本科植物中的TS2同源基因并对它们进行表达分析后推测,TS2在大多数禾本科植物中可能有其他作用。麦瓶草(Silenelatifolia)与玉米不同,是雌、雄单性异株植物。Lebel等[9]发现麦瓶草中的TS2同源基因(STA1)与玉米中TS2表达有明显的不同。TS2能在玉米雄花的雌花原基中表达,但STA1不在麦瓶草雄株的雌蕊原基中表达,因此,STA1的功能与TS2一样可能存在不同,进一步发现STA1与两性花植物拟南芥中TS2的同源基因ATA1一样,也在花药的绒毡层细胞中表达,表明它们可能有相似的功能[9]。因此,深入研究JA介导的TS2基因途径在其他“非性别决定”禾本科植物中的功能,将有助于认识性别决定的衍生和分子进化过程,从此加深人们对这一重要基础理论问题的理解。
作为短链脱氢酶的TS2蛋白在两性花植物水稻花发育中起何种作用,是否与JA相关尚未见到报道,尽管已有研究表明JA对水稻的花器官特别是花药的发育起重要的调控作用。俞竹青、Cai、Zhang等[10-12]发现与JA合成或信号转导有关的酯酶基因P0491E01、EG1、EG2对水稻花药的成熟起关键调控作用,其中EG1、EG2还影响了其他花器官的发育。
为初步探查TS2基因在非性别决定植物水稻中的可能功能,本研究通过生物信息学分析和表达分析,比较了水稻中TS2的同源基因(OsTS2)与玉米TS2基因的异同。尽管它们同属于SDR家族,三维结构相似,但其组织表达特性及对外源喷施JA的前体物质茉莉酸甲酯(MeJA)的反应有所不同,说明TS2的功能在水稻中可能发生了歧化。
1 材料和方法
1.1 生物信息学分析
1.1.1OsTS2 的查找、比对及进化分析 以玉米TS2基因的mRNA(NM_001111852.1)为探针,在NCBI和水稻RGAP(http://rice.plantbiology.msu.edu/index.shtml)数据库中进行Blast 比对,获得OsTS2基因序列(LOC_Os03g18740)。以玉米TS2蛋白的保守氨基酸序列对NCBI数据库进行BlastP搜索,查找不同植物的TS2蛋白序列,然后利用MEGA 4.0软件构建进化树。
1.1.2 OsTS2与玉米TS2氨基酸序列相似性分析及蛋白序列的三维结构预测 将OsTS2和玉米TS2蛋白序列上传至Swiss-Model网站,选择联配模式(Alignment mode) 进行三维结构模型构建,最后用Swiss-Model自带ANOLEA原子平均势能Web 界面进行质量检查。下载该建模至本地,使用RasMol 软件查看并标注蛋白质的三维结构。
1.1.3OsTS2与玉米TS2基因启动子区顺式调控元件分析 为分析比较OsTS2与玉米TS2基因的功能,应用PlantCARE (http://bioinformatics.psb.ugent.be/webtools/plantcare)对OsTS2与玉米TS2基因上游2 000 bp序列进行启动子顺式调控元件的预测。
1.2OsTS2 基因的表达模式分析
1.2.1OsTS2 与玉米TS2基因的组织表达模式分析 以OsTS2 和玉米TS2基因序列为探针分别在Rice Genome Annotation Project 数据库(http://rice.plantbiology.msu.edu/)和maizeGDB数据库(http://www.maizegdb.org/)中进行扫描,下载该基因的RNA-seq FPKM 数据,并以此为根据对OsTS2和玉米TS2基因在不同组织器官和发育时期的表达模式进行分析。
1.2.2 MeJA处理后OsTS2与TS2基因的表达差异分析 从破口期开始,对粳稻日本晴的花序喷施浓度为2 mmol/L的MeJA(Sigma-aldrich公司),以1%的酒精溶液作为对照处理,每24 h喷施1次至开花前,取小穗提取RNA;从七叶期开始对玉米自交系B73的顶端(雄穗)和11叶期的侧枝(雌穗)喷施2 mmol/L的MeJA,1%酒精溶液作为对照处理。每72 h处理一次至雄穗和雌穗开花前停止喷施,取材提取RNA;RNA提取方法采用热酚法[13-14]。将提取的水稻和玉米总RNA,利用PrimerScriptTM反转录试剂盒(大连宝生物公司)反转录为cDNA,进行实时荧光定量PCR检测。
使用Beacon 7.7设计各基因的特异性引物 (表1),其中玉米内参基因为GAPDH,水稻内参基因为ACTIN1。使用Roche LightCycle480荧光实时定量PCR仪和RealMasterMix试剂盒(TIANGEN公司)进行检测。反应体系含有 RealMasterMix 4.5 μL,正、反向引物(3 μmol/L)各1 μL,cDNA模板10 ng,ddH2O 2.5 μL。程序设定为 94 ℃预变性90 s;94 ℃ 15 s,68 ℃ 60 s, 共40个循环,每个样品3次重复。按照基因相对表达分析2-ΔΔCt方法分析目的基因的相对表达量。

表1 实时荧光定量PCR引物
2 结果与分析
2.1OsTS2的生物信息学分析
2.1.1OsTS2的查找、比对及进化分析 由Blast比对分析得知,玉米TS2在水稻中的同源基因OsTS2为LOC_Os03g18740,两者之间氨基酸序列的同源性为84%。经过分子进化分析发现,OsTS2蛋白与假稻属(Leersiavirginica)TS2的亲缘关系最近(图1),彼此之间功能区氨基酸的序列同源性高达95%;玉米TS2与摩擦草属植物(Tripsacumdactyloides)的TS2亲缘关系最近,且处于另一个独立的小分支上(Clade),两者之间氨基酸序列的同源性高达97%。
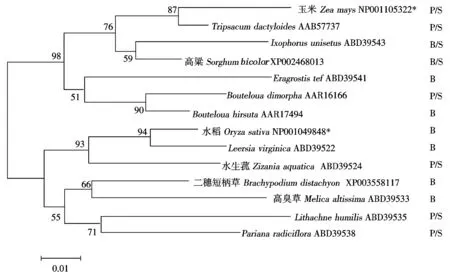
B.两性花; P.雌花; S.雄花 ; *.水稻TS2蛋白(NP001049848)和玉米TS2蛋白(NP001105322)。
假稻属是稻属最近缘的姐妹属,同为两性花植物。玉米及亲缘关系最近的摩擦草属同为单性花植物,但性别表现方式略有不同,玉米的雌花和雄花分别分布于独立的花序上,但摩擦草属植物的雌花和雄花却位于同一花序上[15]。此外,从图1可以看出,14个属植物TS2蛋白的分子进化关系与这些植物的性别表现模式(分别标注为B、P/S、B/S)并不是一致的,这表明TS2基因在一些植物中可能并不仅局限于抑制雌蕊发育的性别决定功能。因此,我们猜测作为两性花植物的水稻OsTS2可能具有其他功能。
2.1.2 OsTS2与玉米TS2蛋白序列的三维结构预测 SDR蛋白家族具有一个由2个保守基序(Motif)组成的沟状结构(Groove)(图2)。其中GxxGxG基序帮助SDR与辅酶NAD+结合来发挥酶促功能。该基序中的第1个甘氨酸(G)是严格保守的,且在主链上帮助形成一个急转角,进而决定基序中第2个甘氨酸的位置,此甘氨酸有助于主链与NAD+的二磷酸基团紧密接触以行使相关功能。另一个基序YxxxK中2个高度保守的氨基酸Tyr (Y)和Lys(K)对于SDR的催化功能非常重要[16]。
通过蛋白分析和三维结构预测,与玉米TS2一样,OsTS2也具有SDR家族典型的Groove结构特征(图2),并且它们的2个保守基序组成相同,均为GASGIG 和YTASK;2个催化活性氨基酸Tyr 和Lys分别位于OsTS2和玉米TS2蛋白的195/199、207/211位,其间隔均为3个氨基酸位点。这表明OsTS2和玉米TS2都属于典型的TS2是类的短链脱氢酶,它们可能作用于相同的催化底物。
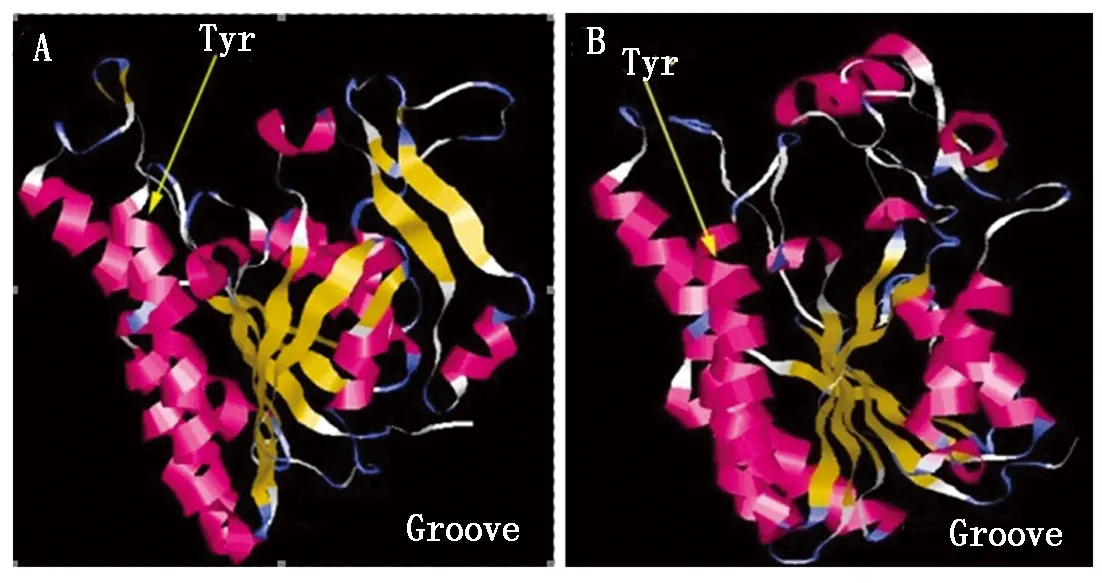
A.OsTS2蛋白三维结构; B.玉米TS2蛋白三维结构;Tyr标示位置为活性位点。
2.1.3OsTS2与玉米TS2基因的启动子区顺式调控元件分析 2个基因的启动子区域除了具有TATA等启动子的典型元件外,还都含有脱落酸(Abscisic acid,ABA)和MeJA响应元件(表2)。值得注意的是,OsTS2还具有玉米TS2所不具有的多种响应元件:如赤霉素、水杨酸以及乙烯等激素响应元件;低温、防御以及光周期反应元件。这些差异调控元件反映出OsTS2与玉米TS2可能存在不同的调控以及信号响应模式,进而存在功能上的歧化,即OsTS2可能不仅与花器官发育有关,还与植物激素信号转导以及逆境响应存在密切关系。
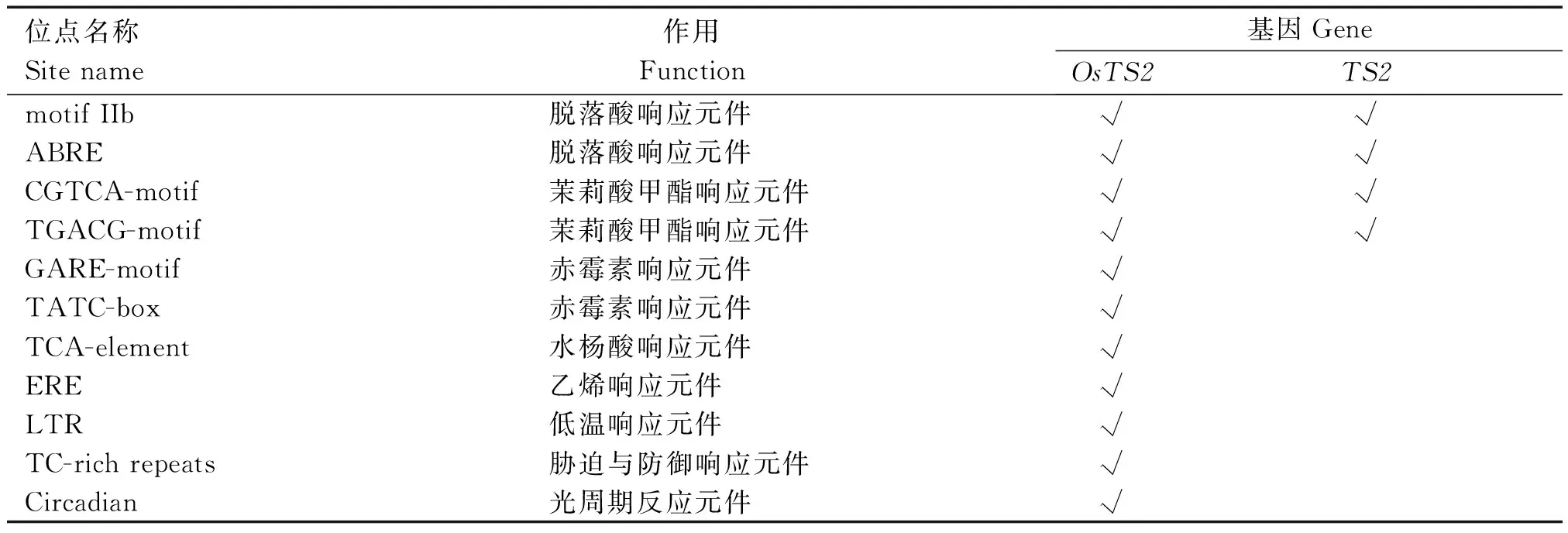
表2 OsTS2与玉米TS2启动子区顺式元件分析
2.2OsTS2的表达差异分析
2.2.1OsTS2基因和玉米TS2基因的组织表达模式分析 基因的表达往往与它所执行的功能密切相关。本研究分别对水稻营养生长期的嫩芽(Shoots,V1)、嫩叶(Leaves-20 days,V2)、抽穗前期的花序(Pre-emergence inflorescence,V3),抽穗期花序(Post-emergence inflorescence,R1)、花药(Anther,R2)、雌蕊(Pistil,R3)和种子成熟期的授粉后5 d的种子(Seed-5 DAP,S1)、授粉后25 d的胚(Embryo- 25 DAP,S2)以及玉米营养生长期的八叶期叶片(Eighth-leaf,V1)、13叶期叶片(Thirteenth-leaf,V2)、茎端分生组织(Stem-and-sAM,V3),生殖生长期的未成熟雄穗(Immature-tassel,R1)、花药(Anther,R2)、花丝(Silks,R3)和种子成熟期授粉后20 d的种子(Whole-seed-20DAP,S1)等器官中TS2基因的RNA-seq的表达数据进行了分析。结果表明,OsTS2在生殖器官中的表达量最高(图3-A),而玉米TS2基因主要在叶中高表达(图3-B)。从图3-A中可以看出,OsTS2在叶、花序、花药、雌蕊、种子等营养和生殖器官中均有所表达,但在抽穗期花序中的表达量最高,在花药、雌蕊以及授粉5 d的种子中的表达量都出现了降低的情况,这似乎表明OsTS2基因的高表达是为花序分化为两性花起作用。而玉米TS2基因的表达主要集中在营养生长时期的叶,特别是快要进入生殖生长分化期的叶片。八叶期的玉米是SAM从营养生长阶段分化转变为雄花序阶段的开始,玉米TS2基因在此时的表达量最高;13叶期的玉米开始分化雌花序,相对八叶期,TS2基因的表达未能在此时及此后成熟的花器官中维持高表达,这种表达模式印证了Delong、Calderon-Urrea等[6,16]的结果,即玉米TS2基因主要参与雄穗的性别决定建成过程。
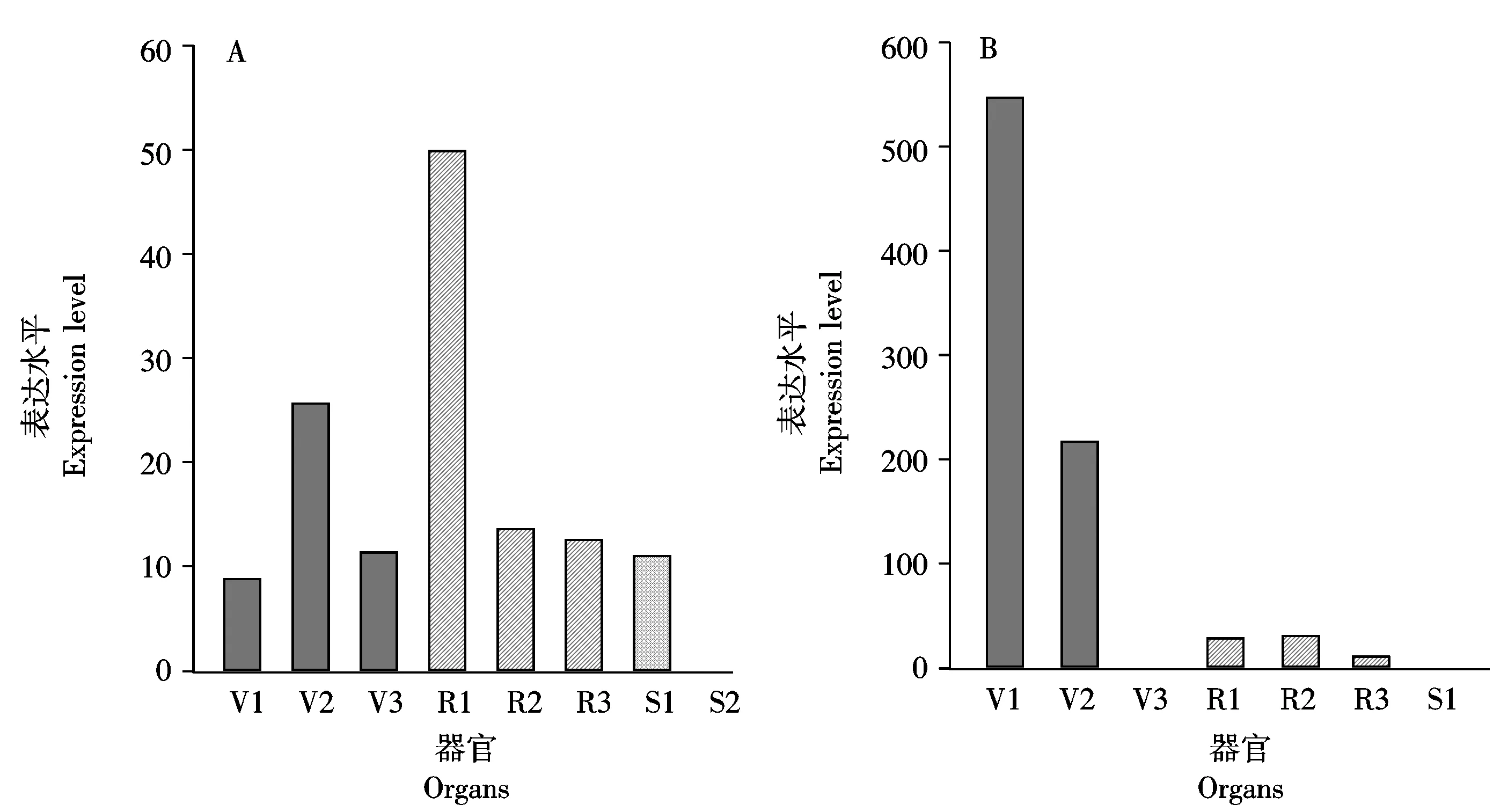
A.OsTS2基因在水稻组织器官的表达分析;B.玉米TS2基因在玉米组织器官的表达分析。
2.2.2 MeJA处理对OsTS2与玉米TS2基因表达的影响 玉米TS2基因是可能与JA有关的雄穗性别决定基因[5],为进一步探讨2个基因是否与MeJA信号转导有关,本研究通过实时荧光定量分析技术,初步对比分析了经外源MeJA处理后的水稻、玉米花序中TS2基因的表达量的变化。结果显示,经MeJA处理后水稻小穗中OsTS2基因的表达量显著提高,表达增加了近4倍(图4-A);而玉米TS2基因在雌穗(Ear)中几乎没有变化,在雄穗(Tassel)中的表达量变化也不明显(图4-B)。这种TS2基因表达变化的差异是与2个基因在2种植物中的功能差异有关,还是与它们与其他激素的复杂网络调控有关,有待于进一步通过其他试验来研究。
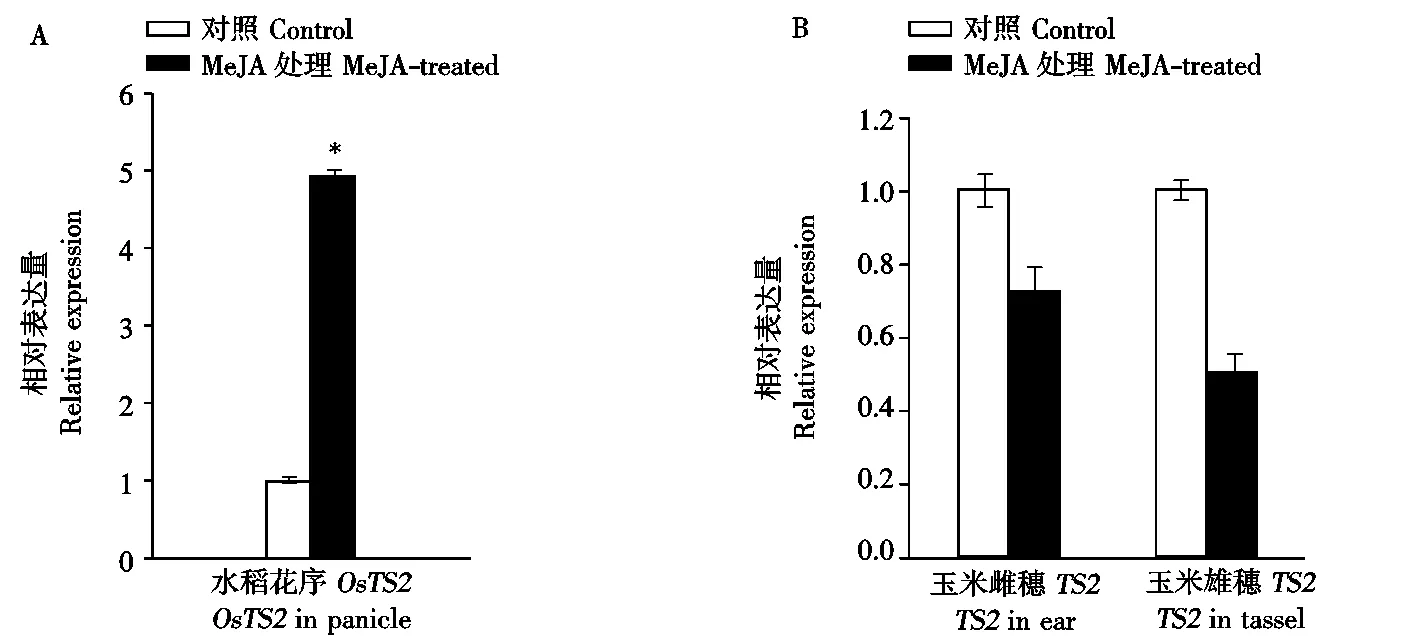
*.P<0.05。
3 讨论和结论
雌雄同株(Monoecy)的禾本科植物有多种复杂的性别表现模式,如雌花两性花型,即同时含有两性花和单性的雌花、雄花两性花型、两性花型、单性花型。禾本科植物在漫长的进化过程中多次发生两性花与单性花之间的转变,即使在亲缘关系最近的种属间,性别表现模式的变化也很大[17]。这种情况的产生可能是由于多种途径参与了不同谱系(Lineages)植物的性别表型模式的调控,其中任何一个途径的改变都可能使花器官发育模式发生改变。
TS2是最早在玉米中克隆的一个与JA合成有关的影响雄穗性别决定的基因,主要功能是抑制雄花中雌蕊的形成[6]。但TS2基因的序列、表达模式在一些禾本科中变化较大,与单性花的产生缺乏必然的联系,因此,Malcomber等[17]认为,TS2除了与黍亚科(Panicoideae) 植物单性花的产生有关外,可能在其他禾本科植物中还具有其他功能。本研究对包含水稻在内一些种属的T2基因的分子进化分析也发现,TS2基因的分子进化与植物单性花的产生之间并不存在特定的关联;通过对比单性花代表植物玉米和两性花代表植物水稻TS2基因的启动子元件、MeJA处理后TS2基因表达的变化可以看出,OsTS2和玉米TS2基因的表达调控可能存在差别,结合OsTS2的RNA-seq数据,初步认为OsTS2可能与玉米TS2存在功能歧化,OsTS2更可能参与JA、GA等激素的信号途径相关的雄蕊发育过程。
SDR家族成员众多,均含有2个保守的基序(Motif),GxxGxG基序和催化基序YxxxK。催化底物包括糖、乙醇、类固醇及芳香类复合物。目前TS2类SDR催化的底物尚不清楚,Calderon-Urrea等[16]认为可能是赤霉素或固醇类分子。由于玉米TS2和OsTS2的保守基序相同(均为GASGIG 和YTASK),这提示它们的催化底物可能是相同的,因此它们功能的差异可能是调控序列的差异所导致的。
在玉米和水稻TS2基因的启动子中均存在MeJA的反应元件。通过外源喷施MeJA,我们发现玉米TS2在雄穗中的表达降低不明显,但OsTS2基因的表达量明显升高。有研究表明在水稻花药的发育过程中,JA、GA可在激素水平上进行调控并存在一定的拮抗作用[18-20]。水稻OsTS2的启动子元件中除了存在MeJA的反应元件外,还存在GA、乙烯、水杨酸等元件,推测该基因可能由多种激素介导而起重要作用。
[1] 徐乾坤, 任德勇, 李自壮, 等.水稻小穗颖壳发育的研究进展[J].中国水稻科学,2016,30(1):99-105.
[2] Bortiri E,Hake S.Flowering and determinacy in maize[J].Journal of Experimental Botany,2007,58(5):909-916.
[3] Zhang J,Boualem A,Bendahmane A,et al.Genomics of sex determination[J].Current Opinion in Plant Biology,2014,18(1):110-116.
[4] Li Q,Liu B.Genetic regulation of maize flower development and sex determination[J].Planta,2017,245(1):1-14.[5] Browse J.Jasmonate:preventing the maize tassel from getting in touch with his feminine side[J].Science Signaling,2009,2(59):pe9.
[6] Delong A,Calderon-Urrea A,Dellaporta S L.Sex determination geneTASSELSEED2 of maize encodes a short-chain alcohol dehydrogenase required for stage-specific floral organ abortion[J].Cell,1993,74(4):757-768.
[7] Acosta I F,Laparra H,Romero S P,et al.tasselseed1 is a lipoxygenase affecting jasmonic acid signaling in sex determination of maize[J].Science,2009,323(5911):262-265.
[8] Simon T,Malcomber,Elizabeth A,et al.Evolution of unisexual flowers in grasses(Poaceae)and the putative sex-determination gene,TASSELSEED2(TS2) [J].New Phytologist,2006,4(170):885-899.
[9] Lebel-Hardenack S,Ye D,Koutnikova H,et al.Conserved expression of aTASSELSEED2 homolog in the tapetum of the dioeciousSilenelatifoliaandArabidopsisthaliana[J].The Plant Journal :for Cell and Molecular Biology,1997,12(3):515-526.
[10] 俞竹青, 朱 骏, 高菊芳, 等.水稻P0491E01基因调控花药发育的功能分析(简报) [J].分子细胞生物学报,2006,39(5):467-472.
[11] Cai Q,Yuan Z,Chen M,et al.Jasmonic acid regulates spikelet development in rice[J].Nature Communications,2014,5(5):3476.
[12] Zhang B,Wu S,Zhang Y,et al.A high Temperature-Dependent mitochondrial lipase EXTRA GLUME1 promotes floral phenotypic robustness against temperature fluctuation in rice (OryzasativaL.) [J].PLOS Genetics,2016,12(7):e1006152.
[13] Kinney M S,Columbus J T,Friar E A.Molecular evolution of the maize sex-determining geneTASSELSEED2 inBouteloua(Poaceae) [J].Molecular Phylogenetics and Evolution,2003,29(3):519-528.
[14] 朱 昀, 王 猛, 贾志伟, 等.一种从富含多糖的玉米幼穗中提取RNA的方法[J].植物学通报,2007,24(5):624-628.
[15] Li D,Blakey C A,Dewald C,et al.Evidence for a common sex determination mechanism for pistil abortion in maize and in its wild relativeTripsacum[J].Proceedings of the National Academy of Sciences of the United States of America,1997,94(8):4217-4222.
[16] Calderon-Urrea A C,Dellaporta S L.Cell death and cell protection genes determine the fate of pistils in maize[J].Development,1999,126(3):435-441.
[17] Malcomber S T,Kellogg E A.Evolution of unisexual flowers in grasses (Poaceae) and the putative sex-determination gene,TASSELSEED2 (TS2)[J].The New Phytologist,2006,170(4):885-899.
[18] Chen Y,Tan B C.New insight in the Gibberellin biosynthesis and signal transduction[J].Plant Signaling & Behavior,2015,10(5):e1000140.
[19] Song S,Qi T,Huang H,et al.Regulation of stamen development by coordinated actions of jasmonate,auxin,and gibberellin inArabidopsis[J].Molecular Plant,2013,6(4):1065-1073.
[20] Song S,Qi T,Wasternack C,et al.Jasmonate signaling and crosstalk with gibberellin and ethylene[J].Current Opinion in Plant Biology,2014,21:112-119.
The Divergent Role of Sex Determination GeneTASSELSEED2 in Rice
GUO Yingying1,HOU Zhipeng1,ZHONG Ming1,CHEN Lijing1,MA Hui1,ZHANG Li1,XU Zhengjin2,LI Haoge1
(1.Bioscience and Technology College,Shenyang Agricultural University,Key Laboratory of Agricultural Biotechnology of Liaoning Province,Shenyang 110866,China;2.Key Laboratory of Northeast Rice Biology and Breeding,Ministry of Agriculture,Shenyang 110866,China)
The development of floral organs is crucial for the production of crops,in which the formation of unisexual flowers by sex-determination is one of the important theoretic issues.TheTASSELSEED2 gene is a JA-synthesis gene which regulates the formation of staminate flower in maize.Previous studies showed thatTS2 genes of grasses might adopt new or divergent functions during evolution.In order to get insights into the divergent role ofTS2,compared the protein structure of rice TS2 with maize TS2 by bioinformatic tools.The results showed thatOsTS2 encodes a typical SDR protein which contains a conserved GASGIG motif and YTASK motif.The substrate catalyzed by OsTS2 protein was also predicted to be similar with that by maize TS2 protein.Further examined the expression pattens ofOsTS2 and maizeTS2 in different tissues.RNA-seq data showed thatOsTS2 mainly expressed in the inflorescence of rice.In accord with JA and other hormone regulatory elements found in the promoter ofOsTS2,the increased expression ofOsTS2 was obviously observed by qPCR in MeJA-treated rice.Whereas,the expression of maizeTS2 was mainly detected in 8-leaf stage of maize rather than in inflorescence,and its expression was not affected by exogenous methyl jasmonate.Taken together,these results provide a clue thatOsTS2 might recruit a divergent role during evolution.
Rice; Maize;TS2; Methyl jasmonate
2017-03-29
国家自然科学基金项目(31071422)
郭盈盈(1994-),女,河南商丘人,主要从事生物技术研究。
李浩戈(1972-),女,辽宁沈阳人,副教授,博士,主要从事植物发育与功能基因组研究。
Q786
A
1000-7091(2017)03-0007-06
10.7668/hbnxb.2017.03.002
——植物学教材质疑(六)

