地高辛标记对旱稻进行southern杂交分析主要影响因素的优化和验证
邢文岳++苏乐乐++李朝炜++魏景芳++朱昀

摘要:以转基因旱稻和野生型旱稻为材料,对通过地高辛随机引物标记法进行的旱稻基因组Southern杂交条件进行了优化分析,包括探针制备效率、DNA样品量、酶切体系及转膜时间等。结果表明:影响探针制备效率的首要因素是温度而不是时间;DNA上样量在10~30 μg均可以获得高质量的杂交图;60 μL体系15 h即可酶切彻底并获得良好的杂交效果;转膜时间6 h即可。本研究所优化的地高辛标记的旱稻杂交分析结果稳定重复性好,具有较高的灵敏度和信噪比。
关键词:旱稻;地高辛;Southern杂交方法;优化;验证
中图分类号: S511.01文献标志码: A文章编号:1002-1302(2017)08-0041-03
Southern blotting 技术于1975年由英国科学家Southern创立,随着该技术的不断发展与普及,目前已成为分析基因结构和检测特定DNA片段的经典技术方法之一[1]。该技术能够在DNA水平检测外源目的基因是否已经转入并成功整合到植物的染色体上,同时对外源片段的拷贝数目进行分析。目前,Southern杂交中标记探针的方法有同位素和非同位素2种。使用同位素标记是最经典的方法,其灵敏度高,能检测出极其微量的信号源,但对试验的条件有比较严格的要求,且会对环境以及实验者的身体造成放射性辐射危害。非同位素标记又分为生物素标记和地高辛标记。由于生物体中并没有地高辛,所以相比于生物素而言,地高辛可以更好地消除内源性背景,应用前景也更为广阔[2]。据报道,棉花[3]、烟草[4]、小麦[5]、油菜[6]、甘蔗[7]、橡胶树[8]、热带果树[9]等植物用地高辛标记的杂交技术均可获得良好的杂交效果。
目前,虽然有地高辛标记探针试剂盒大大方便了试验,但是试剂盒说明书更多地侧重于步骤流程的描述,至于一些技术要点、操作细节、实验注意事项的介绍并不很多。这也直接导致许多试验没能得到满意的结果。本研究以8个不同的LEA家族抗逆旱稻品种为材料,参考前人成功经验,结合本实验室的实际情况,对地高辛标记探针的Southern雜交方法进行探索改进和优化,取得了理想效果,现作一总结。
1材料与方法
1.1试验材料
转基因的T3代旱稻由本实验室通过农杆菌侵染法获得。
1.2试验方法
1.2.1探针标记反应管中加1 μg纯化的目的基因DNA片段,加ddH2O至终体积16 μL。沸水浴10 min变性,迅速插入冰水混合物中,取混匀的地高辛高效引物4 μL到变性的DNA中,混匀,37 ℃孵育20 h。加入2 μL 0.2 mol/L EDTA(pH值8.0)或65 ℃加热10 min终止反应。
1.2.2旱稻基因组DNA的提取及纯化采用改良的CTAB[10]法对旱稻基因组进行提取,略加改动。65 ℃预热 15 mL 提取缓冲液[CTAB 30 mg/mL,NaCl 1.4 mol/L,EDTA(pH值8.0)20 mmol/L,Tris-HCl(pH值8.0)100 mmol/L,β-巯基乙醇0.2%(V/V)];液氮研磨2.5 g植物叶片成粉末后刮入离心管的提取缓冲液中,65 ℃保温40~60 min,每 10 min 轻取出轻摇混匀;加入等体积的酚/氯仿/异戊醇,充分混匀,静置15 min,12 000 r/min离心15 min;转移上清至一新的Eppendorf管,加等体积的氯仿/异戊醇,混匀10 min,静置10 min,12 000 r/min离心10 min;将上清液转移到新的离心管中,加1倍体积的异丙醇,混匀;-20 ℃放置1 h或过夜,将絮状沉淀转移至一新的离心管中,70%乙醇洗涤,无水乙醇洗涤,吹干溶解;加入适量RNase对样品进行消化,之后分别用酚/氯仿/异戊醇以及氯仿/异戊醇抽提1次,乙醇洗涤沉淀,超净台上吹干,溶于适量TE。用分光光度计测定样品DNA浓度以及D260 nm/D280 nm比值。
1.2.3样品酶切60 μL酶切体系中含30 μg纯化的旱稻DNA,250U限制性内切酶(Thermo),6 μL 10×buffer,补ddH2O至终体积60 μL。酶切15 h后取2 μL电泳,观察旱稻基因组是否酶切彻底。
1.2.4转膜及固定酶切充分的DNA加loading buffer混匀,80 V电泳约4 h,直至溴酚蓝位于凝胶的2/3处。电泳结束后凝胶不做脱嘌呤处理,经NaOH碱变性后参照分子克隆采用毛细管虹吸印迹法转膜,注意为了分清膜的正反面,要在尼龙膜的一角提前做好标记。将转膜之后的琼脂糖凝胶进行检测,若无核酸残留,证明转膜成功。将尼龙膜80 ℃烘烤2 h进行核酸的固定。
1.2.5杂交洗涤将探针沸水浴5 min进行变性,之后快速放入冰水混合物中冷却,按照25 ng/mL杂交液的量将变性探针加入预热的杂交液中。预杂交30 min后将预杂交液更换成带有探针的杂交缓冲液,45 ℃杂交16 h。2×SSC、0.1% SDS室温洗膜5 min,之后0.5×SSC、0.1% SDS 68 ℃洗膜 15 min。
1.2.6免疫检测将洗涤过的杂交膜用洗涤缓冲液冲洗 5 min,封阻液孵育30 min,抗体溶液孵育30 min,接着用洗涤缓冲液漂洗2次,每次15 min,检测缓冲液中平衡5 min,避光条件在显色液中静置显色20 min。染色完成后ddH2O冲洗杂交膜5 min,晾干拍照即可。
2结果与分析
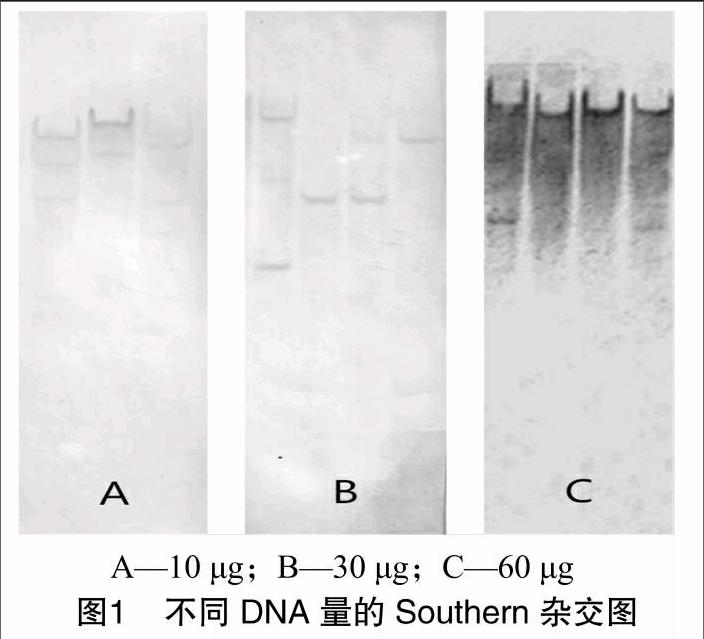
2.1转膜DNA样品量对杂交结果的影响
为了获得较强的杂交信号,分别以10、30、60 μg的DNA量进行杂交。结果显示,DNA上样量并非越多越好,高质量的DNA样品在10 μg的时候也能够得到很好的杂交信号,30 μg 的上样量同样可以洗脱干净,而样品量过大形成的较深背景难以在洗脱阶段处理干净(图1)。
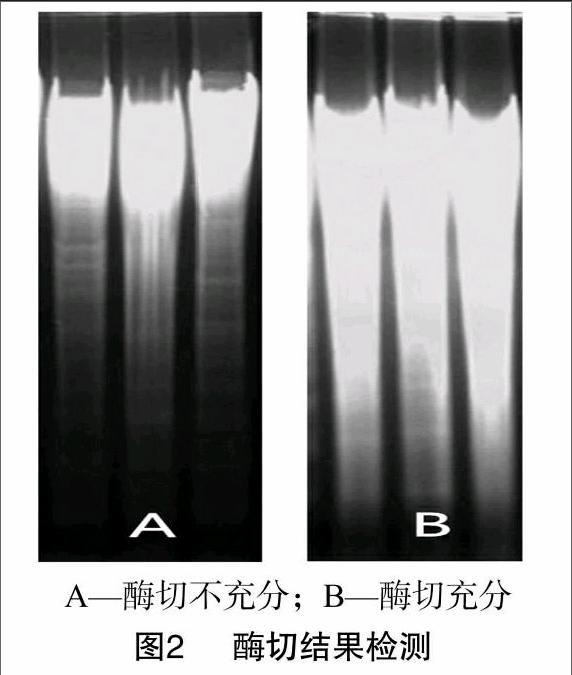
2.2酶切体系对杂交结果的影响
选择目标基因内不存在的3个常用限制性酶EcoRⅠ、XbaⅡ、SacⅠ消化转基因旱稻植株的基因组。30 μg的DNA量在60 μL酶切体系中需15 h才可获得好的酶切结果,时间较短会导致酶切不充分(图2),影响杂交结果,甚至出现非特异性杂交条带。酶切后如果进一步纯化,会造成DNA量的损耗,而前期获得的纯度高、质量好的DNA酶切消化后可以直接转膜用于后续杂交试验。
2.3探针标记效率的影响因素
探针标记效率对杂交有着重要的影响。而标记效率就试剂盒说明书描述和时间相关度并不很大,以3 000 ng模板DNA为例,标记1 h可获得1 350 ng探针,而当标记时间延长到20 h后获得的探针也只有2 650 ng,因此时间并不是探针标记效率的主要影响因素。本试验发现,标记初期的温度对标记效率有绝对的影响。刚刚进行标记的反应体系要严格遵守标记温度,标记初期的温度不准确会导致最终的标记效率大幅度降低。如图3所示,A图为严格遵守孵育温度37 ℃的
探针标记效率检测:第1排为对照样品,浓度从左到右依次为1 ng、10 pg、3.3 pg、1 pg、0.3 pg、0.1 pg;第2排为试验样品,从左到右依次进行梯度稀释,第3排为试验样品的重复,稀释浓度同第2排相应位置的点。B图为标记初期温度略低的探针标记效率检测(32 ℃进行):第1排为对照样品,浓度从左到右依次为1 ng、10 pg、3.3 pg、1 pg、0.3 pg、0.1 pg;第2排为试验样品,依次进行梯度稀释,第3排为试验样品的重复,稀释浓度同第2排相应位置的点。A、B 2张图中试验样品的稀释梯度完全相同。由图3还可见,A图中8号点的量与4号点的量相等,均为0.1 pg;B图中6号点的量与B图中4号点的量相等,均为0.1 pg,而A图点8和B图点6的稀释倍数相差100倍。由此可见温度对标记效率的影响极大,探针标记初期5 ℃的浮动导致2次探针标记效率相差有100倍之多。标记后的探针不需要纯化即可用于后续试验。
2.4转膜时间的控制
以往的试验为了保证充分转膜都是采用过夜转膜,但过夜转膜耗时较长,延长了整个试验的时间,影响了试验进度。在转膜时分别对2、4、6、8 h的转膜情况进行了观察,发现转膜时间在6 h的时候,琼脂糖凝胶上面已经看不到DNA片段(图4),表明转膜已经完全,大大缩短了整个试验的时间。
2.5杂交温度的选择
适宜的杂交温度是根据GC含量和探针与靶片段的相似百分数计算获得的,具体公式如下:Tm=49.82+0.41(%G+C)-(600/I),I=能够杂交上的片段的长度,以碱基对进行计算。Topt.=Tm-(20~25 ℃)。本试验%G+C=53.7,I=806,Tm=49.82+0.41(%G+C)-(600/I)=71.1。计算结果Topt.=46.1~51.1 ℃。由于说明书建议杂交在37~42 ℃
进行,因此我们在37、42、45 ℃均进行了杂交,差别不大。最终杂交选择在45 ℃进行。
2.6显色液对结果的影响
地高辛杂交试剂盒里面的显色液(5号管)平时贮藏在 -20 ℃ 的冰箱中,一般情况下底部会出现棕褐色颗粒状沉淀,配制显色液时要事先吹吸数次混匀。需要注意的是沉淀悬浮起来后不要立即使用,一定要使颗粒完全溶解,在溶液中看不到有颗粒状物质,溶液均匀清澈为止。否则杂交膜的背景颜色较深,且呈现颗粒状(图5),严重影响结果的观察。
3讨论
阳性对照是杂交体系中的重要组成部分。以质粒为模板进行PCR扩增的产物作为阳性对照。转膜时的电泳上样量并非越多越好,样品量过大容易出现非特异条带,试验显示不超过50 ng的纯化后的PCR产物可以获得良好的杂交效果。
尼龙膜在杂交中应尽量与杂交管贴合,不要有气泡出现,否则会严重影响杂交结果。一般赶走气泡的工具采用玻璃棒,将膜小心放入有杂交液的杂交管中后用玻璃棒仔细赶走杂交膜与杂交管之间的气泡。由于杂交液中成分的影响,杂交膜与杂交管之间经常出现大量的微小气泡,很难彻底驱赶干净,并在此操作过程中对杂交膜和转移的DNA样本造成伤害,严重影响杂交结果(图6)。本试验采用宽底试管去挤压膜与管之间的气泡,由于试管底面积宽,不易对膜造成损伤,可以获得良好的杂交效果。
杂交中,足够的探针用量是保证杂交成功的必要条件。但是,过量的探针会导致背景颜色过重,难以洗涤干净。说明书中建议探针使用量为25 ng/mL杂交液,为了获得更清晰的
杂交结果,笔者做了不同探针用量的杂交。试验结果显示,探针浓度提高到50 ng/mL杂交液时对杂交背景影响不大,仍然可以获得清晰背景的杂交条带。
以往报道认为,农杆菌侵染法进行的植物转化,转入基因多以单拷贝或较低拷贝数插入[11-13],在本试验中,进行了8个样品的Southern杂交分析,仅有2个样品鉴定为单拷贝,其余6个样品中最多甚至出现了8个拷贝。这说明对于农杆菌侵染法获得的转基因植株后代而言,低拷贝并不是绝对的,可能与愈伤组织的状态、侵染条件都有一定关系。
参考文献:
[1]Southern E M. Detection of specific sequences among DNA fragments separated by gel electrophoresis[J]. Journal of Molecular Biology,1975,98(3):503-517.
[2]Kruchen B,Rueger B.The DIG system-nonradioactive and highly sensitive detection of nucleic acids[J]. Biochemia,2003,7(3):13-15.
[3]周長发,张锐,张晓,等. 地高辛随机引物法标记探针的Southern杂交技术优化[J]. 中国农业科技导报,2009,11(4):123-128.
[4]梁海泳,夏秀英,高晓蓉,等. 反义4CL与UGPase双价基因在烟草中的转化及表达分析[J]. 植物学通报,2007,24(4):459-464.
[5]刘禄,牛焱焱,雷昊,等. 基于地高辛标记对小麦进行杂交分析主要影响因素的优化和验证[J]. 植物遗传资源学报,2012,13(2):182-188.
[6]刘烜,郑文杰,赵卫东,等. 转基因油菜地高辛标记探针杂交检测方法的建立[J]. 口岸卫生控制,2005,10(4):10-12.
[7]崔学强,张树珍,沈林波,等. 转基因甘蔗植株Southern杂交体系的优化[J]. 生物技术通报,2015,32(12):105-109.
[8]李季,鲁旭,黄天带,等. 橡胶树转基因植株Southern杂交体系的优化[J]. 生物技术通报,2014(8):76-81.
[9]彭军,曾凡云,龙海波,等. 热带果树基因组提取方法的改良及分析[J]. 热带生物学报,2012,3(3):252-257.
[10]陈昆松,李方,徐昌杰,等. 改良CTAB法用于多年生植物组织基因组DNA大量提取[J]. 遗传,2004,26(4):529-531.
[11]杨晓杰,刘传亮,张朝军,等. 不同转化方法获得的转基因棉花外源基因拷贝数分析[J]. 农业生物技术学报,2011,19(2):221-229.
[12]程在全,黄兴奇. 基因枪法和农杆菌介导法对水稻转基因拷贝数和基因重排概率的影响[J]. 植物学报,2001,43(8):826-833.
[13]龙丹凤. 农杆菌及基因枪法介导的BAR基因在高羊茅中的遗传转化效率研究[D]. 兰州:甘肃农业大学,2008:42-45.

