22q11.2微缺失伴先天性心脏病的诊断技术研究
蒋华景+陈静+林丽璇

[摘要]目的 探讨荧光原位杂交技术(FISH)联合超声心动图对诊断22q 11.2微缺失伴先天性心脏病的临床价值。方法 于2013年1月~2014年12月选择62名具有高危妊娠指征的孕妇,应用FISH技术检测22q 11.2微缺失,并以超声心动图明确诊断。结果FISH检出5例22q 11.2微缺失,超声心动图检查结果3例为法洛四联症,2例为室间隔缺损。57例无22q 11.2微缺失的胎儿超声心动图检查结果三尖瓣轻度反流2例、肺动脉狭窄2例、动脉导管未闭1例。22q 11.2微缺失组与无微缺失组胎儿超声心动图表现异常率分别为100.00%和8.77%,差异有统计学意义(χ2=28.28,P<0.01)。结论FISH技术检测胎儿22q 11.2微缺失,并配合超声心动图对心脏畸形进行明确检查,临床应用价值较高,值得推广应用。
[关键词]荧光原位杂交技术;超声心动图;22q 11.2微缺失;先天性心脏病
[中图分类号] 714.43+1 [文献标识码] A [文章编号] 1674-4721(2017)05(c)-0062-04
[Abstract]Objective To discuss the clinical value of fluorescence in situ hybridization (FISH) combined with ultrasonic cardiogram on 22q 11.2 microdeletion accompanied with congenital heart disease (CHD).Methods A total of 62 high risk pregnant women from January 2013 to December 2014 were chosen.The FISH technique was applied to detect 22q 11.2 microdeletion,and ultrasonic cardiogram was used to diagnose clearly.Results Five fetuses with 22q 11.2 microdeletion were detected,from whom 3 fetuses were diagnosed as tetralogy of Fallot,and 2 fetuses were diagnosed as ventricular septal defect.The ultrasonic cardiogram showed that 2 fetuses with tricuspid regurgitation slightly,2 fetuses with pulmonary stenosis and 1 fetus with patent ductus arteriosus were detected in 57 fetuses without 22q 11.2 microdeletion.Abnormality rate in group with 22q 11.2 microdeletion and group without 22q 11.2 microdeletion was 100.00% and 8.77% respectively,and difference was statistically significant (χ2=28.28,P<0.01).Conclusion Detecting 22q 11.2 microdeletion with FISH technique and diagnosing clearly CHD with ultrasonic cardiogram has high clinical application value and it is worthy of clinical promotion and application.
[Key words]Fluorescence in situ hybridization;Ultrasonic cardiogram;22q 11.2 microdeletion;Congenital heart disease
先天性心臟病(congenital heart disease,CHD)是临床常见的胎儿先天性畸形,发病率为活产婴儿的3‰~8‰[1],也是目前婴幼儿死亡的主要病因之一。CHD的发病受遗传和环境等多种因素影响,目前研究表明,染色体22q 11.2微缺失与CHD关系密切,22q 11.2微缺失可以引发心脏缺陷,同时伴有唇裂/腭裂、胸腺发育不良、面容异常等先天畸形,因此被称为22q 11.2微缺失综合征。22q 11.2微缺失综合征作为人类最常见的染色体缺失综合征之一,发病率为1/4 000~1/6 000[2],且75%~80%的22q 11.2微缺失微缺失病例可合并各种类型的CHD[3-5]。本研究采用荧光原位杂交(fluorescence in situ hybridization,FISH)技术,对临床疑似妊娠22q 11.2微缺失综合征胎儿的高危孕妇进行产前检测22q 11.2基因微缺失,并以彩色超声心动图明确诊断,旨在对胎儿进行早期干预,并提高22q 11.2微缺失伴先天性心脏病的诊断技术。
1对象与方法
1.1研究对象
选择2013年1月~2014年12月在本院产前检查并检测22q 11.2微缺失的高危孕妇62例,孕妇年龄28~43岁,平均(36.35±4.62)岁,胎龄13~33周,平均(23.64±4.28)周。根据妊娠周数,11~14周行绒毛穿刺3例,17~24周行羊膜腔穿刺23例,>24周行脐带血穿刺36例。62名孕妇以往均引产或分娩过CHD或唇腭裂等面部畸形胎儿。所有研究对象均签署知情同意书,研究获医院伦理委员会批准。
1.2 试剂与仪器
FISH诊断试剂盒(购自北京金菩嘉医疗科技有限公司),胶原酶B、RNase A酶、胃蛋白酶(均购自美国Sigma公司)。国产长风恒温水浴箱、奥林巴斯BX51型荧光显微镜。
1.3 FISH检测
根据孕龄取羊水10 ml、脐血2 ml或绒毛3~4枝,采用FISH诊断试剂盒,对标本22号染色体TUPLE1基因的微缺失进行检测。GLP TUPLE1/GLP ARSA为待检测的基因,TUPLE1:22q 11和ARSA:22q 13为探针的位点,其荧光信号分别为桔红色和绿色,彼此互为内对照探针。严格按试剂盒说明进行操作,分别进行滴片、干燥、变性、杂交、后洗、染色和镜检等操作。如果TUPLEl探针与22q 11.21成功杂交,显示桔红色的荧光信号(四甲基罗丹明);如果ARSA基因探针与22q 13.31成功杂交,则出现绿色的荧光信号(细胞绿)。TUPLE1和ARSA基因互为内对照。在奥林巴斯BX51型荧光显微镜下对杂交信号进行观察,使用FISH VIDEOTEST 2.0软件分析。FISH信号的评价规则:有效标本为细胞膜完整且细胞杂交率80%,对每份样本随机分析100个处于分裂中期状态的细胞,22号染色体在细胞内呈绿色荧光,如果22q 11无缺失,22号染色体上应该还可显示2个桔红色荧光信号;如果只有1个桔红色荧光信号,提示22q 11.2存在微缺失。若荧光信号正常的细胞≥90%,则胎儿染色体可诊断正常;若荧光信号异常的分裂状态细胞>60%,FISH检查结果阳性,提示胎儿存在22q 11.2微缺失。
1.4超声心动图检查
参照“ISUOG 胎儿心脏筛查指南”[6],超声诊断仪为GE E8型。确认胎儿心脏方位后,在胎儿腹部横切面,依据下腔静脉、胃、腹主动脉等结构对心脏位置是否正常进行判断;然后用超声心动图对胎儿三血管气管的横截面、三血管的横截面、左右室流出道的横截面及四腔心横截面筛查胎儿CHD。
1.5统计学方法
数据采用SPSS 18.0统计学软件进行分析,计数资料采用χ2检验,并采用配对McNemar检验比较两种诊断方法的差异,以P<0.05为差异有统计学意义。
2结果
2.1 FISH 法检测22q 11.2微缺失结果
62例高危孕妇中,共57例FISH检测结果为>90%的细胞内有2个绿色荧光、2个桔红色荧光信号,提示22q 11.2无微缺失。5例有60%以上细胞出现了2个绿色荧光、1个桔红色荧光信号,提示存在22q 11.2微缺失。
2.2 超声心动图结果
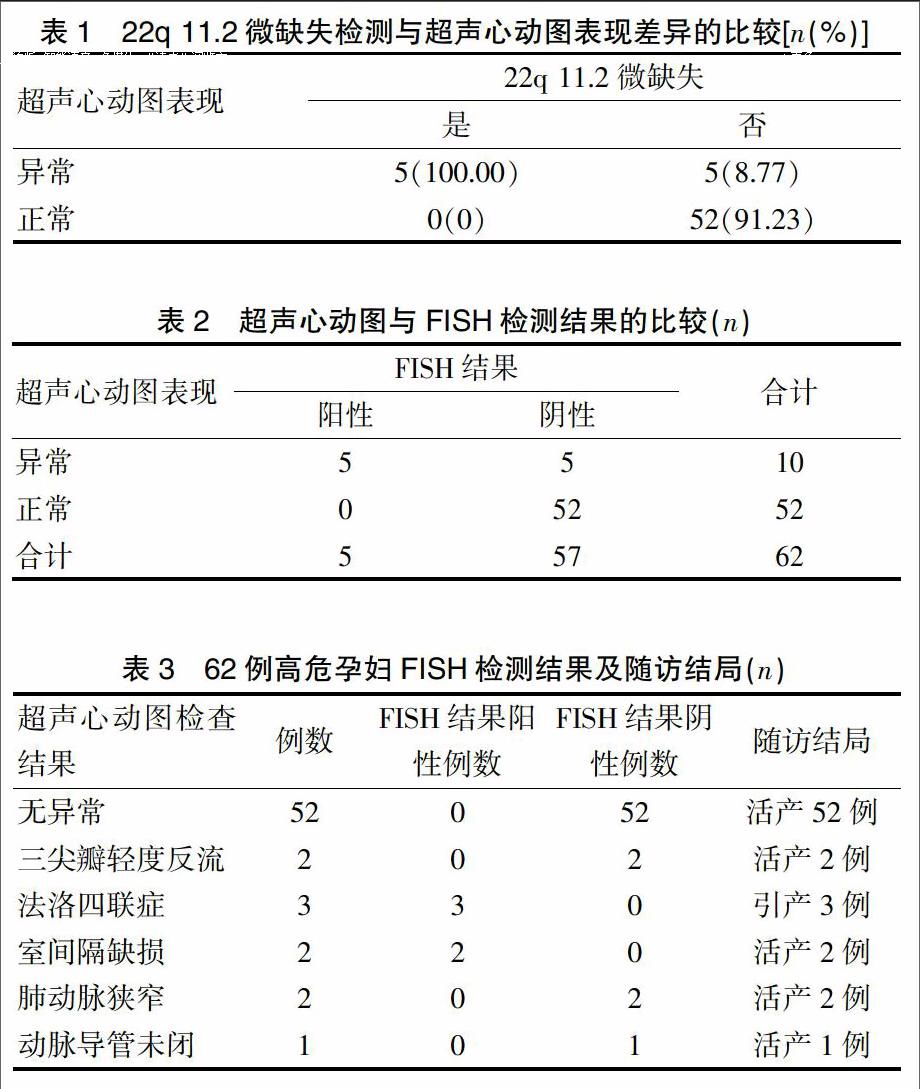
5例22q 11.2微缺失胎儿超声心动图检查结果3例为法洛四联症(图1),2例为室间隔缺损。而57例无22q 11.2微缺失的胎儿超声心动图检查结果三尖瓣轻度反流2例、肺动脉狭窄2例、动脉导管未闭1例,22q 11.2微缺失胎儿超声心动图表现为100.00%异常,而无22q 11.2微缺失的胎儿超声心动图表现异常率为8.77%,两组差异有统计学意义(χ2=28.28,P<0.01)(表1)。FISH和超声心动图诊断结果的配对χ2检验显示2种方法对胎儿心脏异常诊断的差异无统计学意义(χ2=5.00,P=0.06)(表2)。在FISH检测结果和超声心动图结果出来后,对于确诊为法洛四联症的3例胎儿,在孕妇及其家属同意的情况下行引产手术,其他胎儿在征得孕妇及其家属的同意下均活产,随访结局情况见表3。
3讨论
CHD的发病率近年来呈增高趋势,但其发病机制目前仍未完全明了。大部分观点认为CHD是受遗传和环境影响的多基因遗传病,其中染色体畸变是出现CHD的主要病因,胎儿发育过程中极轻微的染色体畸变也能使附近的基因出现异常,并使心脏以及心外器官的发育受到影响,从而出现CHD和心畸形。而22q11.2微缺失综合征是目前少数得到确认的致CHD的染色体畸变之一。Hartman等[7]的研究显示CHD患儿中22q 11.2微缺失的发生率为12.2%。22q 11.2微缺失主要为染色体减数分裂之后重组时发生的异常与不对称导致,微缺失大小为1.5~3 Mb,缺失区域处于D22S306/308与D22S427/1638间。活产儿中22q 11.2的发生率约为1/4 000[8]。22q 11.2微缺失综合征已经被确认为除外唐氏综合征的导致CHD的最为多见的遗传因素。22q 11.2微缺失综合征患者临床表现为CHD、唇腭裂、面部畸形、免疫缺陷等,而CHD中发生率较高的主要为法洛四联征、主动脉弓离断、室间隔缺损、共同动脉干等,患儿的生长发育、学习认知能力都会出现异常或迟缓[9-11],对其预后和生活质量带来严重的不利影响。
研究显示22q 11.2微缺失综合征的主要致病基因为TUPLE1基因,它的畸变或缺失是引起CHD的主要原因之一[12]。FISH技术通过特异性探针与细胞杂交对TUPLE1基因进行检测,能对胎儿是否发生22q 11.2 微缺失进行准确的诊断。FISH检测不需要细胞培养,能适用于细胞周期的各个时期,具有标本采集后可立即检测的优点,能在染色体原位显色,定位精准直观,结果判断时只需对细胞进行计数、辨认是否有杂交信号,具有高度的灵敏性和特异度,成为临床染色体微缺失检测的金标准之一[13]。
染色体异常与胎儿的发育畸形,特别是CHD的发生密切相关。心脏超声检查能够清晰直观地显示胎儿心脏图像,通过将胎儿心脏的扫查切面从四腔心切面扩展到更多的标准切面,使心脏畸形的检出率大为提高,因此超声心动图是诊断胎儿CHD的可靠方法[14-15]。染色体畸变常伴基因异常或缺失,因此,心脏畸形或心外畸形较为多發。研究显示CHD胎儿的染色体异常发生率为25%~30%,而当合并有心外畸形时染色体异常发生率可高达40%[16]。通过产前的FISH检查对胎儿进行22q 11.2微缺失的检测,并结合心脏超声影像学检查,对提高CHD的产前诊断有显著的临床意义。本研究对62例高危孕妇进行FISH检测,检出5例22q 11.2微缺失,22q 11.2微缺失胎儿的超声心动图均显示有心脏畸形,其中法洛四联症3例,室间隔缺损2例;而57例无22q 11.2微缺失的胎儿超声心动图检查心脏畸形率为8.77%,两组差异有统计学意义,说明22q 11.2微缺失与胎儿CHD的发生有较大的相关性,与闫亚妮等[17]的研究相似,同时也提示CHD是环境因素与多基因遗传共同影响的结果,CHD的病因还需更深入的研究。应用FISH技术检测22q 11.2微缺失,所需样本量少、且操作简便,具有灵敏度高、特异性强的特点。随着标记技术和探针制备的发展,FISH技术对临床胎儿CHD检测的应用价值将进一步得到体现[16]。
本研究显示,对高危孕妇进行FISH检测以筛查22q 11.2微缺失,并结合超声心动图检查以明确诊断,以减少和避免22q 11.2微缺失综合征的患儿出生,降低围生儿病死率,提升人口素质,值得临床进一步推广应用。
[参考文献]
[1]肖蕾,王玲.产前超声诊断胎儿先天性心脏病的研究进展[J].安徽医药,2013,17(8):1416-1417.
[2]Zhang Y,Zhi Z,Jiang T,et al.Spherical mesoporous silica nanoparticlesfor loading and release of the poorly water-solubledrug telmisartan[J].J Control Release,2010,145(3):257-263.
[3]Zhao P,Jiang H,Jiang T,et al.Inclusion of celecoxib into fibrousorderedmesoporous carbon for enhanced oral bioavailabilityand reduced gastric irritancy[J].Eur J Pharm Sci,2012, 45(5):639-647.
[4]龚启华,杨一峰,赵天力,等.22q11.2微缺失在贵州少数民族先天性心脏病患者中的研究[J].贵州医药,2016,40(4):351-353.
[5]Bretelle F,Beyer L,Pellissier MC,et al.Prenatal and post-natal diagnosis of 22q11.2 deletion syndrome[J].Eur J Med Genet,2010,53(6):367-370.
[6]Carvalho JS,Allan LD,Chaoui R,et al.ISUOG practice guidelines(updated):sonographic screening examination of the fetal heart[J].Ultrasound Obstet Gynecol,2013,41(3):348-359.
[7]Hartman RJ,Rasmussen SA,Botto LD,et al.The contribution of chromosomal abnormalities to congenital heart defects:a population-based study[J].Pediatr Cardiol,2011,32(8):1147-1157.
[8]李胜利.胎儿先天性心脏病的筛查和诊断[J].中国实用妇科与产科杂志,2010,26(12):920-922.
[9]黄汉钦,冷永群,赵良桥,等.先天性心脏病患者开胸术后心电图分析[J].实用心电学杂志,2015,24(5):341-342,368.
[10]余秀明,吕航,刘鸣,等.法洛四联症术后心电变化一例[J].实用心电学杂志,2017,26(1):68-71.
[11]张伟强,刘树均,罗宇萍,等.先心封堵术后并发三支阻滞心电图演变一例[J].实用心电学杂志,2017,26(2):144-145,147.
[12]孙晓燕,王云英,瓮占平,等.TUPLE1 基因缺失在先天性心脏病发病机制中作用的研究[J].中国优生与遗传杂志,2013,21(2):11-13.
[13]Tomita-Mitchell A,Mahnke DK,Larson JM,et al.Multiplexed quantitative real-time PCR to detect 22q11.2 deletion in patients with congenital heart disease[J].Physiol Genomics,2010,42A(1):52-60.
[14]Fadda GM,Capobianco G,Balala A, et al.Routine second trimester ultrasound screening for prenatal detection of fetal malformations in Sassari university hospital,Italy:23 years of experience in 42,256 pregnancies[J].Eur J Obstet Gynecol ReprodBiol,2009,144(2):110-114.
[15]趙婧,黄湘,李红艳,等.荧光原位杂交技术在先天性心脏病产前诊断中的应用[J].检验医学与临床,2015,12(23):3512-3514.
[16]Locatelli A,Mariani S,Ciriello E,et al.Role of FISH on unculturedamniocytes for the diagnosis of aneuploidies in the presence of fetalanomalies[J].Fetal Diagn Ther,2005, 20(1):1-4.
[17]闫亚妮,吴青青,姚苓,等.胎儿先天性心脏病与染色体及22q11微缺失异常的临床研究[J].西安交通大学学报(医学版),2014,35(2):249-253.
(收稿日期:2017-04-25 本文编辑:许俊琴)

