自噬与糖尿病肾病肾脏固有细胞的损伤
高聪普 综述 白寿军 审校
·肾脏病基础·
自噬与糖尿病肾病肾脏固有细胞的损伤
高聪普 综述 白寿军 审校
糖尿病肾病是慢性肾脏病主要原因之一,目前仍缺乏行之有效的治疗靶点。自噬是一种以自我消化的方式清除细胞内长寿命蛋白质和受损细胞器的生理、病理过程,大多时候被认为是细胞的一种自我保护机制,但是过度的自噬也将会导致细胞损伤。自噬受损可能是糖尿病肾病发病原因,本文通过复习糖尿病肾病时肾脏固有细胞(包括肾小球足细胞、内皮细胞、系膜细胞、近曲小管内上皮细胞)的体内及体外研究相关文献,发现自噬在糖尿病肾病中主要起到保护作用;自噬可能成为糖尿病肾病治疗新靶点。
自噬 糖尿病肾病 肾脏固有细胞
目前糖尿病肾病已经成为慢性肾脏疾病首要发病原因,严重威胁人类健康,而糖尿病肾病发病机制尚不十分清楚。糖尿病肾病发生、发展、结局与哪些机制有关并不十分确定。当前治疗主要是控制血糖、血压,控制肾素-血管紧张素-醛固酮轴亢进以减少蛋白尿,延缓肾功能衰竭发展,然而治疗效果不理想。糖尿病肾病迫切需要寻找新的治疗靶点,探索新疗法。自噬是一种以自我消化的方式清除细胞内长寿命蛋白质和受损细胞器的生理、病理过程。近期研究显示出自噬改变参与糖尿病肾病发病过程,针对糖尿病肾病中自噬现象及过程研究,有望为糖尿病肾病治疗寻找到新的靶点。
自噬
自噬是一种广泛存在于真核细胞内溶酶体依赖性蛋白及细胞器的分解代谢途径的生物学现象。1956年,Clark用电镜观察新生小鼠肾组织时发现细胞中含有大量具有膜性结构的致密体,而且其中常含有类似于线粒体等的胞质结构。1962年,美国科学家Ashford和Porter利用透射电镜观察胰高血糖素灌注大鼠的肝脏切片时首次发现细胞内存在“自食(self-eating)”的现象。在1963年的溶酶体国际会议上,比利时科学家Christian de Duve将这种细胞中存在的包裹细胞质和细胞器的膜泡发生现象定义为自噬,用以描述真核细胞内存在的“自食”现象[1],早期研究认为自噬是营养素饥饿状态下诱发的适应性反应,通过自噬循环利用自身物质。近十年对细胞自噬机制研究表明自噬在人类健康和疾病中发挥重要作用[2]。目前研究将自噬分为三种:宏自噬、微自噬和分子伴侣介导自噬[3]。在本文重点关注的自噬主要指宏自噬[4],其过程大致包括5个阶段[5]:(1)形成双膜结构的隔离膜即吞噬泡;(2)吞噬泡扩张;(3)自噬体的形成,隔离膜逐渐延伸将需降解的底物完全包绕形成自噬体;(4)自噬性溶酶体的形成自噬体通过细胞骨架微管系统将其包裹的底物运输至溶酶体并与之融合形成自噬性溶酶体;(5)自噬体内容物的降解,自噬体与溶酶体融合后自噬体内膜及其内容物被溶酶体中多种蛋白水解酶降解,自噬体膜脱落循环利用。生理条件下几乎所有细胞都存在基础水平的自噬。基础水平的自噬可清除并降解未折叠或折叠错误的蛋白质,降解蛋白质产生氨基酸等供细胞再循环,从而维持细胞生存及内环境的稳定。自噬可被多种因素激活,如营养或生长因子缺乏、缺氧、活性氧刺激、DNA损伤、蛋白质聚集、细胞器损伤或细胞内病原体侵袭等因素[3]。在大多数情况下,自噬参与细胞的应激反应,帮助细胞适应营养变化,维持细胞稳态和延续细胞生命。自噬是细胞对外界因素刺激的一种适应性反应,是细胞的一种自我保护机制,可抑制有害应激所诱导的细胞凋亡[6]。
自噬与糖尿病肾病
糖尿病肾病发生发展机制目前不十分清楚,但是与肾脏固有细胞改变密切相关,固有细胞包括肾小球系膜细胞、足细胞、内皮细胞和肾小管上皮细胞。其中系膜细胞、足细胞、内皮细胞主要参与肾小球滤过膜构成及功能调节,肾小管上皮细胞主要参与物质重吸收与分泌。固有细胞是糖尿病肾病损伤靶点,下文将逐一综述自噬与四种固有细胞的关系。
自噬与系膜细胞损伤 系膜细胞是肾小球重要的固有细胞之一,在肾小球疾病的发生、发展中起了至关重要的作用。采用任何能维持系膜细胞增生、肥大和凋亡之间的平衡以及改善系膜基质代谢的干预措施是缓解或逆转肾小球疾病的关键。系膜细胞增多与系膜基质增多是糖尿病肾病共同病理变化,无论系膜细胞增生或萎缩,均伴系膜细胞外蛋白的蓄积,导致肾小球的硬化[7-8]。 Ding等[9]研究表明在无血清条件下,系膜细胞自噬由转化生长因子β1(TGF-β1)通过TAK11和PI3K-Akt 依赖途径诱发,通过自噬阻止了系膜细胞凋亡,增加系膜细胞存活率。Kim等[10]报道自噬负调控系膜细胞产生细胞外基质,主要通过细胞内Ⅰ型胶原降解。这些报道数据表明一个新的细胞内机制,系膜细胞通过自噬降低胶原纤维水平,从而抑制肾脏纤维化,而肾脏慢性纤维化是慢性肾脏病的发生发展主要机制,也是糖尿病肾病发生发展的主要机制。
研究表明细胞自噬失调是糖尿病肾病发病原因之一,我们对在糖尿病条件下系膜自噬尚知之甚少。Fiorentino等[11]通过获得敲除Timps小鼠系膜细胞,证明通过Timp3降低了FoxO1表达,从而阻止系膜细胞自噬水平,促进糖尿病肾病发展。
自噬与足细胞损伤 足细胞是一种高度分化的肾小球上皮细胞,足细胞相互交叉足突排列在基膜外侧,包裹着肾小球毛细血管构成肾小球滤过屏障[12],足细胞损伤与丢失在糖尿病肾病发生发展中发挥至关重要作用[13-14]。
足细胞是高度分化静止细胞,自我分裂再生能力差,因此自身修复是保持自身稳定的重要机制。目前证据表明足细胞存在高水平的基础的细胞自噬,通过细胞自噬维持细胞稳定[15]。虽然自噬在糖尿病肾病肾小球损伤中发生作用的机制还不完全明了,但是已经有实验发现在随着糖尿病大鼠患糖尿病时间延长,足细胞自噬能力在下降[16]。在高糖培养足细胞也会表现出自噬相关蛋白表达水平降低,例如Beclin-1、Atg5-Atg12复合体。Hartleben等[17]研究表明足细胞特异性Atg5基因受损的老龄老鼠,由于细胞自噬水平下降,导致氧化的蛋白与泛素化蛋白在足细胞内蓄积,导致足细胞数目及功能下降,而蛋白尿及肾小球硬化。
Xin等[18]通过高血糖培养条件,使足细胞自噬水平降低,通过雷帕霉素提高自噬水平后,可以减轻足细胞损伤,减轻足细胞胰岛素抵抗。Fang等[16]研究表明糖尿病条件下mTORC1激活会抑制足细胞的自噬,导致足细胞损伤、数目减少和蛋白尿。Gdel等[19]研究表明非糖尿病小鼠足细胞特异性mTORC1受损导致蛋白尿和肾小球硬化。而mTORC1和mTORC2同时受损后,肾小球损伤更为严重。这些发现表明mTORC1和mTORC2表达水平与足细胞稳态非常重要,mTORC的过度及减少表达均可导致足细胞损伤。但是目前我们还需要进一步验证多种实验条件下mTORC与足细胞损伤之间关系。Yadav等[20]研究表明血管紧张素Ⅱ可通过血液动力学效应及直接作用于细胞诱细胞凋亡,引起肾脏损伤。血管紧张素Ⅱ可导致足细胞自噬泡增多,体积增大,自噬标记蛋白LC3-Ⅱ和Beclin-1表达也提高,应用自噬抑制剂3-MA抑制足细胞自噬后,足细胞凋亡率增加,表明自噬在血管紧张素Ⅱ诱导的足细胞凋亡中起到保护作用。自噬可能成为保护足细胞治疗的新靶点(图1)[21]。
自噬与肾小球内皮细胞损伤 既往研究表明肾小球内皮细胞损伤与糖尿病肾及非糖尿病患者的肾纤维化密切相关[22]。目前自噬与肾小球内皮细胞方面报道不多,Xavier等[23]研究表明BAMBI(Bone morphogenetic protein and Actin receptor Membrane Bound Inhibitor)是TGF-β竞争性受体拮抗剂,它定位肾脏内皮细胞内,可以干扰TGF-βⅠ型及Ⅱ型受体,阻断TGF-β受体信号传导,从而阻止肾脏纤维化,通过诱发内皮细胞自噬可导致BAMBI蛋白降解。自噬与内皮细胞损伤及肾脏纤维化关系较为复杂,需要进一步研究来阐明他们的关系。
自噬与近曲肾小管上皮细胞损伤 正常情况下肾小管上皮细胞基础自噬发生率较低[24]。Kimura等[25]研究表明Atg5基因近曲肾小管特异受损小鼠,其肾小管上皮细胞逐渐出现变形线粒体和P62和泛素均为阳性的内涵体蓄积,在小鼠9月龄时就出现近曲小管细胞肥大和变性,而且Atg5基因缺失会加重近曲小管上皮细胞缺血灌注损伤,增加小管上皮细胞凋亡,增加P62和泛素阳性胞质内涵体蓄积。上述研究表明自噬在近曲肾小管上皮细胞保持自身稳定和保护灌注再损伤方面发挥重要作用。既往对1型及2型糖尿病动物近曲及远曲小管细胞研究表明,高血糖通过增加p62/SQTM1阻止细胞自噬[26-28]。阻止钠-葡萄糖共同转运体2(SGLT2)向顶性表达能够增强近曲小管摄取葡萄糖能力。抑制SGLT2增加肾脏排泄,降低血糖水平,因此药物性阻断SGLT2已经发展成为潜在抗糖尿病药物[29]。敲除SGLT2基因后,减弱链脲佐菌素(STZ)诱导的P62/SQSTM1蓄积,表明SGLT2诱导增加血糖重吸收,导致对自噬的增强[30]。在STZ诱导的糖尿病动物模型中,SGLT2缺乏不能减少纤维连接蛋白表达,但是SGLT2敲除后可减低高血糖及高滤过状态,减少肾脏纤维化,其原因尚不明。SIRT1是肾脏重要的自噬介质,Hasegawa等[31]应用SIRT1敲除及SIRT1转基因小鼠实验显示,SIRT1在近曲小管影响肾小球功能及保护糖尿病肾脏损害。减少SIRT1在近曲小管细胞表达降低细胞SIRT1,同时调高足细胞Claudin-1,增加了蛋白尿,而且在db/db 或者STZ诱发糖尿病肾病小鼠模型,SIRT1在近曲小管表达下降发生在蛋白尿之前。虽然自噬的活动度未被直接检测,SIRTI是肾脏自噬的一个正调因子,可能通过诱导细胞自噬保护肾小球近曲小管而减少蛋白尿(图1)。
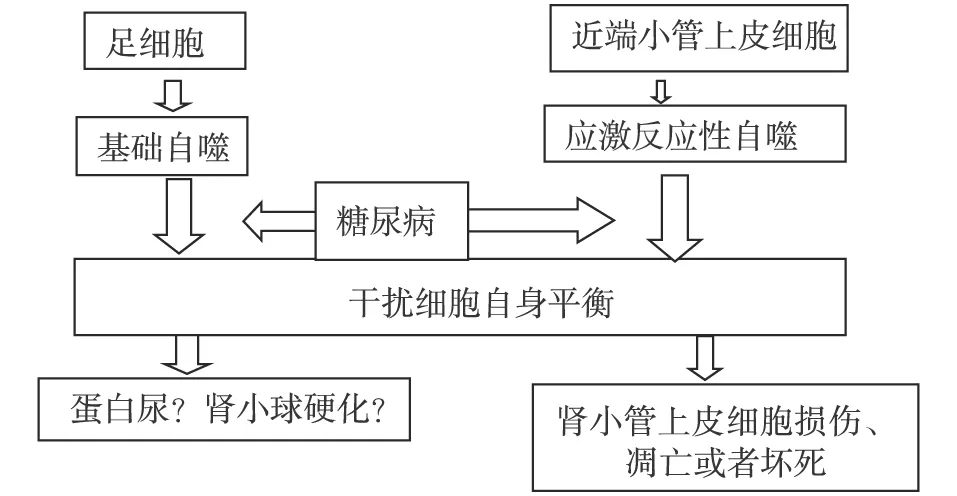
图1 糖尿病足细胞与近端肾小管上皮细胞自噬损伤导致肾脏损伤示意基础自噬是足细胞保持自身平衡发挥重要作用,在正常近端小管上皮细胞中自噬水平低,在缺氧、蛋白尿等应激情况下自噬被激活;在糖尿病情况下足细胞及近端小管上皮自噬水平降低,出现足细胞、上皮细胞损伤。但是目前自噬在糖尿病肾病的肾小球足细胞和上皮细胞病变发生机制作用尚不明确
小结:自噬是生命体的一种自然现象,广泛参与各种病理生理过程。营养缺乏、缺氧、应激的产生、内质网及线粒体损伤等各种应激均可诱导细胞自噬。自噬可清除长寿命蛋白质和受损细胞器,大多时候被认为是细胞的一种自我保护机制,避免了细胞凋亡,同时也认为过多的自噬可能造成细胞损伤及凋亡。目前,对糖尿病肾病的研究发现,自噬对足细胞、肾小管上皮细胞及系膜细胞等肾脏固有细胞均有保护作用,但自噬与糖尿病肾病发生、发展机制的关联仍需要进一步阐明。增强固有细胞自噬可能会对肾脏有保护作用,可能是糖尿病肾病的潜在治疗靶点。
1 Klionsky DJ.Autophagy:from phenomenologyto molecular understanding in less than a decade.Nat Rev Mol Cell Biol,2007,8(11):931-937.
2 Mortimore GE,Pösö AR.Intracellular protein catabolism and its control during nutrient deprivavion and supply.Annu Rev Nutr,1987,7:539-564.
3 Choi AM,Ryter SW,Levine B.Autophagy in human health and disease.N Engl J Med,2013,368(7):651-662.
4 Kaushik S,Massey AC,Mizushima N,et al.Constitutive activation of chaperone mediated autophagy in cells with impaired macroautophagy.Mol Biol Cell,2008,19(5):2179-2192.
5 Abada A,Elazar Z.Getting ready for building:signaling and autophagosome biogenesis.EMBO Rep,2014,15(8):839-852.
6 Huber TB,Edelstein CL,Hartleben B,et al.Emerging role of autophagy in kidney function,diseases and aging.Autophagy,2012,8(7):1009-1031.
7 Kanwar YS,Sun L,Xie P,et al.A glimpse of various pathogenetic mechanisms of diabetic nephropathy.Annu Rev Pathol,2011,6:395-423.
8 Chiang CK,Wang CC,Lu TF,et al.Involvement of Endoplasmic Reticulum Stress,Autophagy,and Apoptosis in Advanced Glycation End Products-Induced Glomerular Mesangial Cell Injury.Sci Rep,2016,6:34167.
9 Ding Y,Kim JK,Kim SI,et al.TGF-β1 protects against mesangial cell apoptosis via induction of antophagy.J Biol Chem,2010,285(48):37909-37919.
10 Kim SI,Na HJ,Ding Y,et al.Autophagy promotes intracellular degradation of type I collagen induced by transforming growth factor (TGF)-β1.J Biol Chem,2012,287(15):11677-11688.
11 Fiorentino L,Cavalera M,Menini S,et al.Loss of TIMP3 underlies diabetic nephropathy via FoxO1/STAT1 interplay.EMBO Mol Med,2013,5(3):441-455.
12 Kawachi H,Miyauchi N,Suzuki K,et al.Role of podocyte slit diaphragm as a filtration barrier.Nephrology (Carlton),2006,11(4):274-281.
13 Wolf G,Chen S,Ziyadeh FN.From the periphery of the glomerular capillary wall toward the center ofdisease:podocyte injury comes of age in diabetic nephropathy.Diabetes,2005,54(6):1626-1634.
14 Pagtalunan ME,Miller PL,Jumping-Eagle S,et al.Podocyte Loss and progressive glomerular injury in type II diabetes.J Clin Invest,1997,99(2):342-248.
15 Mizushima N,Yamamoto A,Matsui M,et al.In vivo analysis of antophagy in response to nutient starvation using transgenic mice expressing a fluorescent autophagosome marker.Mol Biol Cell,2004,15(3):1101-1111.
16 Fang L,Zhou Y,Cao H,et al.Autophagy attenuates diabetic glomerular damage through protection of hyperglycemia-induced podocyte injury.PLoS One,2013,8(4):e60546.
17 Hartleben B,Gödel M,Meyer-Schwesinger C,et al.Autophagy influences glomerular disease susceptibility and maintains podocyte homeostasis in aging mice.J Clin Invest,2010,120(4):1084-1096.
18 Xin W,Li Z,Xu Y,el al.Autophagy protects human podocytes from high glucose-induced injury by preventing insulin resistance.Metabolism,2016,65(9):1307-1315.
19 Gödel M,Hartleben B,Herbach N,et al.Role of mTOR in podocyte function and diabetic nephropathy in humans and mice.J Clin Invest,2011,121(6):2197-2209.
20 Yadav A,Vallabu S,Arora S,et al.ANG II promotes antophagy in podocytes.Am J Physiol Cell physiol,2010,299(2):C488-C496.
21 Weide T,Huber TB.Implications of antophagy for glomerular aging and diseas.Cell Tissue Res,2011,343(3):467-473.
22 Stehouwer CD.Endothelial dysfunction in diabetic nephropathy:state of the art and potential significance for non-diabetic renal disease.Nephrol Dial Transplant,2004,19(4):778-781.
23 Xavier S,Gilbert V,Rastaldi MP,et al.BAMBI is expressed in endothelial cells and is regulated by lysosomal/autolysosomal degradation.PLoS One,2010,5(9):e12995.
24 Liu S,Hartleben B,Kretz O,et al.Autophagy plays a critical role in kidney tubule maintenance,aging and ischemia-reperfusion injury.Autophagy,2012,8(5):826-837.
25 Kimura T,Takabatake Y,Takahashi A,et al.Autophagy protects the proximal tubule from degeneration and acute ischemic injury.J Am Soc Nephrol,2011,22(5):902-913.
26 Barbosa Júnior Ade A,Zhou H,Hültenschmidt D,et al.Inhibition of cellular autophagy in proximal tubular cells of the kidney in streptozotocin-diabetic and uninephrectomized rats.Virchows Arch B Cell Pathol Incl Mol Pathol,1992,61(6):359-366.
27 Han K,Zhou H,Pfeifer U.Inhibition and restimulation by insulin of cellular autophagy in distal tubular cells of the kidney in early diabetic rats.Kidney Blood Press Res,1997,20(4):258-263.
28 Kitada M,Takeda A,Nagai T,et al.Dietary restriction ameliorates diabetic nephropathy through anti-inflammatory effects and regulation of the autophagy via restoration of Sirt1 in diabetic Wistar fatty (fa/fa) rats:a model of type 2 diabetes.Exp Diabetes Res,2011,2011:908185.
29 Nair S,Wilding JP.Sodium glucose cotransporter 2 inhibitors as a new treatment for diabetes mellitus.J Clin Endocrinol Metab,2010,95(1):34-42.
30 Vallon V,Rose M,Gerasimova M,et al.Knockout of Na-glucose transporter SGLT2 attenuates hyperglycemia and glomerular hyperfiltration but not kidney growth or injury in diabetes mellitus.Am J Physiol Renal Physiol,2013,304(2):F156-167.
31 Hasegawa K,Wakino S,Simic P,et al.Renal tubular Sirt1 attenuates diabetic albuminuria by epigenetically suppressing Claudin-1 overexpression in podocytes.Nat Med,2013,19(11):1496-1504.
(本文编辑 加 则 子 慕)
Autophgy in diabetic nephropathy intrinsic cell injury
GAOCongpu,BAIShoujun
DepartmentofNephrology,QingpubranchofZhongshanHospitalaffiliatedFudanuniversity
Diabetic nephropathy is becoming a leading cause of chronic kidney disease, but there is still lack of a effective therapeutic target in diabetic nephropathy treament. Autophgy is a highly conserved “self-eating” path way by which cells degrading and recycling macromolecules and organelles, and play an imporptant role in human health and diseases. It is usually considered a protective process, but impaired autophgy will cause cell and organ damage. Impairment of the autophgy implicated in the pathogenesis of diabetic nephropathy. We reviews current articles focusing on studies of renal intrinsic cells (including glomerular podocyte,glomerular endothelial cell,messangial cell,proximal tubular epithelial cell)experiments in vivo and in vitro, and conclude that autophagy probably play a protective effect in diabetic nephropathy, and will be a new target in treatment.
autophy diabetic nephropathy renal intrinsic cells
10.3969/cndt.j.issn.1006-298X.2017.01.015
上海市自然科学基金(13ZR140720)
复旦大学附属中山医院青浦分院肾内科(上海,201706)
2016-07-05

