系统性红斑狼疮相关血栓性微血管病血管内皮-间充质细胞转分化的研究
周 颖 陈樱花 张明超 梁少姗 杨 帆 涂义姚 鲍 浩 刘志红 胡伟新
系统性红斑狼疮相关血栓性微血管病血管内皮-间充质细胞转分化的研究
周 颖*陈樱花*张明超 梁少姗 杨 帆 涂义姚 鲍 浩 刘志红 胡伟新
目的:探讨系统性红斑狼疮相关血栓性微血管病(SLE-TMA)肾间质血管内皮细胞表型变化及其与血管病变和间质纤维化之间的关系。 方法:30例经肾活检明确诊断的SLE-TMA患者,根据血管组织学改变分为急性TMA和慢性TMA,以正常肾组织血管为对照。内皮细胞CD31、血管内皮钙黏蛋白(VE-cadherin)、α平滑肌肌动蛋白(α-SMA)和转化生长因子β(TGF-β)采用间接免疫荧光双重染色定位,免疫组织化学染色和Image-Pro-Plus 6.0测量上述分子的表达量,以平均光密度表示其表达强度。Aperio图像分析系统测量肾间质纤维化面积。 结果:间接免疫荧光双重染色显示正常血管内膜无α-SMA表达,SLE-TMA血管内皮细胞表达α-SMA。与正常对照组相比,急性TMA组血管内皮CD31和VE-cadherin表达降低(P<0.05),α-SMA表达则显著增高(P<0.01);慢性TMA组内皮细胞CD31、VE-cadherin和TGF-β表达强度均显著低于急性TMA组和正常血管组(P<0.01),α-SMA表达更高(P<0.01)。肾间质血管α-SMA平均光密度与肾间质纤维化面积呈显著正相关(r=0.439,P=0.015),而CD31平均光密度与肾间质纤维化呈显著负相关(r=-0.458,P=0.011)。 结论:SLE-TMA血管内皮细胞正常标记物表达减少而α-SMA表达增加,表明内皮细胞向成纤维细胞表型转变,且表达量的变化与血管病变进展相关;肾血管内皮细胞CD31表达减少和α-SMA增加与肾间质纤维化相关。
系统性红斑狼疮 血栓性微血管病 内皮细胞-间充质细胞转分化 血管病变 间质纤维化
系统性红斑狼疮(SLE)可并发血栓性微血管病(TMA),且绝大多数与免疫复合物性狼疮性肾炎(LN)并存[1],造成严重肾功能损害,甚至需要肾脏替代治疗(RRT)。由于国内外对SLE-TMA的机制缺乏深入研究,迄今缺乏有效的治疗手段。研究发现Ⅳ型伴TMA的LN的2年肾脏存活率仅39%,而无TMA的LN 10年肾脏存活率达85%[2]。TMA已成为LN患者进展为终末期肾病(ESRD)最主要的危险因素之一,是影响LN患者肾脏远期预后的关键因素[3]。临床迫切需要对SLE-TMA的发病机制进行深入研究,在此基础上寻找到有效的治疗方法。
SLE-TMA血管内皮细胞肿胀剥脱、内皮下黏液样水肿,腔内血栓,管腔堵塞;血管病变进展,则出现血管内膜纤维性增生,管腔狭窄或闭锁,导致肾小球缺血和间质纤维化[4]。内皮细胞损伤是血管TMA发生的关键。近年研究发现在心脏[5]、肺[6]和肾脏[7]等的血管内皮损伤过程中存在内皮-间充质细胞转分化(EndMT),后者参与以上组织的纤维化。我们推测SLE-TMA的血管内皮细胞损伤也存在EndMT,且与血管内膜纤维化相关。因此,本文观察SLE-TMA患者肾间质血管内皮细胞CD31、血管内皮钙黏蛋白(VE-cadherin)、α平滑肌肌动蛋白(α-SMA)和转化生长因子β(TGF-β)的表达变化及其与血管病理改变的关系,探讨EndMT是否参与TMA病变的发生和发展,同时分析病变血管内皮细胞标志物表达量变化及其与间质纤维化相关性。
对象和方法
病例选择 2010年1月至2014年9月在南京军区南京总医院肾脏科经肾活检确诊的30例伴TMA的LN,均符合1997年美国风湿病学会SLE诊断标准[8],肾活检病理显示为增殖型LN及间质血管TMA。除外药物(如环孢素、他克莫司)、硬皮病或恶性高血压等引起的TMA。另取性别、年龄匹配的肾癌切除肾的癌旁正常肾组织为正常对照组。
肾组织病理 LN的病理分型参照2003年ISN/RPS分型标准[9]。肾血管急性TMA表现为肾间质小动脉(包括入球动脉、小叶间动脉或叶间动脉)内皮细胞肿胀,剥脱,内皮下增宽呈黏液样改变,腔内可见血栓或红细胞碎片,可见管壁坏死。慢性TMA表现为血管内膜纤维性增生,内膜增厚分层,呈“洋葱皮”样改变,管腔狭窄或闭塞[4]。 免疫荧光检查病变血管壁无明显免疫球蛋白沉积。肾组织活动性指数(AI)及慢性化指数(CI)参照文献[10]评分。
肾组织免疫组织化学染色 肾组织石蜡切片脱蜡至水;高温修复10 min;10%小牛血清室温封闭10 min;分别滴加一抗CD31抗体、VE Cadherin抗体、α-SMA抗体、TGF-β抗体室温孵育2h;滴加二抗室温孵育30 min;DAB显色,苏木素染核后封片。
肾组织间接免疫荧光双重染色 肾组织石蜡切片脱蜡至水;高温修复10 min;10%小牛血清室温封闭10 min;分别将CD31抗体或VE-cadherin抗体与α-SMA抗体混合、CD31抗体或VE-cadherin抗体与TGF-β抗体混合,分别滴加于肾组织上,室温孵育2h;滴加FITC标记的二抗与TRITC标记的二抗混合后滴加于肾组织上,室温孵育30 min,封片后激光共聚焦显微镜下观察。
血管内皮细胞分子表达定量分析 免疫组化染色切片于光镜下观察血管CD31、VE-cadherin、α-SMA和TGF-β的表达情况,数码相机分别获取20条急性TMA和慢性TMA血管及来自10例正常肾组织间质的20条正常对照肾血管的4种分子标志物400倍镜下的照片。Image-Pro-Plus 6.0软件分别测量血管内皮CD31、VE-cadherin、α-SMA和TGF-β积分光密度(IOD),并计算平均光密度(MD),即IOD/血管内皮细胞层面积),以MD表示其表达强度。
间质纤维化面积 Masson三色染色切片,采用Aperio Image Scope定量分析系统测量肾间质纤维化面积[11]。肾组织切片扫描及定量分析分别由一位病理医师单独完成(单盲)。
临床指标及实验室检查 包括年龄、性别、受累脏器损害、血压、24h尿蛋白定量、血清白蛋白、血清肌酐、血清乳酸脱氢酶、外周血红细胞碎片、网织红细胞计数。免疫学指标包括补体C3、补体C4、ANA、抗ds-DNA抗体、抗C1q抗体和抗磷脂抗体。

图1 CD31与α平滑肌肌动蛋白(α-SMA)双套色共聚焦显微镜(×400)A1~3为正常血管:内皮层仅表达绿色的CD31(A1、A3),呈连续线状,无α-SMA表达;B1~3为SLE-TMA血管:内皮层CD31表达减弱且不连续(A1),见α-SMA强阳性,内皮下区域也见少量CD31和α-SMA阳性细胞(B1,B2);CD31与α-SMA双套色(B3)见内皮层细胞为大量CD31与α-SMA共表达细胞(黄色),少量仅表达α-SMA(红色),内皮下也见少量CD31与α-SMA共表达细胞和α-SMA阳性细胞;肾小球血管袢和管周毛细血管CD31阳性细胞为主,见极少细胞CD31与α-SMA共表达;↑:肾组织内的小动脉
统计学方法 采用SPSS 16.0软件进行统计分析。以单样本Kolmogorov-Smirnov Z检验对数据进行正态检验。所有计量资料,以均数±标准差或中位数(四分位间距)表示,组间比较应用方差分析或Kruskal-Wallis H检验;计数资料以百分率表示,组间比较采用卡方检验。正态分布数据采用Pearson相关系数,非正态分布数据采用Spearman相关系数评价变量间的相关性。P<0.05为差异有统计学意义,P<0.01为统计学差异显著。
结 果
临床和肾脏病理资料 30例SLE-TMA患者中27例存在高血压,SLE-DAI为(16.4±5.0)分,尿蛋白定量(4.3±2.4) g/24h,26例急性肾损伤,平均SCr (282.9±194.5) μmol/L,其中14例需急诊RRT治疗。30例均有贫血(平均血红蛋白71±13 g/L),23例血小板减少(平均79±40×109/L)。28例C3降低,18例C4降低, 18例抗ds-DNA阳性,16例抗磷脂抗体阳性。24例外周血红细胞碎片阳性,7例伴中枢神经系统受累。
LN病理类型Ⅳ型和Ⅳ+Ⅴ型分别有21例和9例, 8例有袢内血栓,AI (7.9±2.9)分,CI (2.5±2.1)分。间质血管急性、慢性和急性伴慢性TMA各10例。
血管内皮标记的定性观察 免疫荧光双套染色显示正常血管内膜CD31和VE-cadherin呈强阳性类线性表达,TGF-β弱表达,α-SMA无表达。在TMA血管,α-SMA与CD31或VE-cadherin共表达于内皮细胞(图1)。免疫组化染色显示急性TMA血管内膜CD31和VE-cadherin表达减弱,α-SMA散在表达;慢性TMA内膜CD31和VE-cadherin表达进一步减弱,α-SMA表达增强。急性和慢性TMA血管内膜TGF-β表达均减弱(图2)。
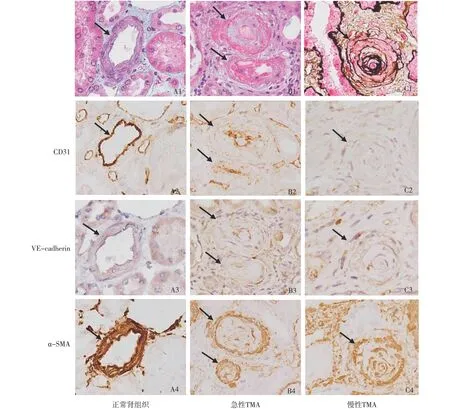
图2 光镜下正常血管、急性TMA和慢性TMA血管(A1、B1:Masson三色,×400;C1:PASM-Masson,×400);免疫组化染色:急性TMA血管内皮层CD31(B2)和VE-cadherin(B3)表达减弱且不连续,α-SMA(B4)表达增强;慢性TMA血管内皮层CD31(C2)和VE-cadherin(C3)表达进一步减弱,α-SMA(C4)表达更强;TMA血管内皮CD31、VE-cadherin和α-SMA表达不仅局限于内皮层,内皮下也见阳性表达,表明内皮细胞增生、分层(IH,×400)TMA:血栓性微血管病;α-SMA:α平滑肌肌动蛋白;VE-cadherin:血管内皮钙黏蛋白;↑:肾组织内的小动脉
血管内膜分子表达量与血管病变的联系 与正常血管相比,急性TMA血管内皮CD31(P=0.013)、VE-cadherin(P=0.007)和TGF-β(P=0.01)表达水平显著降低,α-SMA表达水平显著增高(P<0.01);慢性TMA血管内皮细胞CD31、VE-cadherin和TGF-β表达水平降低(P<0.01),α-SMA表达水平显著增高(P<0.01)。慢性TMA血管内膜CD31(P=0.02)和TGF-β(P<0.01)表达水平显著低于急性TMA,α-SMA表达增高,水平高于急性TMA,但无统计学差异(P=0.09)(图3)。
血管内皮细胞分子表达与间质纤维化的关系 30例SLE-TMA肾组织平均肾间质纤维化为16.0%±7.8%。定量分析TMA血管内皮CD31、VE-cadherin、α-SMA和TGF-β表达量与肾间质纤维化的关系,发现肾间质血管CD31平均表达量与肾间质纤维化呈显著负相关(r=-0.458,P=0.011),α-SMA平均表达量与肾间质纤维化面积呈显著正相关(r=0.439,P=0.015)(图4)。

图3 狼疮性肾炎伴TMA不同类型血管病变血管内皮细胞分子表达VE-cadherin:血管内皮钙黏蛋白;α-SMA:α平滑肌肌动蛋白;TGF-β:转化生长因子β

图4 肾间质血管CD31和α平滑肌肌动蛋白(α-SMA)表达与间质纤维化的关系
讨 论
SLE-TMA发生的关键是内皮细胞损伤,SLE-TMA绝大多数与免疫复合物沉积导致的肾小球肾炎并存,本文重点观察免疫复合物性LN(Ⅳ型或Ⅳ+Ⅴ型)合并TMA患者肾间质小动脉内皮细胞损伤在TMA发生及发展中的病理作用,以血管内皮细胞CD31和VE-cadherin及α-SMA、TGF-β的表达反映血管内皮细胞功能表型的变化,发现SLE-TMA病变血管内皮细胞的正常标记CD31和VE-cadherin分子表达减弱,并出现α-SMA的表达,且随着血管病变慢性化的进展,内皮细胞正常标记进一步减弱,α-SMA表达更强,表明SLE-TMA的发生及发展过程存在EndMT,同时发现肾间质血管内皮CD31和α-SMA表达水平与间质纤维化相关。
EndMT是指在特定的生理和病理条件下,内皮细胞特异性标志物丢失,而重新获得间充质细胞标志物,进而转换成有活力的间充质细胞的过程[12]。发生EndMT的内皮细胞极性发生变化,粘附和紧密连接损伤,出现表型和功能的明显改变,逐渐演变成间充质细胞[13],具有致纤维化作用。来源于纤维化疾病不同组织的人内皮细胞的体外研究[14-15],纤维化疾病动物模型研究[5-7]及对不同纤维化疾病患者[16-17]的组织分析均显示EndMT在多个组织的纤维化过程发挥了重要作用。本研究首先采用免疫荧光双套色证明了正常肾血管内膜CD31和VE-cadherin呈强阳性表达,无α-SMA表达,在已发生TMA的血管内膜,α-SMA表达显著增强,正常表达CD31或VE-cadherin的内皮细胞数量显著减少,出现α-SMA与CD31或VE-cadherin共表达。免疫组化染色证明了在急性TMA血管内皮细胞CD31和VE-cadherin表达减弱,α-SMA表达增强,表明内皮细胞表型发生了改变,而TMA病变进展至内膜纤维化时,CD31和VE-cadherin表达进一步减少,甚至消失,α-SMA表达更强,表明在SLE-TMA血管病变发生及进展过程中,存在内皮细胞向成纤维细胞表型转变,即EndMT参与了血管病变的发生和进展过程。发生EndMT时,血管内皮细胞正常标记表达减少,细胞与细胞间的连接能力减弱或丢失,可能与SLE-TMA急性期所见的内皮下疏松、内皮细胞剥脱和内膜黏液样水肿等病变相关。当内皮细胞获得了成纤维细胞标记,便具有致纤维化作用,从而导致血管内膜纤维性增生。肺动脉高压患者血管病变的研究显示内皮细胞和成纤维细胞的特异标志物共表达于肺小动脉内皮细胞,内皮来源的间充质细胞导致受累血管内皮下纤维组织的产生和聚集,EndMT参与了肺血管的纤维化[16]。因此,EndMT可能既损伤了血管内皮,又诱导了血管内膜的纤维化,是SLE-TMA发生和发展的关键过程。TGF-β是重要的致纤维化细胞因子,也是介导EndMT的重要介质[18-19]。但本研究发现在明确TMA的血管内膜TGF-β表达反而减弱,可能由于绝大部分SLE-TMA肾活检时血管病变已非早期,随着内皮细胞损伤加重,逐渐发生纤维化,TGF-β表达减弱。除TGF-β外,多个信号通路如Wnt、Notch和Hedgehog都参与EndMT的发生,且受多种分子如Caveolin-1和Endothelin-1的调节[20]。因此,介导SLE-TMA血管EndMT的发生机制需要进一步研究。
本研究观察到SLE-TMA肾间质血管内皮α-SMA表达水平与肾间质纤维化呈正相关, CD31与间质纤维化呈负相关,表明血管内皮EndMT与SLE-TMA患者的肾间质纤维化相关。分析可能与α-SMA表达增强,导致血管内膜纤维化、管腔狭窄,进而导致小管损伤和间质纤维化有关。在多个肾脏纤维化模型包括单侧输尿管梗阻、糖尿病肾病和Alport综合征小鼠模型的研究显示30%~50%的成纤维细胞来源于内皮细胞[7]。对糖尿病肾病患者肾组织的分析也显示CD31和α-SMA共表达于肾小球内皮细胞[17],表明EndMT参与了肾脏纤维化过程。由于本组病例TMA主要累及间质小动脉,肾小球及管周毛细血管仅见极少量CD31或VE-cadherin与a-SMA共表达,表明肾小球及管周毛细血管内皮也存在EndMT,它们与肾小球硬化和间质纤维化间的相关性有待进一步研究。
小结:SLE-TMA肾血管病变发生及进展存在内皮细胞正常标记表达减少,α-SMA表达增加,表明内皮细胞向成纤维细胞表型转变,而且内皮细胞表型变化与肾间质纤维化相关,但介导内皮细胞向成纤维细胞表型转变的机制还需进一步研究。
1 Song D,Wu LH,Wang FM,et al.The spectrum of renal thrombotic microangiopathy in lupus nephritis.Arthritis Res Ther,2013,15(1):R12.
2 Hu WX,Liu ZZ,Chen HP,et al.Clinical characteristics and prognosis of diffuse proliferative lupus nephritis with thrombotic microangiopathy. Lupus,2010,19( 14) : 1591-1598.
3 孙海鸥,胡伟新,谢红浪,等.弥漫增生型狼疮性肾炎的远期预后.肾脏病与透析肾移植杂志,2008,17(3):216-223.
4 Appel GB,Pirani CL,D′Agati V.Renal vascular complications of systemic lupus erythematosus.J Am Soc Nephrol,1994,4(8):1499-1515.
5 Zeisberg EM,Tarnavski O,Zeisberg M,et al.Endothelial-to-mesenchymal transition contributes to cardiac fibrosis.Nat Med,2007,13(8):952-961.
6 Hashimoto N,Phan SH,Imaizumi K,et al.Endothelial mesenchymal transition in bleomycin-induced pulmonary fibrosis.Am J Respir Cell Mol Biol,2010,43(2):161-172.
7 Zeisberg EM,Potenta SE,Sugimoto H et al.Fibroblasts in kidney fibrosis emerge via endothelial-to-mesenchymal transition.J Am Soc Nephrol,2008,19(12):2282-2287.
8 Hochberg MC.Updating the American College of Rheumatology revised criteria for the classification of systemic lupus erythematosus.Arthritis Rheum,1997,40(9):1725.
9 Weening JJ,D′Agati VD,Schwartz MM,et al.The classification of glomerulonephritis in systemic lupus erythematosus revisited.J Am Soc Nephrol,2004,15(2):241-250.
10 Austin HA 3rd,Muenz LR,Joyce KM,et al.Diffuse proliferative LN:identification of specific pathologic features affecting renal outcome.Kidney Int,1984,25(4):689-695.
11 Wang Y,Zheng C,Xu F,et al.Urinary fibrinogen and renal tubulointerstitial fibrinogen deposition:Discriminating between primary FSGS and minimal change disease.Biochem Biophys Res Commun,2016,478(3):1147-1152.
12 Karasek MA.Does transformation of microvascular endothelial cells into myobroblasts play a key role in the etiology and pathology ofbrotic disease? Med Hypotheses,2007,68(3),650-655.
13 Medici D,Kalluri R.Endothelial-mesenchymal transition and its contribution to the emergence of stem cell phenotype.Semin Cancer Biol,2012,22(5-6):379-384.
14 Choi SH,Hong ZY,Nam JK,et al.A Hypoxia-induced vascular endothelial-to-mesenchymal transition in development of radiation-induced pulmonarybrosis.Clin Cancer Res,2015,21(16),3716-3726.
15 Zhao Y,Qiao X,Wang L,et al.Matrix metalloproteinase 9 induces endothelial-mesenchymal transition via Notch activation in human kidney glomerular endothelial cells.BMC Cell Biol,2016,17(1):21.
16 Arciniegas E,Frid MG,Douglas IS,et al.Perspectives on endothelial-to-mesenchymal transition:Potential contribution to vascular remodeling in chronic pulmonary hypertension.Am J Physiol Lung Cell Mol Physiol,2007,293(1),L1-L8.
17 Li L,Chen L,Zang J,et al.C3a and C5a receptor antagonists ameliorate endothelial-myofibroblast transition via the Wnt/β-catenin signaling pathway in diabetic kidney disease.Metabolism,2015,64(5):597-610.
18 Cooley BC,Nevado J,Mellad J,et al.TGF-β signaling mediates endothelial-to mesenchymal transition (EndoMT) during vein graft remodeling.Sci Transl Med,2014,6(227):227ra34.
19 Xavier S,Vasko R,Matsumoto K,et al.Curtailing endothelial TGF-β signaling is sufcient to reduce endothelial-mesenchymal transition andbrosis in CKD.J Am Soc Nephrol,2015,26(4),817-829.
20 Piera-Velazquez S,Mendoza FA,Jimenez SA.Endothelial to Mesenchymal Transition (EndoMT) in the Pathogenesis of Human Fibrotic Diseases.J Clin Med,2016,5(4):E45.
(本文编辑 凡 心)
Renal vascular endothelial-mesenchymal transition in systemic lupus erythematosus associated thrombotic microangiopathy
ZHOUYing*,CHENYinghua*,ZHANGMingchao,LIANGShaoshan,YANGFan,TUYiyao,BAOHao,LIUZhihong,HUWeixin
NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China
*ZHOUYingandCHENYinghuaareconsideredtobefirstauthors
HUWeixin(E-mail:huwx@vip.163.com)
Objective:To investigate the phenotypic changes of renal vascular endothelial cells and its relationship with the vascular injury and renal interstitial fibrosis in patients with systemic lupus erythematosus associated thrombotic microangiopathy (SLE-TMA). Methodology:Biopsies from thirty SLE patients with lupus nephritis and renal vascular TMA were included in this study. Renal vascular TMA lesions were divided into acute and chronic TMA according to histology by light microscopy. Normal renal tissue from nephrectomized kidney of renal cancer was used as normal control. The expression of renal vascular endothelial CD31, vascular endothelial cadherin (VE-cadherin), α-smooth muscle actin (α-SMA) and transforming growth factor-β (TGF-β) were stained with immunofluorescence and immunohistochemical assays, and computer-assisted image analysis Image-Pro-Plus 6.0 and ImageScope (Aperio) were used to quantitatively analyze the intensity of endothelial marker expression recorded as the mean density (integral optical density/area of vascular endothelial layer) and the extent of renal interstitial fibrosis respectively. Results:Confocal immunofluorescence microscopy showed increased expression of α-SMA in the vascular endothelial cells in SLE-TMA, while negative endothelial α-SMA expression in normal control.Compared with the normal group, the endothelial expressions of CD31 and VE-cadherin were both significantly reduced in acute TMA group (P<0.05), whereas the expression of α-SMA increased significantly (P<0.01). The endothelial CD31, VE-cadherin and TGF-β expressions were significantly lower, while α-SMA expression was significantly higher in chronic TMA group than that in other two groups (P<0.01). The mean density of endothelial α-SMA expression was positively correlated with (r=0.439,P=0.015), while the expression of endothelial CD31 was negatively correlated with the extent of renal interstitial fibrosis significantly (r=-0.458,P=0.011). Conclusion:Renal vascular endothelial to mesenchymal transition was found in SLE-TMA, which was associated with the renal interstitial fibrosis.
systemic lupus erythematosus thrombotic microangiopathy endothelial-mesenchymal transition vascular injury renal interstitial fibrosis
10.3969/cndt.j.issn.1006-298X.2017.01.004
国家自然科学基金面上项目(81470042);国家科技支撑计划(2013BAI09B04,2015BAI12B05)
南京大学医学院附属金陵医院(南京军区南京总医院)肾脏科 硕士研究生(周 颖),国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016);*周 颖和陈樱花为共同第一作者
胡伟新(E-mail:huwx@vip.163.com)
2016-10-19
ⓒ 2017年版权归《肾脏病与透析肾移植杂志》编辑部所有

