青蒿素对ApoE-/-基因敲除小鼠动脉粥样硬化的影响
曹 乾,杜洪姣,史 瑾,李晓东
·论著·
青蒿素对ApoE-/-基因敲除小鼠动脉粥样硬化的影响
曹 乾*,杜洪姣,史 瑾,李晓东
目的 探讨青蒿素对ApoE-/-基因敲除小鼠动脉粥样硬化以及炎症因子的影响。方法 将20只ApoE-/-基因敲除小鼠分为青蒿素组和PBS处理组,每组10只,经高脂喂养8周,与对照组小鼠(C57BL/6J标准饮食小鼠,10只)比较,通过血管大体油红O染色评价斑块面积;HE染色观察病变形态及血浆中炎症因子的变化。结果 与对照组比较,PBS处理组及青蒿素组均可见动脉硬化斑块,炎症因子水平升高。青蒿素组的动脉硬化程度及炎症因子水平均明显低于PBS处理组。结论 青蒿素可以改善ApoE-/-基因敲除小鼠动脉粥样硬化进展。
青蒿素;ApoE-/-基因敲除小鼠;动脉粥样硬化
0 引言
动脉粥样硬化(Atherosclerosis,AS)是一种全身性慢性动脉疾病,可以侵害大、中动脉,造成血管内膜增厚、僵硬、管腔面积狭窄。血管平滑肌细胞(Vascular smooth muscle cells,VSMCs)增殖和迁移与动脉粥样硬化发生发展关系密切,同时动脉粥样硬化整个过程都有炎性反应参与[1]。有研究表明,炎性细胞因子及抗炎细胞因子的表达失衡参与调节动脉粥样硬化。青蒿素(Artemisinin,ART)又名黄花蒿素,是由菊科植物黄花蒿所提炼出来的倍半萜内酯化合物,除具有抗疟疾作用,近年研究发现,其还具有抗氧化[2]、抗肿瘤[3]、抗炎[4-5]等广谱的生物学和药理学活性。
由于ApoE-/-基因敲除小鼠动脉硬化模型与人体相似度高,近年来已经成为研究动脉硬化的重要模型[6]。本研究通过建立小鼠动脉粥样硬化模型,观察青蒿素对动脉粥样硬化以及炎症因子的影响,为临床治疗AS提供指导。
1 材料与方法
1.1 材料 C57BL/6J小鼠10只,健康雄性ApoE-/-基因敲除小鼠20只,体重16~20 g,由华阜康公司提供,青蒿素,ELISA试剂盒,多聚甲醛、无水乙醇、二甲苯、水合氯醛、苏木精、伊红、戊二醛等均由我院中心实验室提供,青蒿素:Dalian Meilun Biotech Co.,Dalian。
1.2 动物分组与模型建立
1.2.1 小鼠动脉粥样硬化模型的建立及分组 对照组:C57BL/6J小鼠10只,每日给予标准饲料20 g,喂养8周;相同标准剂量生理盐水腹腔注射,注射8周。PBS处理组:健康雄性ApoE-/-基因敲除小鼠10只,每日给予高脂饲料20 g,喂养8周;相同标准剂量生理盐水腹腔注射,注射8周。青蒿素组:健康雄性ApoE-/-基因敲除小鼠10只,每日给予高脂饲料20 g,同时腹腔注射青蒿素(参考剂量:100 mg/kg),喂养8周。
8周后,留取血清标本,处死小鼠后各组留取主动脉,部分经液氮速冻后置于-70 ℃保存,部分置于甲醛中固定48 h,备后续实验。
1.2.2 组织染色 油红O染色确定斑块面积及部位。油红O染色:①用干净清洁的硅化载玻片粘取冷冻切片,切片干燥后入60%异丙醇浸洗10 min。②油红O工作液染色10 min,避光。③ddH2O漂洗15 s,60%异丙醇分化3~10 s至间质清晰,水洗。④Mayer苏木精复染1 min,自来水返蓝。⑤滤纸小心吸干水分,甘油明胶封片。
HE染色观察病变分级。HE染色:将主动脉置于10%中性福尔马林溶液中固定24 h以上,常规石蜡包埋,切至7 μm薄片,置于苏木精中染色1 min,1%盐酸乙醇分化2 s,伊红染液染色2 min,切片入无水乙醇Ⅰ、Ⅱ、Ⅲ各1 min,入二甲苯Ⅰ、Ⅱ各3 min后,滴加适量中性树胶封片,显微镜下观察拍照。
1.3 观察指标与检测方法 以体视显微镜及光学显微镜观察三组标本。用斑块百分比(动脉粥样硬化斑块面积/动脉总面积)反映动脉硬化程度。图片经Photoshop、Image-Pro-Plus 6.0等软件对红色斑块面积进行圈定计算,以及对小鼠主动脉总面积的圈定计算,结果以斑块百分比=动脉粥样硬化斑块面积/动脉总面积表示。分别计算各组小鼠的平均百分比,对数据进行统计分析。
2 结果
饲养后8周的小鼠血脂情况见表1。
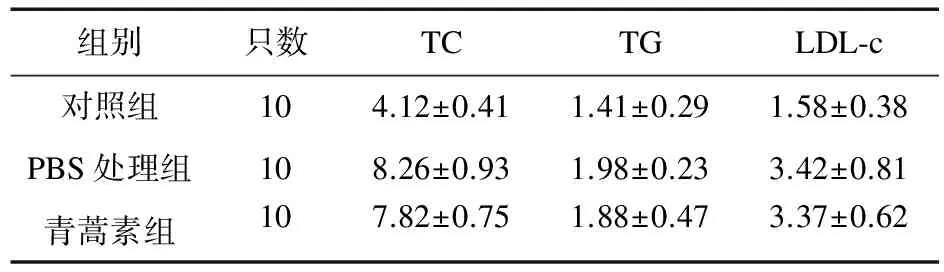
表1 小鼠血脂指标(mmol/L)
体视显微镜观察显示,PBS处理组主动脉大部分灰白不透明,弓斑块明显,大小不等,管壁弹性差。青蒿素组主动脉大部分呈透明状,主动脉可见灰白色斑块,呈斑点状,但面积明显小于PBS处理组,且管壁弹性较好。对照组主动脉管壁透明,无AS病灶。见图1。光学显微镜观察:PBS处理组主动脉管壁可见由泡沫细胞形成的脂纹脂斑和胆固醇结晶,管壁厚薄不均。青蒿素组主动脉管壁可见轻度增厚隆起,厚薄较均匀,少量炎症细胞。见图2。
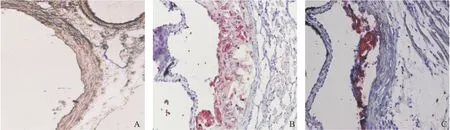
图1 油红染色
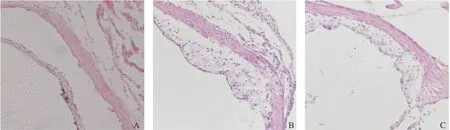
图2 HE染色
对照组动脉管腔面积(363.95±32.17)×10-3mm2;PBS处理组动脉管腔面积(334.53±45.40)×10-3mm2,斑块面积43.58 mm2,比例13.03%;青蒿素组动脉管腔面积(350.36±39.73)×10-3mm2,斑块面积28.22 mm2,比例8.05%。青蒿素处理后的 ApoE-/-小鼠心脏三尖瓣部位的动脉粥样硬化斑块面积平均值较PBS处理组明显减少,差异有统计学意义(P<0.05)。PBS处理组和青蒿素组间的主动脉部位动脉粥样硬化斑块面积百分比平均值比较差异有统计学意义(13.03% vs.8.05%,P<0.05)。见图3。
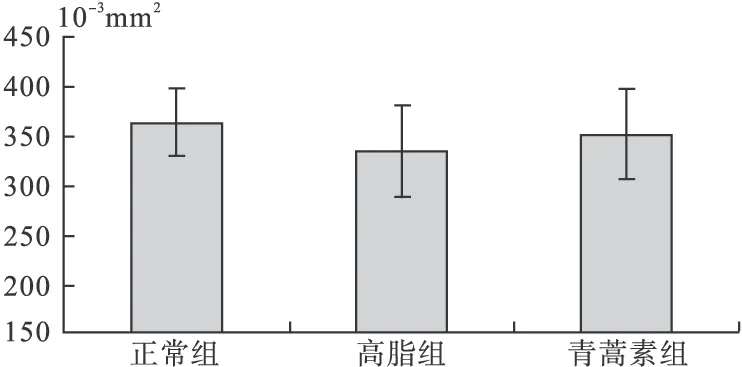
图3 小鼠主动脉管腔面积
PBS处理组炎症因子的TNF-α、hs-CRP表达较对照组明显升高(P<0.05),SOD明显下降(P<0.05);青蒿素组炎症表达有所改变,与PBS处理组比较差异有统计学意义。见表2。
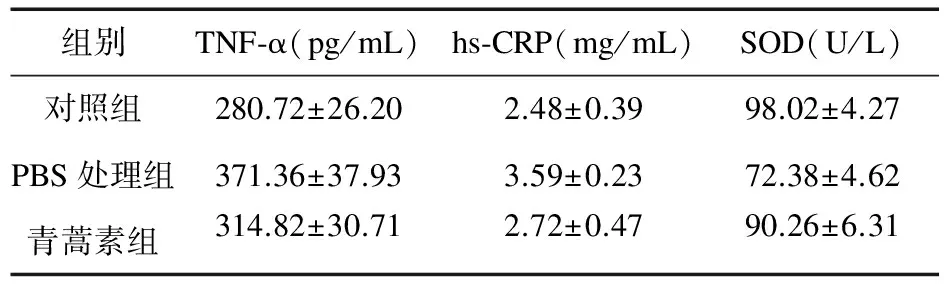
表2 三组小鼠炎症因子表达情况
3 讨论
动脉硬化是一种严重威胁人类健康的疾病,发病率和致残率均高,其防治日益受到重视[7-8]。动脉硬化可能与内皮损伤、氧化应激、炎症反应、平滑肌增殖等多方面因素有关[9]。ApoE-/-基因敲除小鼠动脉粥样硬化模型由于造模较容易,并且与人类动脉硬化相似度高,而被广泛应用于科学研究[10]。
青蒿素化学结构中存在内过氧桥,断裂后产生的碳中心自由基分子和ROS是其发挥药理学和毒理学作用的共同结构基础。近年来,关于青蒿素的研究已经从抗疟疾治疗领域扩展到针对炎症、氧化及平滑肌增殖等诸多领域[11-12]。笔者前期试验中进行了不同剂量的筛选以及细胞毒理学研究。本研究选取100 mg/kg的青蒿素[13-14],针对青蒿素对ApoE-/-基因敲除小鼠早期动脉硬化程度的影响以及动脉硬化中的炎症因子进行了检测。从炎症角度评价青蒿素延缓动脉硬化进程的作用。体视显微镜及光镜下均显示,对于易患个体(ApoE-/-基因敲除小鼠),高脂饮食明显促进主动脉动脉硬化程度进展。给予干预因素(青蒿素治疗)后,动脉硬化程度得到延缓。青蒿素干预组的斑块百分比明显降低,主动脉管腔面积增加,同时炎症因子CRP、肿瘤坏死因子水平明显降低。提示青蒿素具有通过抑制炎症反应、改善氧化应激等途径延缓动脉硬化进程的作用。研究表明,其通过NF-κB和 MAPK调节炎症反应[15-16]。具体剂量方法、作用环节有待进一步研究证实[17-18]。
[1] Ross R.Atherosclerosis-an inflammatory disease[J].N Engl J Med,1999,340(2):115-126.
[2] Wang Z,Hu W,Zhang JL,et al.Dihydroartemisinin induces autophagy and inhibits the growth of iron-loaded human myeloid leukemia K562 cells via ROS toxicity[J].FEBS Open Bio,2012,2:103-112.
[3] Lai HC,Singh NP,Sasaki T.Development of artemisinin compounds for cancer treatment[J].Invest New Drugs,2013,31(1):230-246.
[4] Tu Y.The discovery of artemisinin (qinghaosu) and gifts from Chinese medicine[J].Nat Med,2011,17(10):1217-1220.
[5] Park KH,Yoon YD,Han SB,et al.Artemisinin inhibits lipopolysaccharide-induced interferon-β production in RAW 264.7 cells:implications on signal transducer and activator of transcription-1 signaling and nitric oxide production[J].Int Immunopharmacol,2012,14(4):580-584.
[6] Li Y,G ZC,Wang XH,et al.Progression of atherosclerosis in ApoE-knockout mice fed on a high-fat diet[J].Eur Rev Med Pharmacol Sci,2016,20(18):3863-3867.
[7] Yan J,Zang X,Chen R,et al.The clinical implications of increased cyclophilin A levels in patients with acute coronary syndromes[J].Clin Chim Acta,2012,413(7-8):691-695.
[8] 郭晓玲,李琳,李岩,等.不同剂量纤溶酶联合他汀类药物治疗颈动脉硬化斑块临床效果分析[J].中国医药,2016,11(12):1781-1784.
[9] Wei Y,Jinchuan Y,Yi L,et al.Antiapoptotic and proapoptotic signaling of cyclophilin A in endothelial cells[J].Inflammations,2013,36:567-572.
[10]陈玲,于杨,陈曼华.哌唑嗪对ApoE基因敲除小鼠动脉粥样硬化的影响[J].实用医学杂志,2016,32(13):2123-2126.
[11]Tan SS,Ong B,Cheng C,et al.The antimalarial drug artesunate inhibits primary human cultured airway smooth muscle cell proliferation[J].Am J Respir Cell Mol Biol,2014,50(2):451-458.
[12]Ghaffarifar F,Esavand HF,Dalimi A,et al.Evaluation of apoptotic and antileishmanial activities of artemisinin on promastigotes and Balb/C mice infected with leishmania major[J].Iran J Parasitol,2015,10(2):258-267.
[13]Wang HY,Huang RP,Han P,et al.The effects of artemisinin on the proliferation and apoptosis of vascular smooth muscle cells of rats[J].Cell Biochem Funct,2014,32(2):201-208.
[14]Cao Q,Jiang Y,Shi J,et al.Artemisinin inhibits tumour necrosis factor-α-induced vascular smooth muscle cell proliferation in vitro and attenuates balloon injury-induced neointima formation in rats[J].Clin Exp Pharmacol Physiol,2015,42(5):502-509.
[15]Yoon JJ,Lee YJ,Han BH,et al.Protective effect of betulinic acid on early atherosclerosis in diabetic apolipoprotein-E gene knockout mice[J].Eur J Pharmacol,2017,796:224-232.
[16]Wang KS,Li J,Wang Z,et al.Artemisinin inhibits inflammatory response via regulating NF-κB and MAPK signaling pathways[J].Immunopharmacol Immunotoxicol,2017,39(1):28-36.
[17]Lee KP,Park ES,Kim DE,et al.Artemisinin attenuates platelet-derived growth factor BB-induced migration of vascular smooth muscle cells[J].Nutr Res Pract,2014,8(5):521-525.
[18]Kocks M,Jessup W.Atherosclerosis cellular pathway in atherogenesis[J].Pharmacol Ther,2010,128:106-118.
Effect of artemisinin on atherosclerosis of ApoE-knockout mice
CAO Qian*,DU Hong-jiao,SHI Jin,LI Xiao-dong
(Shengjing Hospital of China Medical University,Shenyang 110004,China)
Objective To explore the influence of artemisinin on atherosclerosis and the inflammatory factors of ApoE-knockout mice.Methods Twenty rigorously selected ApoE-knockout mice were randomly divided into artemisinin-treated group (ATG) and PBS-treated group (PTG),and 10 C57 mice were chosen as control group (CHFG).After 8 weeks of high-fat diet,HE staining and oil-red staining were administrated to evaluate the degree of artery atherosclerosis,and detect the plasma levels of inflammatory cytokine.Results Compared with CHFG,the degrees of artery atherosclerosis of ATG group and PTG group exacerbated and the plasma levels of inflammatory cytokine were dramatically elevated (P<0.05).The degree of artery atherosclerosis and plasma levels of inflammatory cytokine in ATG groups were lower than those of PTG group (P<0.05).Conclusion Artemisinin can inhibit the atherosclerotic progress of high-fat fed ApoE-knockout mice.
Artemisinin;ApoE knock-out mice;Atherosclerosis
2017-01-23
中国医科大学附属盛京医院,沈阳 110004
辽宁省省直医院改革重点临床科室诊疗能力建设项目(LNCCC-D10-2015);中国医科大学附属盛京医院优秀博士课题资助项目(201608)
10.14053/j.cnki.ppcr.201706001
*通信作者
——青蒿素

