HPV45-L1和HPV58-L1蛋白植物表达载体的构建及水稻转基因植株的鉴定
王聚财,刘运超,陈玉梅,,孟凤丽,,王爱萍,张二芹,许倩茹,邓瑞广,张改平,
(1.河南农业大学 牧医工程学院,河南 郑州 450002;2.河南省农业科学院 河南省动物免疫学重点实验室,农业部动物免疫学重点实验室,河南 郑州 450002;3.郑州大学 生命科学学院,河南 郑州 450001)
HPV45-L1和HPV58-L1蛋白植物表达载体的构建及水稻转基因植株的鉴定
王聚财1,刘运超2,陈玉梅2,3,孟凤丽2,3,王爱萍3,张二芹1,许倩茹1,邓瑞广2,张改平1,2
(1.河南农业大学 牧医工程学院,河南 郑州 450002;2.河南省农业科学院 河南省动物免疫学重点实验室,农业部动物免疫学重点实验室,河南 郑州 450002;3.郑州大学 生命科学学院,河南 郑州 450001)
利用水稻胚乳细胞生物反应器,构建含有HPV45-L1和HPV58-L1基因的重组植物表达载体,为HPV-45L1和HPV58-L1蛋白的表达提供一种新的高效、低廉的表达方式。利用PCR技术克隆人乳头瘤病毒HPV45-L1和HPV58-L1蛋白编码基因,将其重组于中间载体pMP3和植物表达载体pCAMBIA-1300中,构建含HPV45-L1和HPV58-L1基因的植物表达载体pCAMBIA-1300-pMP3-HPV45-L1、pCAMBIA-1300-pMP3-HPV58-L1,随后采用根癌农杆菌侵染水稻愈伤组织介导的水稻遗传转化,获得HPV-L1转基因水稻植株。PCR检测结果表明,HPV45-L1和HPV58-L1基因已整合到水稻基因组中,说明已成功构建水稻胚乳特异性表达载体。
人乳头瘤病毒;转基因水稻;水稻胚乳特异性启动子;根癌农杆菌
水稻是我国主要的粮食作物之一,是一种低成本、高收益、高安全的农作物。目前,水稻基因组的全序列已经被测定,这为开展水稻遗传转化方面的研究工作提供了基础。近年来,转基因水稻作为生物反应器生产药用生物大分子的研究发展迅速[1],利用其胚乳表达的蛋白遭受蛋白酶降解的可能性较低[2],因此,水稻胚乳表达系统表达外源蛋白已经被广泛应用,但大多还停留在实验室研究阶段。通过转基因技术,可将重组蛋白质定向储藏在蛋白体,避免了蛋白酶的降解,在种子成熟过程中不断地积累,从而获得较高表达[3-4]。同时,水稻作为生物反应器,具有成本低、操作简便、蛋白活性高等优点[5]。
人乳头瘤病毒(Humanpapillomavirus,HPV)感染是宫颈癌发生的直接病因[6],体外表达的HPV主要衣壳蛋白L1可组装成病毒样颗粒(Virus-like particles,VLPs)[7],这种VLPs结构在动物模型中可刺激机体产生长效的中和抗体[8-9],已用于开发预防性HPV疫苗。目前已经上市的HPV疫苗主要是利用杆状病毒表达系统或酵母表达系统在体外表达L1蛋白,制备VLPs疫苗[10-11],但是由于生产工艺复杂、成本较高等因素,使该类VLPs疫苗在发展中国家的推广应用受到限制。目前,转基因植物已被公认是制备各种基因工程蛋白中最价廉、最方便的生物反应器,常用的转基因植物有马铃薯、水稻、番茄、拟南芥、烟草等[12-14]。本研究尝试在转基因水稻中制备HPV -L1蛋白制备VLPs疫苗。利用水稻胚乳生物反应器,应用遗传工程和DNA重组技术,将经过优化人工合成的HPV45-L1和HPV58-L1基因克隆于水稻表达载体中,通过根瘤农杆菌介导将其转入水稻愈伤组织,获得表达HPV45-L1和HPV58-L1蛋白的转基因水稻植株,为获得HPV-L1蛋白提供一种更为廉价的途径。
1 材料和方法
1.1 试验材料
1.1.1 质粒及菌株 TP309水稻种子、根癌农杆菌EHA105、中间载体pMP3、植物表达载体pCAMBIA1300由武汉禾元科技股份有限生物公司提供。大肠杆菌DH5α、BL21(DE3)感受态细胞购于TaKaRa公司。pUC57-HPV45-L1、pUC57-HPV58-L1经水稻密码子优化后由南京金斯瑞科技有限公司合成。
1.1.2 试验试剂 各种限制性内切酶购自NEB公司。头孢霉素(Cep)、卡那霉素(Kan)、利福平(Rif)、乙酰丁香酮(Acetosyringone,AS)和植物激素6-苄氨基腺嘌呤(6-Benzylaminopurine,6-BA)、萘乙酸(1-Naphthylacetic acid,NAA)、吲哚-3-乙酸(Indole-3-acetic acid,IAA)、6-糖基氨基嘌呤(Kinetin,KT)等购自Biosharp公司。潮霉素B(Hygromycin B)购自Roche公司。质粒提取试剂盒和切胶回收试剂盒购自Axygen公司。
1.1.3 培养基 LB、MS培养基、N6培养基、诱导培养基、共培养基、农杆菌悬浮培养基、筛选培养基、分化培养基及生根培养基参照武汉禾元科技股份有限生物公司提供方法配制。
1.2 试验方法
1.2.1 基因序列分析及优化合成 通过检索数据库(http://www.ncbi.nlm.nih.gov),获得HPV45-L1及HPV58-L1基因及氨基酸序列,结合已有文献报道中对不同变异体蛋白产生及组装效率的分析筛选出合适的基因序列,再根据水稻密码子偏爱性情况,利用生物信息学分析优化并合成含有HPV45-L1及HPV58-L1蛋白编码基因的pUC57-HPV45-L1、pUC57-HPV58-L1,在合成基因N端引入MlyⅠ酶切位点;在C端引入XhoⅠ酶切位点。同时设计合成2对特异性鉴定引物(表1)

表1 重组植物表达载体鉴定用引物
1.2.2 水稻胚乳特异性表达载体pCAMBIA1300-pMP3-HPV45-L1及pCAMBIA1300-pMP3-HPV58-L1的构建 将优化合成的基因pUC57-HPV45-L1和pUC57-HPV58-L1分别经XhoⅠ和MlyⅠ双酶切,中间载体pMP3经XhoⅠ和NaeⅠ双酶切,37 ℃2 h后切胶回收,经T4连接酶16 ℃过夜连接,构建中间载体pMP3-HPV45-L1、pMP3-HPV58-L1。用限制性内切酶Hind Ⅲ和EcoR Ⅰ双酶切植物表达载体pCAMBIA1300和重组载体pMP3-HPV45-L1、pMP3-HPV58-L1,切胶回收经T4连接酶16 ℃过夜连接,构建水稻胚乳特异性表达载体。经菌液PCR、双酶切鉴定后送样测序,将成功构建的表达载体命名为pCAMBIA-1300-pMP3-HPV45-L1、pCAMBIA1300-pMP3-HPV58-L1。重组植物表达载体构建策略如图1所示。
1.2.3 水稻胚乳特异性表达载体pCAMBIA-1300-pMP3-HPV45-L1及pCAMBIA-1300-pMP3-HPV58-L1电转根癌农杆菌 分别提取表达载体pCAMBIA-1300-pMP3-HPV45-L1和pCAMBIA-1300-pMP3-HPV58-L1质粒,取2 μL阳性质粒电转化200 μL根癌农杆菌(EHA105)感受态细胞。经菌液PCR鉴定为阳性后,分别命名为EHA105-pCAMBIA-1300-pMP3-HPV45-L1和EHA105-1300-pCAMBIA-pMP3-HPV58-L1用于介导水稻的遗传转化。
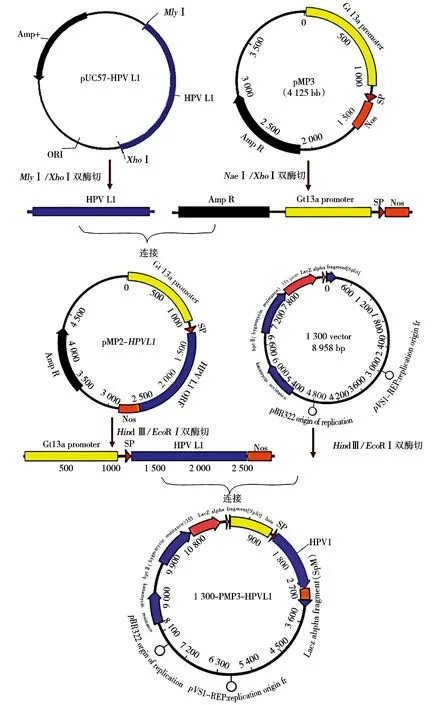
图1 植物表达载体构建策略
1.2.4 水稻愈伤组织的获得 取成熟的TP309水稻种子,脱壳后置于37 ℃恒温箱2 d。在超净台上用20%的次氯酸钠(加入1~2滴吐温20)浸泡30 min,用无菌水冲洗6次,后用无菌滤纸吸干水分,置于诱导培养基中,26 ℃光照培养9~10 d,挑取生长状态良好的愈伤组织用于根癌农杆菌侵染试验。
1.2.5 水稻胚乳表达系统的遗传转化 将重组根癌农杆菌1∶100接种于含有50 mg/L Kan和50 mg/L Rif的液体LB中,28 ℃,200 r/min过夜培养,取200 μL均匀涂抹在含有50 mg/L Kan和50 mg/L Rif的LB固体培养基上,28 ℃暗培养2 d。用无菌勺子将重组根癌农杆菌刮至300 mL农杆菌悬浮培养基(AMM)中,于28 ℃,200 r/min 培养3 h,待菌液长至OD600为0.6~0.8时,侵染水稻的愈伤组织30~40 min,此间要不时地摇动,后弃菌液,用无菌滤纸吸干多余的菌液。将侵染后的愈伤组织接种到共培养基上,25 ℃暗培养3 d后移至无菌三角瓶内,先用4 L无菌水冲洗至溶液澄清,每隔5 min换一次液,再用2 L含有0.5 g/L头孢水冲洗,每隔15 min换一次液最后用无菌滤纸吸干愈伤组织表面的水分,置于无菌滤纸上晾干后转移至筛选培养基,26 ℃暗培养30~35 d,挑选质地紧实、嫩黄的愈伤组织转移至分化培养基中,26 ℃、光照条件下培养约30 d再转移至生根培养基中,26 ℃、光照条件下培养30 d。待根系完全长出后,移栽至温室培养10~14 d。
1.2.6 转基因水稻叶片DNA的提取 利用十六烷基三甲基溴化铵法(Cetyltrimethylammonium Ammonium Bromide,CTAB)提取水稻叶片DNA,取500 mg T0转基因水稻新鲜叶片,用组织研磨器研碎,加入500 μL预热的2 % CTAB分离提取液,轻轻转动混匀后置于65 ℃水浴锅中45 min,加入等体积氯仿-异戊醇(24∶1)抽提,12 000 r/min离心10 min。上清移至新的EP管中,加入2/3体积的异戊醇轻轻混匀,-20 ℃静置1~2 h。12 000 r/min离心10 min,弃上清。用700 μL 70%无水乙醇洗涤沉淀2~3次,干燥后溶于80 μL TE中。
1.2.7 转基因水稻的PCR检测 取1 μL总DNA,分别用HPV45-L1和HPV58-L1上下游引物(F45/R45;F58/R58)进行PCR鉴定,扩增条件:95 ℃预变性10 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,30个循环;72 ℃延伸10 min。以未转入HPV-L1基因的水稻植株叶片DNA为阴性对照,以相应质粒 DNA 为阳性对照。
2 结果与分析
2.1 中间表达载体pMP3-HPV45-L1及pMP3-HPV58-L1的鉴定
中间表达载体pMP3-HPV45-L1、pMP3-HPV58-L1的菌液PCR产物经1%琼脂糖凝胶电泳分析,分别在约499,466 bp处可见特异性条带,大小与预期相符(图2)。经Hind Ⅲ/EcoR Ⅰ双酶切鉴定电泳结果显示,阳性质粒有2条带其中3 100 bp条带包括水稻特异性启动子Gt13a、HPV-L1基因、信号肽SP及终止子,大小与预期相符(图3)。
2.2 重组植物表达载体pCAMBIA-1300-pMP3-HPV45-L1及pCAMBIA-1300-pMP3-HPV58-L1的鉴定
重组植物表达载体pCAMBIA-1300-pMP3-HPV45-L1 、pCAMBIA-1300-pMP3-HPV58-L1菌液PCR产物经1%琼脂糖凝胶电泳分析,在约499,466 bp处可见特异性条带,大小与预期相符(图4)。植物表达载体pCAMBIA-1300-pMP3-HPV45-L1、pCAMBIA1300-pMP3-HPV58-L1质粒双酶切(Hind Ⅲ/EcoR Ⅰ)产物经1%琼脂糖凝胶电泳分析,可见2条带,大小分别与预期载体片段和目的基因片段相符(图5)。
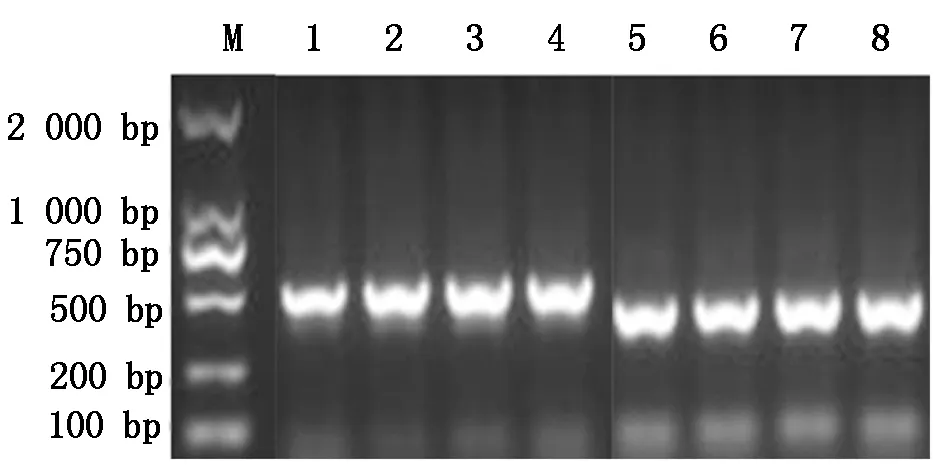
M.DL2000;1~3.pMP3-HPV45-L1单菌落;4. pUC57-HPV45-L1质粒(阳性对照);5~7.pMP3-HPV58-L1单菌落;8. pUC57-HPV58-L1质粒(阳性对照)。
M.DL2000;1-3:The single colony of pMP3-HPV45-L1 strains;4.pUC57-HPV45-L1 plasmid(PC);5-7.The single colony of pMP3-HPV58-L1 strains;8.pUC57-HPV58-L1 plasmid(PC).
图2 重组质粒 pMP3-HPV45-L1、pMP3-HPV58-L1菌液PCR鉴定
Fig.2 Identification of recombinant plamids pMP3-HPV45-L1 and pMP3-HPV58-L1 by PCR amplification

M.DL10000;1~3.Hind Ⅲ/EcoR Ⅰ双酶切pMP3-HPV45-L1质粒;4~6.Hind Ⅲ/EcoR Ⅰ双酶切pMP3-HPV58-L1质粒。
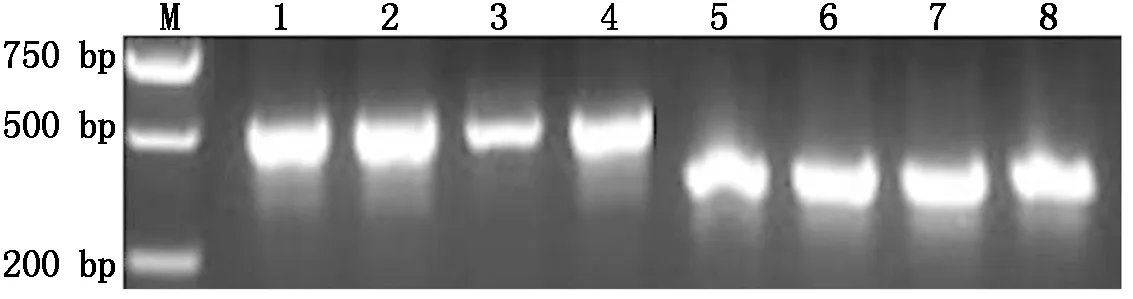
M.DL2000;1~4.pCAMBIA-1300-pMP3-HPV45-L1单菌落;5~8.pCAMBIA-1300-pMP3-HPV58-L1单菌落。
2.3 重组根癌农杆菌表达载体EHA105-pCAMBIA-1300-pMP3-HPV45-L1及EHA105-pCAMBIA-1300-pMP3-HPV58-L1的鉴定
分别取2 μL成功构建的植物表达载体pCAMBIA-1300-pMP3-HPV45-L1和pCAMBIA-1300-pMP3-HPV58-L1阳性质粒电转根癌农杆菌EHA105,菌液PCR产物经1%琼脂糖凝胶电泳分析,在约499,466 bp处可见特异性条带,大小与预期相符(图6,7)。
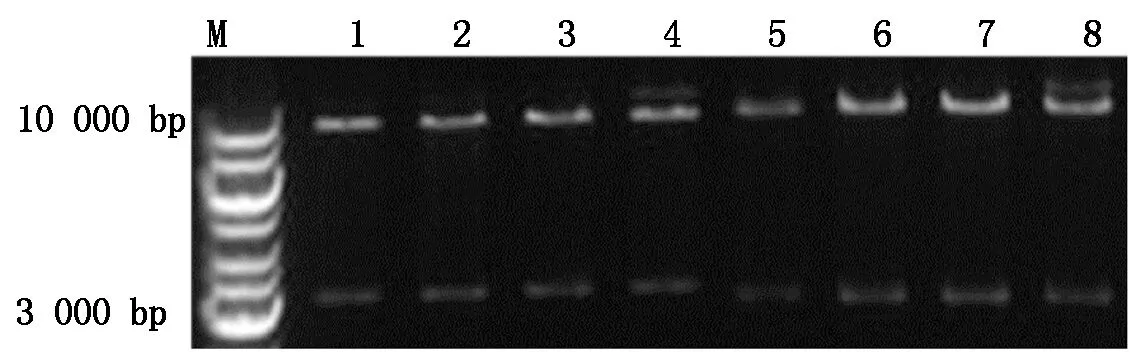
M.DL10000;1~4.Hind Ⅲ/EcoR Ⅰ双酶切pCAMBIA-1300-pMP3-HPV45-L1质粒;5~8.Hind Ⅲ/EcoR Ⅰ双酶切pCAMBIA-1300-pMP3-HPV58-L1质粒。
M.DL10000;1-4.pCAMBIA-1300-pMP3-HPV45-L1 plasmids enzymed byHind Ⅲ andEcoR Ⅰ;5-8.pCAMBIA1300-pMP3-HPV58-L1 plasmids enzymed byHind Ⅲ andEcoR Ⅰ
图5 重组质粒的双酶切鉴定
Fig.5 Identification of recombinant plasmid by enzyme digestion
2.4 水稻胚乳表达系统的遗传转化
分别用含有HPV45-L1、HPV58-L1基因的根瘤农杆菌浸染水稻愈伤组织,在潮霉素的抗性筛选下选择培养30~35 d,愈伤组织分化出新的嫩黄、质地坚硬的抗性愈伤组织,抗性愈伤组织经分化、生根培养得到转基因水稻(图8)。
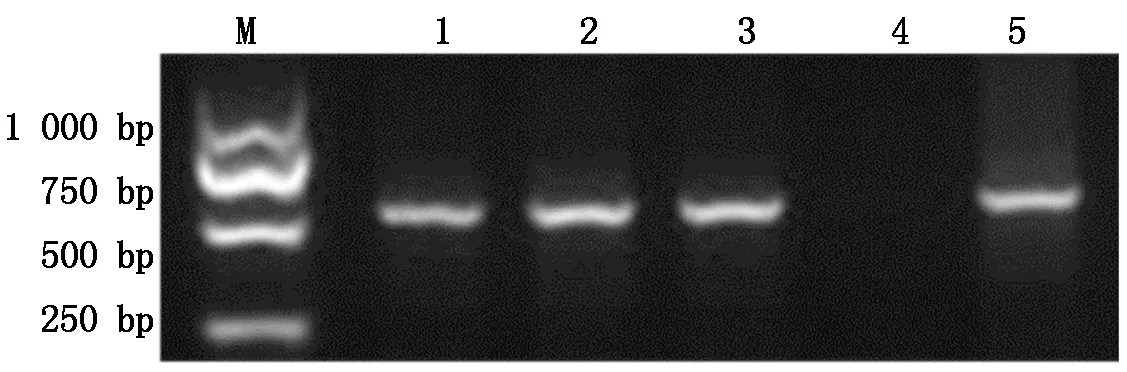
M.DL2000;1~5.EHA105-pCAMBIA-1300-pMP3-HPV45-L1单菌落。
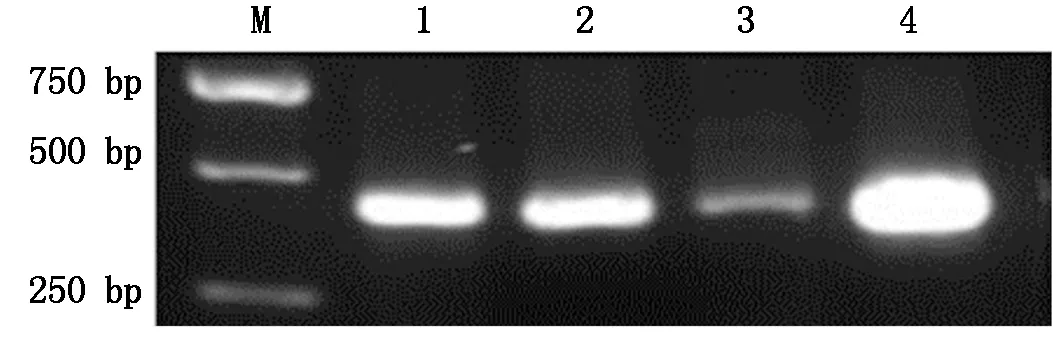
M.DL2000;1~4.EHA105-pCAMBIA-1300-pMP3-HPV58-L1单菌落。

图8 水稻胚乳介导的遗传转化
2.5 转基因水稻阳性植株的鉴定
将含有潮霉素抗性的阳性转基因水稻移栽到温室练苗7~14 d,利用CTAB法分别提取转基因水稻T0叶片DNA。经PCR鉴定(图9,10),28株抗性水稻植株中共筛选20株含有HPV45-L1基因(499 bp左右有目的条带)的阳性转基因水稻植株;40株抗性水稻植株中共筛选22株含有HPV58-L1基因的(466 bp左右有目的条带)阳性转基因水稻植株;而阴性对照未扩增出任何条带,说明HPV-L1基因已整合到水稻基因组中。
3 结论与讨论
目前已上市的HPV预防性疫苗主要是基于L1蛋白自组装或是L1、L2蛋白共同组装形成的VLPs疫苗[15],与传统疫苗相比,VLPs疫苗相对比较安全,而且具有较高的免疫原性[16]。现有的预防性VLPs疫苗采用昆虫细胞或酵母表达体系制备,生产成本较高,极大地限制了疫苗在发展中国家的推广应用。有研究显示:HPV-L1蛋白可在不同植物中实现可溶性表达:Warzecha等[17]在鲜马铃薯块茎中表达的HPV11-L1-NLS-,L1蛋白含量可达20 ng/g;Kohl等[18]已成功地利用转基因烟草、拟南芥表达HPV11-L1-NLS-蛋白,其在拟南芥中含量高达12 μg/g,而在转基因烟草中为2 μg/g;Lamprecht等[19]利用转基因烟草表达HPV16假病毒(Pseudovirions,PsVs),首次证实转基因植物可用于制备哺乳动物假病毒,并证明利用转基因植物制备DNA疫苗具有可能性。水稻是世界上重要的粮食作物,并已为分子生物学研究的模式作物之一,因此,遗传转化已成为水稻分子生物学研究和基因工程的必需手段。He等[20]已成功应用水稻胚乳表达系统表达Osr HSA,占水稻可溶性蛋白的10.58%,且纯度高达99%,AN等[21]表达的OsrbFGF产量可达8.33 mg/kg,表明水稻胚乳表达系统作为一种新的植物表达系统表达外源重组蛋白。
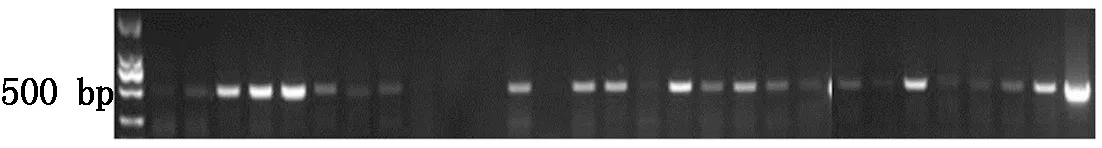
图9 HPV45-L1转基因水稻PCR鉴定
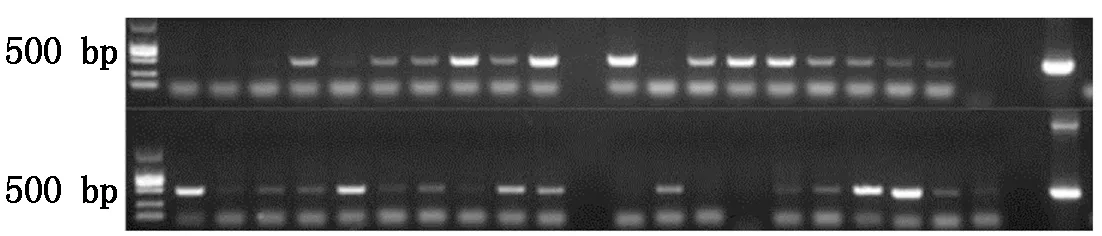
图10 HPV58-L1转基因水稻PCR鉴定
经研究实践证实,利用转基因植物作为生物反应器生产HPVVLPs疫苗或DNA疫苗在理论上是可行的,同时基于转基因水稻作为生物反应器的诸多优势,本研究构建了HPV45-L1、HPV58-L1水稻胚乳特异性表达载体,该表达载体具有完整的植物表达调控元件,如水稻胚乳特异性启动子Gt13a、信号肽序列SP、潮霉素筛选基因及左右边界序列等植物表达系统所必须的元件以及目的基因HPV45-L1或HPV58-L1编码区序列。将成功构建的重组表达菌株EHA105-pCAMBIA-1300-pMP3-HPV45-L1及EHA105-pCAMBIA-1300-pMP3-HPV58-L1分别浸染水稻愈伤组织,在潮霉素抗性培养基筛选分别获得28,40株转基因水稻植株;随后提取转基因水稻叶片DNA并进行PCR鉴定,最终筛选出20株含的HPV45-L1基因和22株含的HPV58-L1基因的转基因水稻,说明构建的水稻胚乳特异性表达载体适用于根瘤农杆菌介导的水稻遗传转化,为HPV45或HPV58亚型L1蛋白在水稻胚乳表达系统中的成功表达奠定基础。
[1] Marino M H. Expression systems for heterologous protein production[J]. Biopharm,1989,2:18
[2] Horn M E, Woodard S L, Howard J A. Plant molecular farming: systems and products[J]. Plant Cell Reports, 2004, 22(10): 711-720.
[3] 王瑞刚,王水平.外源蛋白表达系统及利用植物表达外源蛋白的特点与优势[J].生物学通报,2003,38(1):11-12.
[4] 段永波,赵丰兰,倪大虎,等.水稻胚乳表达药用重组蛋白研究进展[J].中国新药杂志,2014(7):787-792.
[5] 杜小春,何正权,陈 磊,等.植物生物反应器表达药用蛋白研究新进展[J].中国生物工程杂志,2008,28(9):135-143.
[6] Villiers E M de. Cross-roads in the classification of papillomaviruses[J]. Virology, 2013, 445(1/2): 2-10.
[7] Kirnbauer R, Taub J, Greenstone H, et al. Efficient self-assembly of human papillomavirus type 16 L1 and L1-L2 into virus-like particles[J]. Journal of Virology, 1993, 67(12): 6929-6936.
[8] Buck C B, Day P M, Trus B L. The papillomavirus major capsid protein L1[J]. Virology, 2013, 445(1/2): 169-174.
[9] Hanumantha RAO N, Bajibabu P, Rajendra L, et al. Expression of codon optimized major capsid protein (L1) of human papillomavirus type 16 and 18 in Pichiapastoris; purification and characterization of the virus-like particles[J]. Vaccine, 2011, 29(43): 7326-7334.
[10] Mckee S J, Bergot A S, Leggatt G R. Recent progress in vaccination against human papillomavirus-mediated cervical cancer[J]. Reviews in Medical Virology, 2015, 25(1): 54-71.
[11] Shaw A R. Human papillomavirus vaccines six years after approval[J]. Annual Review of Medicine, 2013, 64(1): 91-100.
[12] Mason H S, Ball J M, Shi J J, et al. Expression of Norwalk virus capsid protein in transgenic tobacco and potato and its oral immunogenicity in mice[J]. Proceedings of the National Academy of Sciences of the United States of America, 1996, 93(11): 5335-5340.
[13] Mcgarvey P B, Hammond J, Dienelt M M, et al. Expression of the rabies virus glycoprotein in transgenic tomatoes[J]. Bio/Technology, 1995, 13(13): 1484-1487.
[14] Wigdorovitz A, Carrillo C, Dus Santos M J, et al. Induction of a protective antibody response to foot and mouth disease virus in mice following oral or parenteral immunization with alfalfa transgenic plants expressing the viral structural protein VP1[J]. Virology, 1999, 255(2): 347-353.
[15] Kumar S, Biswas M, Jose T. HPV vaccine: Current status and future directions[J]. Medical Journal Armed Forces India, 2015, 71(2): 171-177.
[16] Wang J W, Roden R B. Virus-like particles for the prevention of human papillomavirus-associated malignancies[J]. Expert Review of Vaccines, 2013, 12(2): 129-141.
[17] Warzecha H, Mason H S, Lane C, et al. Oral immunogenicity of human papillomavirus-like particles expressed in potato[J]. Journal of Virology, 2003, 77(16): 8702-8711.
[18] Kohl T O, Hitzeroth I I, Christensen N D, et al. Expression of HPV-11 L1 protein in transgenicArabidopsisthalianaandNicotianatabacum[J]. BMC Biotechnology, 2007, 7(3): 56.
[19] Lamprecht R L, Kennedy P, Huddy S M, et al. Production of human papillomavirus pseudovirions in plants and their use in pseudovirion-based neutralisation assays in mammalian cells[J]. Scientific Reports, 2016, 6: 20431.
[20] He Yang, NING Tingting, XIE Tingting, et al. Large-scale production of functional human serum albumin from transgenic rice seeds[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(47): 19078-19083.
[21] AN Na, OU Jiquan, JIANG Daiming, et al. Expression of a functional recombinant human basic fibroblast growth factor from transgenic rice seeds[J]. International Journal of Molecular Sciences, 2013, 14(2):3556-3567.
Construction of HPV45-L1 and HPV58-L1 Plant Expression Vectors and Identification of Transgenic Rice Plants
WANG Jucai1,LIU Yunchao2,CHEN Yumei2,3,MENG Fengli2,3,WANG Aiping3,ZHANG Erqin1,XU Qianru1,DENG Ruiguang2,ZHANG Gaiping1,2
(1.College of Animal Science and Veterinary Medicine,Henan Agricultural University,Zhengzhou 450002,China;2.Key Laboratory of Animal Immunology of Ministry of Agriculture,Henan Key Laboratory of Animal Immunology,Henan Academy of Agricultural Sciences,Zhengzhou 450002,China;3.School of Life Sciences,Zhengzhou University,Zhengzhou 450001,China)
The rice seeds were used as the cell bioreactor to construct the recombinant plant expression vector containingHPV45-L1 andHPV58-L1 genes to provide a new efficient and inexpensive method forHPV45-L1 andHPV58-L1 protein expression.TheHPV45-L1 andHPV58-L1 coding sequence(ORF)was amplified by PCR and then subcloned into middle vector pMP3 and plant expression vector pCAMBIA-1300 to construct the rice endosperm-specific expression vector pCAMBIA-1300-pMP3-HPV45-L1 and pCAMBIA-1300-pMP3-HPV58-L1.Subsequently,the transgenic rice plants containingHPV-L1 ORF gene were obtained by agrobacterium-mediated genetic transformation of rice callus.The PCR test showed that theHPV45-L1 andHPV58-L1 genes had integrated into the rice genome,suggesting the successful construction of rice endosperm specific expression vectors.
Humanpapillomavirus;Transgenic rice;The rice specific endosperm-promoter;Agrobacteriumtumefaciens
2016-11-08
河南省高校科技创新团队和创新人才支持计划(14HASTIT027)
王聚财(1990-),女,河南洛阳人,硕士,主要从事疫病与疫苗研究。
张改平(1960-),男,河南内黄人,院士,博士生导师,主要从事动物免疫学及动物病毒分子致病机制研究。
Q78;S511.03
A
1000-7091(2017)02-0055-06
10.7668/hbnxb.2017.02.009

