亚低温对脑缺血再灌注大鼠血管内皮生长因子和低氧诱导因子-1α表达的影响①
程黎,贾功伟
亚低温对脑缺血再灌注大鼠血管内皮生长因子和低氧诱导因子-1α表达的影响①
程黎1,贾功伟2
目的探讨亚低温对脑缺血再灌注大鼠内皮生长因子(VEGF)和低氧诱导因子-1α(HIF-1α)表达的影响。方法30只Sprague-Dawley大鼠随机分为假手术组、模型组和亚低温组,每组10只。后两组制备大脑中动脉闭塞(MCAO)2 h再灌注动物模型,亚低温组进行亚低温处理24 h。Longa评分评估各组大鼠神经功能;湿/干重法测定脑含水量;TTC染色观察脑梗死体积;ELISA法检测脑组织VEGF、HIF-1α蛋白含量;qPCR法检测脑组织VEGF mRNA水平。结果与假手术组比,模型组神经行为学评分升高,脑含水量及脑梗死率增加,脑组织HIF-1α蛋白、VEGF蛋白及mRNA水平上调(P<0.05)。与模型组比,亚低温组神经神经行为学评分显著降低(χ2=26.657,P<0.001),脑含水量及脑梗死率降低,脑组织HIF-1α蛋白、VEGF蛋白及mRNA水平进一步上调(P<0.05)。结论亚低温可能通过HIF-1α介导VEGF上调,促进缺血组织区新生血管形成,从而发挥对缺血性脑卒中的保护作用。
缺血再灌注;亚低温;血管内皮生长因子;低氧诱导因子-1α;大鼠
[本文著录格式]程黎,贾功伟.亚低温对脑缺血再灌注大鼠血管内皮生长因子和低氧诱导因子-1α表达的影响[J].中国康复理论与实践,2017,23(6):667-671.
CITED AS:Cheng L,Jia GW.Effect of mild hypothermia on expression of vascular endothelial growth factor and hypoxia-inducible factor-1α in rats with cerebral ischemia-reperfusion[J].Zhongguo Kangfu Lilun Yu Shijian,2017,23(6):667-671.
缺血性脑卒中是由于脑血管狭窄或闭塞导致脑组织缺血缺氧,脑细胞死亡,并引起神经功能缺损症状的一种疾病[1],具有高致死率及致残率的特点[2-3]。研究表明,脑缺血后血管新生可以促进缺血区侧支循环的建立,增加缺血区域组织低灌注[4],从而改善患者预后[5]。
血管内皮生长因子(vascular endothelial growth factor,VEGF)作为一种促血管内皮细胞生长、提高毛细血管渗透压的细胞因子[6],能刺激血管发生和血管再生,发挥营养神经及神经保护作用[7]。缺氧能触发VEGF的产生[8]。低氧诱导因子1α(hypoxia-inducible factor-1α,HIF-1α)是缺氧条件下哺乳动物体内一种重要的核转录因子,在组织缺氧时,其降解减少,浓度增高[9]。最近有研究发现,HIF-1α可与VEGF启动子区域的缺氧反应元件结合,从而上调VEGF的基因转录水平,增加VEGF蛋白表达[10]。
亚低温作为目前被证实有确切神经保护作用的治疗措施之一,其减轻脑缺血时脑组织梗死体积及脑水肿的作用不论在临床还是基础研究中均得到证实[11-12],但其发挥神经保护作用的分子机制尚不十分明确。有研究发现亚低温可增加局部脑缺血时海马VEGF的表达[13]。因此,我们推测亚低温可能通过HIF-1α上调VEGF的表达,刺激血管再生,改善脑缺血预后。
本研究拟通过动物实验探讨亚低温对大鼠脑缺血再灌注后皮层区VEGF表达的影响,明确亚低温在缺血性脑卒中中发挥神经保护作用的可能分子机制,为其临床应用提供更多的理论依据。
1 材料与方法
1.1 实验动物
SPF级雄性Sprague-Dawley大鼠45只,体质量180~220 g,购自重庆医科大学动物实验中心。
1.2 试剂和仪器
ELISA试剂盒:北京四正柏生物科技有限公司。总RNA提取试剂盒:北京BIOTAKE公司。RIPA裂解液及BCA蛋白浓度测定试剂盒:碧云天生物技术有限公司。大鼠肛温温度计、低温高速离心机、酶标仪等实验仪器由重庆医科大学生命科学研究院提供。
1.3 方法
45只大鼠最终纳入30只进行研究,其中死亡大鼠12只,未观察到神经损伤症状大鼠3只。30只大鼠按随机数字表分为假手术组、模型组和亚低温组,每组10只。按Longa法[14]制备大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)动物模型。大鼠称重后腹腔注射10%水合氯醛3.5 ml/kg麻醉,固定于简易手术台上,颈正中切口,钝性分离皮下组织及肌肉,暴露颈总、外动脉,在其近心端用手术线结扎,在颈总动脉近分叉处暂时夹闭血管,用手术剪剪一细切口,插入线栓,将其缓慢推入颈内动脉18~20 mm,缝合伤口,2 h后拔出栓线。动物清醒后参考Longa的5分制法进行神经行为学评分[15]。评分标准:0分,无神经损伤症状;1分,不能完全伸展对侧前爪;2分,行走时向对侧转圈;3分,行走时向对侧倾倒;4分,无法行走。
假手术组除不插入栓线外余操作步骤同前。亚低温组大鼠造模后放入装有冰袋和碎冰的代谢笼中,测大鼠肛温降至(33±1)℃,持续亚低温24 h后取出并自然复温。
模型排除标准:①Longa评分0分的大鼠;②未到观察时间点死亡的大鼠。模型成功标准:Longa评分1~4分。再灌注24 h后再次进行评分。
1.4 评价方法
1.4.1 脑含水量测定
再灌注24 h时,各组取3只大鼠10%水合氯醛过量麻醉,断头取脑,去掉低位脑干、小脑以及嗅球,滤纸吸干称重后放入60℃烤箱48 h至恒重后称干重,根据公式计算含水量:

1.4.2 TTC染色观察脑梗死体积
再灌注24 h时,各组取3只大鼠10%水合氯醛过量麻醉,断头取脑,将大脑组织置于-20℃冰箱20 min后冠状均匀切成5片,浸于2%TTC溶液,37℃培养箱中避光染色30 min,再于4%多聚甲醛固定。此时梗死区域呈白色,正常组织呈红色,拍照后用Image-Pro Plus软件计算脑梗死率:

1.4.3 ELISA法检测大鼠脑组织VEGF、HIF-1α蛋白含量
再灌注24 h时,各组取4只大鼠麻醉后经心尖处插管,生理盐水150 ml灌注,冰上取缺血半暗带区域脑组织(距额叶前端4 mm和8 mm处行冠状切片,取中间4 mm厚脑块,沿矢状线旁开4 mm,右开30°切片所得楔形组织),-80℃保存。称取脑组织,每毫克组织加入10 μl裂解液,超声裂解1 min,4℃静置30 min,12,000 r/min离心15 min,取上清。
按ELISA试剂盒说明操作:配置不同浓度梯度的标准品溶液,和稀释后的组织匀浆液一起复孔加入样品孔,100 μl/孔,封板,37℃孵育90 min。除去封板膜,倒出孔内液体,每孔加入抗大鼠VEGF或HIF-1α抗体工作液100 μl,37℃孵育60 min,洗板后每孔加入酶结合物工作液100 μl,37℃孵育30 min,洗板后每孔加入显色底物100 μl,37℃培养箱内孵育15 min后加入终止液。酶标仪450 nm处测OD值。以pg/mg表示蛋白含量。
1.4.4 qPCR法测大鼠脑组织VEGF的mRNA表达水平
于-80℃冰箱取出已取缺血半暗带区域脑组织,按总RNA提取试剂盒说明书提取大鼠脑组织总RNA,紫外分光光度计测定总RNA浓度,据反转录试剂盒说明书反转录合成cDNA,随后按扩增试剂盒说明书进行PCR扩增。VEGF的上游引物为5'-GGTGAGAGGTCTAGTTCCCGA-3',下游引物为5'-CCATGAACTTTCTGCTCTTC-3';内参β-actin的上游引物为5'-CGAGCGGGCTACAGCTTC-3',下游引物为5'-GTCACGCACGATTCCCTCT-3'。PCR反应条件:94℃5 min;94℃60 s,55℃45 s,72℃60 s,72℃10 min,共40个循环。用2-△△Ct法计算mRNA相对表达量。
1.5 统计学分析
采用SPSS 22.0统计软件进行统计分析,计量资料用(xˉ±s)表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t检验;等级资料的比较采用非参数检验。显著性水平α=0.05。
2 结果
2.1 神经行为学评分
再灌注24 h后,模型组、亚低温组神经行为学评分较假手术组均升高,亚低温组神经行为学评分显著低于模型组(P<0.001)。见表1。

表1 各组大鼠神经行为学评分(n)
2.2 脑含水量
模型组、亚低温组脑组织含水量较假手术组增加(P<0.05);亚低温组脑含水量低于模型组(P<0.05)。见表2。
2.3 脑梗死率
模型组、亚低温组脑梗死率较假手术脑梗死率均增加(P<0.05);亚低温组脑梗死率低于模型组(P<0.05)。见表2、图1。
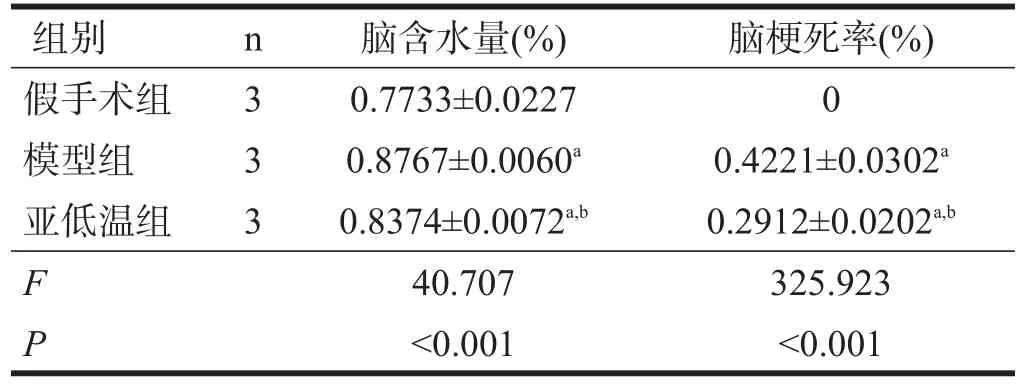
表2 各组脑含水量及梗死体积的比较
2.4 VEGF及HIF-1α蛋白水平
模型组、亚低温组脑组织VEGF及HIF-1α蛋白水平均较假手术组增高(P<0.05),亚低温组脑组织VEGF及HIF-1α蛋白水平较模型组增高(P<0.05)。见表3。

表3 各组VEGF及HIF-1α蛋白表达水平比较(pg/mg)
2.5 VEGF mRNA水平
模型组、亚低温组脑组织VEGF mRNA水平均较假手术组增高(P<0.05),亚低温组较模型组增高(P<0.05)。见表4。
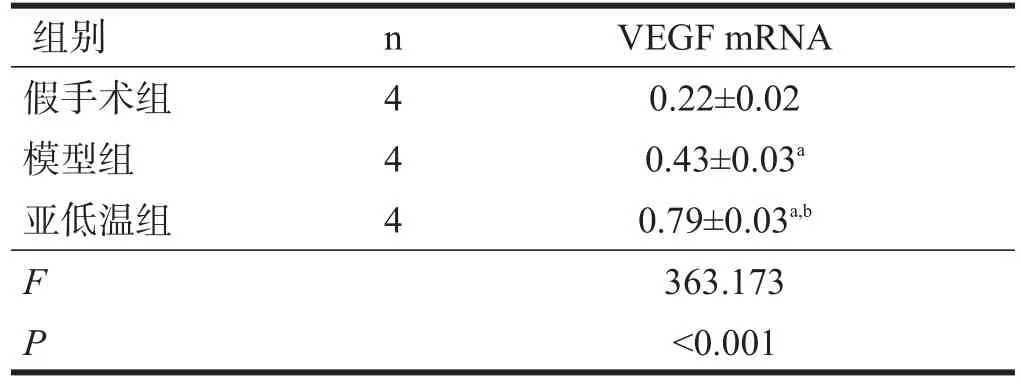
表4 各组VEGF mRNA表达水平的比较
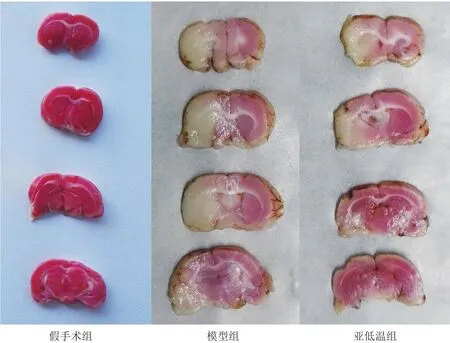
图1 各组大鼠脑TTC染色
3 讨论
本实验构建经典的模拟缺血性脑血管病的大鼠MCAO模型,旨在观察亚低温对大鼠缺血性脑梗死的影响及潜在机制。实验发现,亚低温组大鼠神经行为学评分低,脑含水量及脑梗死体积减少,证明亚低温能减轻脑水肿,缩小缺血半暗带移行区,对急性期缺血性脑卒中有保护作用。同时实验结果还显示,亚低温组HIF-1α及VEGF蛋白含量进一步增高,提示增加HIF-1α及VEGF表达可能与亚低温发挥神经保护作用有关。
脑缺血发生时,缺血中心区细胞迅速坏死,半暗区细胞处于低灌注状态,及时恢复该区血供能有效改善神经功能缺损[16]。VEGF作为参与血管重塑的关键因子之一[17],在脑缺血缺氧时表达迅速增多,能促进缺血区新生血管形成,建立侧支循环,有效改善缺血区低灌注[18-19],一直是脑血管疾病研究的热点。但仅依靠内源性血管新生恢复脑缺血后神经缺损功能效用有限,补充外源性的VEGF进一步提高其含量能促进MCAO模型大鼠血管新生[20],改善感觉和认知功能损害[21]。临床研究亦发现,脑梗死患者血清VEGF浓度与神经功能恢复正相关[22]。本研究中VEGF在假手术组呈现低表达,在模型组表达增强,与既往研究结果缺血缺氧诱导VEGF表达增多一致[20],而亚低温组VEGF较模型组进一步增高。
HIF-1是一种缺氧诱导的核转录因子[23],缺氧对HIF-1活性的调节主要通过α亚基即HIF-1α来实现[24]。组织缺氧时HIF-1α降解减少,并可通过激活乳酸脱氢酶等多种酶促进糖的转移利用,为细胞修复提供能量[25];同时HIF-1α还可结合VEGF启动子区域的缺氧反应元件,上调其表达。本实验中,HIF-1α与VEGF蛋白含量的变化趋势在各组中均保持一致,VEGF mRNA水平亦呈现同步上调,提示脑缺血时HIF-1α可在转录水平上调VEGF表达。
综上所述,亚低温可通过增加HIF-1α的表达,介导VEGF上调,促进缺血组织新生血管形成,从而发挥对缺血性脑卒中的保护作用。
[1]Doyle KP,Simon RP,Stenzel-Poore MP.Mechanisms of ischemic brain damage[J].Neuropharmacology,2008,55(3): 310-318.
[2]Moskowitz MA,Lo EH,Iadecola C.The science of stroke: mechanisms in search of treatments[J].Neuron,2010,67(2): 181-198.
[3]Yang G,Wang Y,Zeng Y,et al.Rapid health transition in China,1990-2010:findings from the Global Burden of Disease Study 2010[J].Lancet,2013,381(9882):1987-2015.
[4]Navarro-Sobrino M,Rosell A,Hernandez-Guillamon M,et al.A large screening of angiogenesis biomarkers and their association with neurological outcome after ischemic stroke[J].Atherosclerosis,2011,216(1):205-211.
[5]Ohab JJ,Fleming S,Blesch A,et al.A neurovascular niche for neurogenesis after stroke[J].J Neurosci,2006,26(50): 13007-13016.
[6]Marti HH,Risau W.Angiogenesis in ischemic disease[J]. Thromb Haemost,1999,82(Suppl 1):44-52.
[7]Greenberg DA,Jin K.From angiogenesis to neuropathology[J].Nature,2005,438(7070):954-959.
[8]Griffiths L,Dachs GU,Bicknell R,et al.The influence of oxygen tension and pH on the expression of platelet-derived endothelial cell growth factor/thymidine phosphorylase in human breast tumor cells grown in vitro and in vivo[J].Cancer Res, 1997,57(4):570-572.
[9]Karakashev SV,Reginato MJ.Hypoxia/HIF1alpha induces lapatinib resistance in ERBB2-positive breast cancer cells via regulation of DUSP2[J].Oncotarget,2015,6(4):1967-1980.
[10]Pereira ER,Frudd K,Awad W,et al.Endoplasmic reticulum (ER)stress and hypoxia response pathways interact to potentiate hypoxia-inducible factor 1(HIF-1)transcriptional activity on targets like vascular endothelial growth factor(VEGF)[J].J Biol Chem,2014,289(6):3352-3364.
[11]Van Der Worp HB,Macleod MR,Bath PM,et al.EuroHYP-1: European multicenter,randomized,phase III clinical trial of therapeutic hypothermia plus best medical treatment vs.best medical treatment alone for acute ischemic stroke[J].Int J Stroke,2014,9(5):642-645.
[12]Wu TC,Grotta JC.Hypothermia for acute ischaemic stroke[J].Lancet Neurol,2013,12(3):275-284.
[13]李飞,李树清.亚低温后适应对树鼩局部脑缺血海马CA1区神经元的保护机制[J].中国病理生理杂志,2009,25(2): 236-240.
[14]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989,20(1):84-91.
[15]Liu S,Cao Y,Qu M,et al.Curcumin protects against stroke and increases levels of Notch intracellular domain[J].Neurol Res,2016,38(6):553-559.
[16]Heiss WD.The ischemic penumbra:how does tissue injury evolve?[J].Ann N YAcad Sci,2012,1268:26-34.
[17]Sims NR,Muyderman H.Mitochondria,oxidative metabolism and cell death in stroke[J].Biochim Biophys Acta,2010, 1802(1):80-91.
[18]Emerich DF,Silva E,Ali O,et al.Injectable VEGF hydrogels produce near complete neurological and anatomical protection following cerebral ischemia in rats[J].Cell Transplant,2010, 19(9):1063-1071.
[19]Matsuo R,Ago T,Kamouchi M,et al.Clinical significance of plasma VEGF value in ischemic stroke-research for biomarkers in ischemic stroke(REBIOS)study[J].BMC Neurol, 2013,13:32.
[20]Sun Y,Jin K,Xie L,et al.VEGF-induced neuroprotection, neurogenesis,and angiogenesis after focal cerebral ischemia[J].J Clin Invest,2003,111(12):1843-1851.
[21]Wang Y,Galvan V,Gorostiza O,et al.Vascular endothelial growth factor improves recovery of sensorimotor and cognitive deficits after focal cerebral ischemia in the rat[J].Brain Res, 2006,1115(1):186-193.
[22]官俏兵,张晓玲,王琰萍,等.血清血管生长因子浓度变化与急性脑梗死后神经功能康复的关系[J].实用医学杂志,2013, 29(5):726-728.
[23]Nakamura H,Tasaki L,Kanoh D,et al.Diaryl-substituted ortho-carboranes as a new class of hypoxia inducible factor-1alpha inhibitors[J].Dalton Trans,2014,43(13):4941-4944.
[24]Liu Q,Geng H,Xue C,et al.Functional regulation of hypoxia inducible factor-1alpha by SET9 lysine methyltransferase[J]. Biochim BiophysActa,2015,1853(5):881-891.
[25]Schwartz DL,Bankson J,Bidaut L,et al.HIF-1-dependent stromal adaptation to ischemia mediates in vivo tumor radiation resistance[J].Mol Cancer Res,2011,9(3):259-270.
Effect of Mild Hypothermia on Expression of Vascular Endothelial Growth Factor and Hypoxia-inducible Factor-1α in Rats with Cerebral Ischemia-reperfusion
CHENG Li1,JIA Gong-wei2
1.Department of ICU,Chongqing Emergency Medical Center,Chongqing 400010,China;2.Department of Rehabilitation,the SecondAffiliated Hospital of Chongqing Medical University,Chongqing 400010,China
JIA Gong-wei.E-mail:jiagongwei@163.com
Objective To observe the effect of mild hypothermia on expression of vascular endothelial growth factor(VEGF)and hypoxia-inducible factor-1α(HIF-1α)in brain tissues in rats with cerebral ischemia-reperfusion.Methods Thirty Sprague-Dawley rats were randomly divided into sham group,model group and mild hypothermia group with ten rats in each group.The latter two groups were established middle cerebral artery occlusion(MCAO)for two hours and reperfusion model.The mild hypothermia group
mild hypothermia treatment for 24 hours.The neurologic function was evaluated with Longa's score.The brain water content was measured by wet/dry method.The infarction area ratio was assessed by TTC staining.The protein levels of VEGF and HIF-1α were determined by ELISA,while the mRNA level of VEGF was assessed by qPCR.Results Compared with the sham group,the score of neurologic score,the brain water content ratio and the infarction area ratio,the expression of VEGF protein and HIF-1α protein,and the mRNA level of VEGF increased in the model group(P<0.05).Compared with the model group,the score of neurologic score significantly decreased(χ2=26.657,P<0.001),the brain water content ratio and the infarction area ratio decreased(P<0.05),and the expression of VEGF protein and HIF-1α protein,and the mRNA level of VEGF further increased(P<0.05)in the mild hypothermia group.Conclusion Mild hypothermia may protect against ischemic-induced neurologic injury by up-regulating the expression of VEGF and HIF-1α,and promote the angiogenesis in the rats with cerebral ischemia-reperfusion.
ischemia-reperfusion;mild hypothermia;vascular endothelial growth factor;hypoxia-inducible factor-1α;rats
R743.3
A
1006-9771(2017)06-0667-05
2017-02-21
2017-03-31)
10.3969/j.issn.1006-9771.2017.06.010
重庆市卫生计生委2014年医学科研计划项目(No.20142077)。
1.重庆市急救医疗中心ICU,重庆市400010;2.重庆医科大学附属第二医院康复医学科,重庆市400010。作者简介:程黎(1983-),女,汉族,湖北随州市人,硕士,医师,主要研究方向:神经康复。通讯作者:贾功伟,男,主治医师。E-mail:jiagongwei@163.com。

