HPLC法同时测定不同产地龙血竭中3种黄酮类成分
李 竣,朱功俊,陈 素,刘向明,李芸芳,杨光忠
(1 中南民族大学 药学院,武汉 430074;2 中南民族大学 生物医学工程学院,武汉 430074 )
HPLC法同时测定不同产地龙血竭中3种黄酮类成分
李 竣1,朱功俊1,陈 素2,刘向明2,李芸芳1,杨光忠1
(1 中南民族大学 药学院,武汉 430074;2 中南民族大学 生物医学工程学院,武汉 430074 )
为建立HPLC测定不同产地龙血竭中3种黄酮类成分的方法,选择了广西、云南产9个批次的龙血竭,测定了其中龙血素A、龙血素B、剑叶龙血素B的含量. 采用Thermo BDS Hypersil C18色谱柱(4.6 mm×250 mm,5 μm),流动相乙腈-1%冰醋酸,梯度洗脱,流速1.0 mL·min-1,柱温40℃,检测波长278 nm.3个药效成分在45 min内达到基线分离,线性关系良好.9个批次龙血竭中龙血素A、龙血素B、剑叶龙血素B的平均含量分别为:0.47%,0.96%,0.44%;平均加样回收率分别为:99.6%,103.2%,100.5%;RSD分别为:1.20%,0.65%,1.30%.该实验方法操作简便,结果准确,重复性和稳定性良好,可为龙血竭的质量控制提供参考.
龙血竭;龙血素A;龙血素B;剑叶龙血素B ;HPLC法
龙血竭是百合科龙血树属剑叶龙血树Dracaenacochinchinensis(Lour.) S. C. Chen的含脂的木材经提取得到的树脂[1],主要产于东南亚和我国西南地区包括云南、广西等地.其富含有查尔酮、黄酮、高异黄烷和二苯乙烯类等成分[2],具有活血化瘀、止血、止痛,生肌等功效,临床上用于治疗外伤出血、疮疡不敛、跌打损伤、淤滞作痛等症[3].在对龙血竭研究的过程中,发现龙血素A,B和剑叶龙血素B的配伍组合是其产生镇痛作用药效物质[4].
为了确定其3种药效物质在龙血竭中的比例关系,使用HPLC法测定其含量.目前,采用HPLC法对龙血竭进行含量测定方法有单一化合物的含量测定[5,6],也有多个化合物的含量测定[7,8].本实验采用HPLC同时测定龙血竭中3种药效成分龙血素A、龙血素B和剑叶龙血素B的含量,对3个厂家和9个批次的龙血竭中3种药效成分进行了分析比较,为龙血竭质量控制方法提供参考依据.
1 材料
1.1 试药
龙血素A对照品(批号111660-200402)、龙血素B对照品(批号111558-201407)购于中国食品药品检定研究院,剑叶龙血素B对照品(自制,纯度≥98%).乙腈为色谱纯(Tedia company),水为超纯水,其他试剂均为分析纯.
9批龙血竭分别购自于西双版纳版纳药业有限责任公司(批号120127、111015、150702、100420)、广西中医药大学制药厂(批号20131002、20131003、20140707)和云南普洱丹州制药股份有限公司(批号20150303、20140801).
1.2 仪器
高效液相色谱仪(Ultimate 3000型, 美国戴安),粉碎机(YB-2000A型, 浙江永康市速峰工贸),电子天平(AUW120D型,岛津),超声波清洗器(KQ-500E型, 昆山市超声仪器),分光光度计(UEC1312028型, 上海美谱达仪器).
2 方法与结果
2.1 色谱条件
Thermo BDS Hypersil C18色谱柱(4.6 mm×250 mm,5 μm),流动相乙腈(A)-1%冰醋酸水溶液(B),梯度洗脱,0~10 min,20%~35%A;10~35 min,35%~36%A;35~45 min,36%~37%A;流速1.0 mL·min-1;柱温40℃;检测波长278 nm.按照上述色谱条件进行测定,3个检测指标与其他峰分离良好,分离度均大于1.5,理论塔板数均不低于1万.依据对3个对照品,在供试品溶液的色谱图中找到3个对照品相应的色谱峰(见图1).
2.2 对照品溶液的制备
分别精密称取龙血素A、龙血素B、剑叶龙血素B对照品3.71,3.05,3.86 mg,置于100 mL棕色容量瓶中,加适量无水乙醇超声使其溶解,并定容至刻度线,摇匀,即得到混合对照品溶液.
2.3 供试品溶液的制备
取龙血竭粉末(过60目筛),约0.5 g,精密称定,置于具塞锥形瓶中,精密加入70%乙醇50 mL,密封,称定质量,室温下超声(250 W,40 kHz)提取30 min,取出放冷,再称定质量,用70%乙醇补足失重,摇匀,用0.45 μm的微孔滤膜滤过,即得龙血竭供试品溶液.

1) 剑叶龙血素B;2) 龙血素A;3) 龙血素B图1 龙血竭供试品(a)和对照品(b)的HPLC色谱图Fig.1 HPLC chromatograms of Resina Draconis and reference substances
2.4 线性关系的考察
精密量取2.2项下的混合标准品溶液1,2,3,5,7,9,10 mL,分别置于10 mL棕色容量瓶中,用无水乙醇定容,摇匀,按照2.1项下的色谱条件测定,记录峰面积.以对照品进样量(ng)为横坐标,色谱峰峰面积为纵坐标,绘制标准曲线,计算标准曲线回归方程,结果见表1.

表1 对照品的线性范围、回归方程和相关系数
2.5 精密度考察
精密吸取2.3项下同一浓度的供试品溶液20 μL,按照2.1项下的色谱条件,重复进样6次,测定龙血素A、龙血素B、剑叶龙血素B的色谱峰峰面积,计算其RSD分别为0.65%, 0.27%, 0.58%,表明仪器精密度良好,结果见表2.
2.6 稳定性考察
取龙血竭供试品溶液,分别于0, 1, 2, 4, 8, 12, 24 h进样20 μL,按照2.1项下的色谱条件测定,并记录峰面积.龙血竭供试品溶液中的龙血素A、龙血素B和剑叶龙血素B峰面积的RSD分别为0.62%, 0.37%, 1.85%,表明供试品溶液在24 h内稳定,结果见表3.

表2 仪器精密度考察

表3 供试品稳定性考察
2.7 重复性考察
取同一批龙血竭样品,按照2.3项下的方法平行制备6份供试品溶液,进样20 μL,按照2.1项下的色谱条件测定龙血素A、龙血素B和剑叶龙血素B的含量,RSD分别为1.84%, 1.61%, 1.65%,表明该方法重复性良好,见表4.

表4 供试品重复性考察
2.8 加样回收率实验
分别精密称取已知含量的龙血竭样品6份,每份约12.5 mg,精密称定,置于具塞锥形瓶中.取2.2项下的混合对照品溶液15 mL于50 mL容量瓶中,并用无水乙醇定容至刻度线,取该溶液6份,每份5 mL,溶解上述6份龙血竭样品.室温下超声30 min后,放冷,再称定质量,用无水乙醇补足失重,取该液体用0.45 μm微孔滤膜过滤,进样量10 μL,记录对应各峰峰面积,计算3个药效成分的回收率,结果见表5.
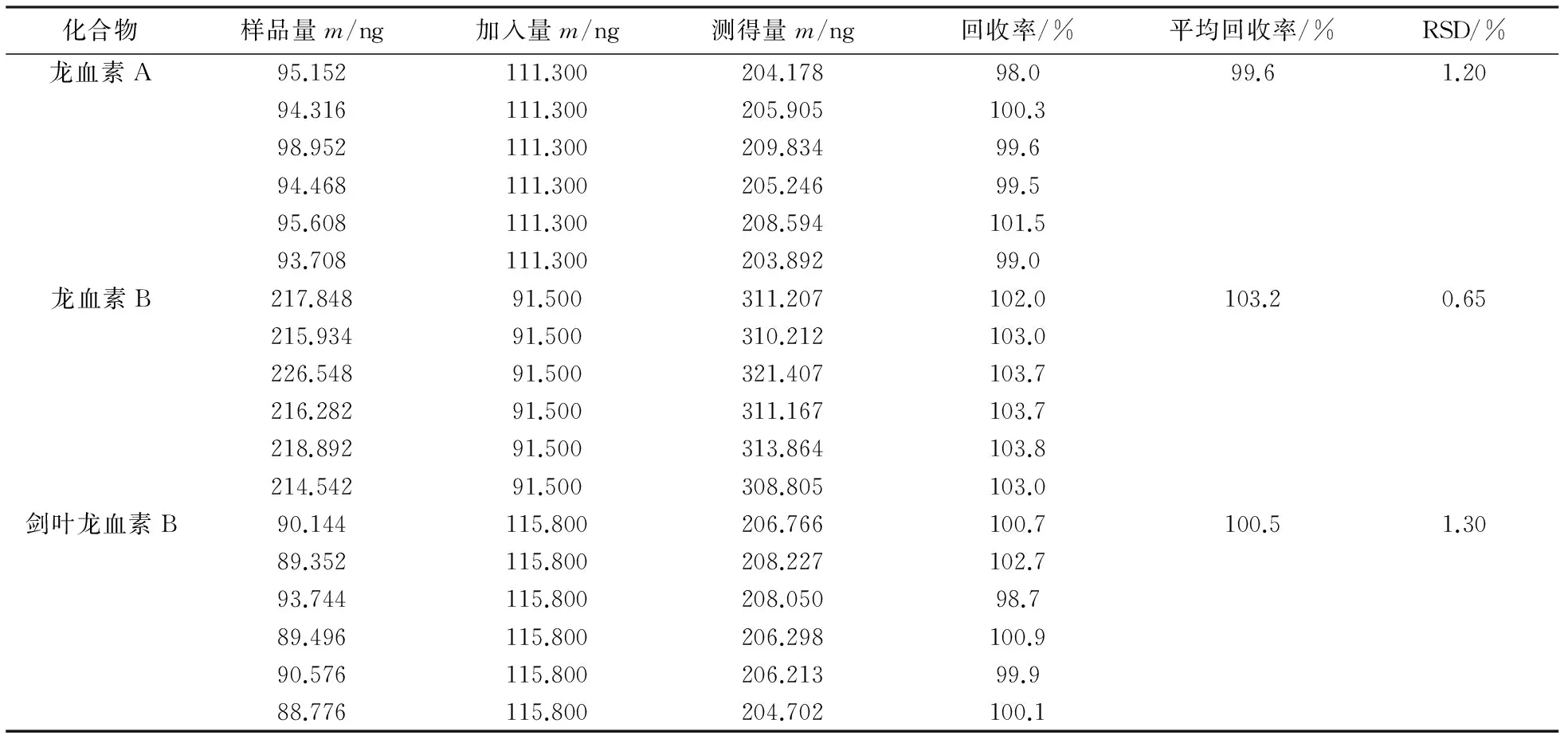
表5 龙血竭中3个药效成分的加样回收率
2.9 样品含量测定
取不同厂家和批次的龙血竭,按2.3项下的方法制备供试品溶液,并按2.1项下的色谱条件进样分析,进样量20 μL、平行测3次,龙血竭中龙血素A、龙血素B和剑叶龙血素B的含量测定结果见表6.

表6 不同厂家和批次龙血竭中3个药效成分的测定
3 讨论
本文建立了用HPLC法同时测定龙血竭中3种药效成分的含量,该方法能使3个成分获得基线分离(分离度大于1.5),具有快速、准确的特点.实验使用紫外-可见分光光度计分别对3个对照品溶液在190~700 nm进行了全波长扫描,结果显示:龙血素A、龙血素B和剑叶龙血素B的最大吸收波长分别为278,278,287 nm;龙血素A、龙血素B最大吸收波长一致,且剑叶龙血素B的最大吸收波长和278 nm相近,选择278 nm作为检测器的波长.
龙血素A、龙血素B具有较强的抗血栓、抗凝血等活血化瘀药理作用[9,10],是龙血竭中重要的药效组成成分.龙血素B有良好的镇痛效应,且龙血素A、龙血素B和剑叶龙血素B有协同效应[11,12].因此本实验选择以龙血素A、龙血素B和剑叶龙血素B为考察指标.
龙血素A、B和剑叶龙血素B的联合使用与龙血竭有相同的药效作用[13],明确这3种有效成分的含量对龙血竭质量控制十分重要.文中HPLC法测定龙血竭中3种药效成分,可为龙血竭的质量控制提供参考,保证龙血竭的临床治疗效.不同厂家和批次的龙血竭中龙血素A、B和剑叶龙血素B含量存在差异,9批龙血竭药材龙血素A、B和剑叶龙血素B的平均含量分别为0.47%,0.96%,0.44%,3种成分协同作用下治疗疼痛的比例关系,为龙血竭在药物的二次开发提供一定思路.
[1] 屠鹏飞,陶 晶,胡迎庆,等.龙血竭黄酮类成分研究[J].中国天然药物,2003,1(1):27-29.
[2] 唐人九,文东旭,韦 宏,等.广西血竭石油醚和醋酸乙酯部位中的化学成分[J].中国中药杂志,1995, 20(7):421-423,448.
[3] 王锦亮,李兴从,江东福,等.云南血竭的化学成分及抗真菌活性[J].云南植物研究,1995,17(3):336-340.
[4] Liu X M, Su C, Zhang Y, et al. Modulation of dragon′s blood on tetrodotoxin- resistant sodium currents in dorsal root ganglion neurons and identification of its material basis for efficacy[J]. Sci China Life Sci, 2006, 49(3): 274-285.
[5] 刘子修,刘 梅,刘 静,等.龙血竭胶囊中龙血素B含量的高效液相色谱法测定[J]. 海军医学杂 志,2013,34(4):249-251.
[6] 冀伟业,王东升.HPLC法测定龙血竭滴丸中龙血素B的含量[J].现代医药卫生,2010,26(7):986-988.
[7] 王佳媛,戴好富,王 辉,等.海南龙血竭HPLC分析方法及三种黄酮成分含量的测定[J].时珍国医国药,2014,12:2828-2830.
[8] 李 云,萧 伟,秦建平,等. HPLC测定龙血竭提取物中龙血素A,B和7,4′-二羟基黄酮的含量[J].中国实验方剂学杂志,2012,18(3):45-47.
[9] 杨 波,郭建恩,韩俊婷,等.龙血素A对大鼠局灶性脑缺血再灌注引起的脑损伤及机制探讨[J].中药新药与临床药理,2010,21(2):103-107.
[10] 闫 冬.龙血素B对纤溶酶原激活物抑制剂的抑制作用[J].生物化工,2016,2(2):49-50.
[11] 郭 敏,陈 素,刘向明.一种新的评估龙血竭3种化学成分相互作用特性的分析方法[J].中南民族大学学报(自然科学版),2008,27(2):56-59.
[12] Wei L S , Chen S, Huang X J , et al. Material basis for inhibition of dragon′s blood on capsaicin-induced TRPV1 receptor currents in rat dorsal root ganglion neurons[J]. Eur J Pharmacol, 2013, 702(1/3): 275-284.
[13] Chen S, Liu XM. Effect of Salvia miltiorrhiza injection on hyperpolarization-activated current channels in dorsal root ganglion neurons of rats[J]. Acta Pharmacol Sin, 2006, 41(11): 1038-1043.
Simultaneous Determination of Three kinds of Flavonoids inResinaDraconisfrom Different regions by HPLC
LiJun1,ZhuGongjun1,ChenSu2,LiuXiangming2,LiYunfang1,YangGuangzhong1
(1 College of Pharmaceutical Sciences, South-Central University for Nationalities, Wuhan 430074, China;2 College of Biomedical Engineering, South-Central University for Nationalities, Wuhan 430074,China )
To establish a method for the determination of loureirin A, loureirin B and cochinchinenin B inResinaDraconisfrom Guangxi and Yunnan Province in China, HPLC testing was performed on a Thermo BDS Hypersil C18column (4.6 mm×250 mm) with mobile phases of acetonitrile-1% acetic acid solution in a gradient mode, with a flow rate of 1.0 mL·min-1, column temperature of 40℃, and detection wavelength of 278 nm. The three components were baseline separated in 45 mins and showed good linear relationship. The average content of loureirin A, loureirin B and cochinchinenin B in the nine batches ofResinaDraconiswere 0.47%, 0.96%, 0.44%, and the average recover rates were 99.6% (RSD=1.20%), 103.2% (RSD=0.65%), 100.5% (RSD=1.30%), respectively. This method was convenient, accurate and reliable, which could provide reference for the quality control ofResinaDraconis.
ResinaDraconis; loureirin A; loureirin B; cochinchinenin B; HPLC
2016-11-02
李 竣(1975-),男,副教授,博士,研究方向:天然药物化学成分及质量标准研究,E-mail:lijun-pharm@hotmail.com
国家自然科学基金资助项目(81403186),湖北省高等学校优秀中青年科技创新团队计划资助项目(T201220),中央高校基本科研业务费专项(3212015CZW15029, 3212015YCZW15095),中南民族大学实验室开放与技改资助项目(KF2016005, JG2016004)
TQ460.7+2;R927.2
A
1672-4321(2017)02-0045-04

