金纳米粒子表面等离子共振吸收特性快速检测脱落酸
朱娟花, 王 顺, 李 伟, 常课课, 郭清乾, 孙海峰, 王满苹, 江 敏, 张 浩, 胡建东,5
(1.河南农业大学机电工程学院,河南 郑州 450002; 2.河南农业大学理学院,河南 郑州 450002;3.安阳学院,河南 安阳 455000;4.河南农业大学生命科学学院,河南 郑州 450002; 5.小麦玉米作物学国家重点实验室,河南 郑州 450002)
金纳米粒子表面等离子共振吸收特性快速检测脱落酸
朱娟花1, 王 顺1, 李 伟2, 常课课1, 郭清乾1, 孙海峰1, 王满苹3, 江 敏4, 张 浩1, 胡建东1,5
(1.河南农业大学机电工程学院,河南 郑州 450002; 2.河南农业大学理学院,河南 郑州 450002;3.安阳学院,河南 安阳 455000;4.河南农业大学生命科学学院,河南 郑州 450002; 5.小麦玉米作物学国家重点实验室,河南 郑州 450002)
提出了一种基于金纳米粒子表面等离子共振吸收特性快速检测脱落酸的新方法。采用紫外-可见分光光度计获取金纳米粒子在加入不同目标物质时的吸收光谱,并通过试验验证了该方法的可行性。在优化NaCl浓度条件下,采用5、20、 50、 100、 200 μmol·L-1脱落酸标准样品进行检测,以吸光度比值为纵坐标,浓度为横坐标,建立标准曲线。结果表明,脱落酸浓度与吸光度比值(A620/A522)具有较好的线性关系,相关系数为0.996。
金纳米粒子;表面等离子共振;植物激素;脱落酸
植物激素是由植物自身代谢产生的一类有机物质,并自产生部位移动到作用部位,在极低浓度下就有明显生理效应的微量物质,也被称为植物天然激素或植物内源激素。在细胞分裂与伸长、组织与器官分化、开花与结实、成熟与衰老、休眠与萌发以及离体组织培养等方面,分别或相互协调地调控植物的生长、发育与分化[1-2]。脱落酸 (Abscisic Acid, ABA) 是植物激素之一,能抑制植物生长、促进休眠、引起气孔关闭、调节种子胚的发育、增加抗逆性等生理作用[3-5]。因此,实现植物激素脱落酸进行高灵敏度、高特异性检测具有重要意义。目前,脱落酸的测定方法有多种,主要有酶联免疫法[6],毛细管电泳法[7],化学发光法[8],表面等离子共振法[9],高效液相色谱法[10-11]法,气相色谱-质谱联用法(GC-MS)[12]及液相色谱-质谱联用法 (HPLC-MS)[13-15]等。这些方法分析比较复杂,步骤也较为繁琐,而仪器联用设备昂贵,使用和维护成本高。
金纳米是目前研究最为广泛的纳米材料之一, 具有良好的导电性和生物相容性,并且具有独特的光学效应。当金纳米粒子粒径与入射光波长相匹配时,入射光电磁场诱导价带电子发生极化,从而产生对入射光能量的吸收,即表面等离子体共振 (SPR) 吸收,吸收峰的位置与颗粒的形态及周围环境的介电常数密切相关[16-18]。金纳米粒子具有非常高的摩尔消光系数,可实现物质的高灵敏度检测。采用柠檬酸钠还原法制备的13.5 nm球形金纳米粒子吸收峰位于520 nm附近[19]。核酸适配体是利用指数富集的配体系统进化技术体外筛选出来的与靶物质高特异性结合的单链DNA/RNA。作为一种新型分子识别元件,与传统抗体相比,核酸适配体不仅对目标物质具有高度的亲和力与特异性,而且具有靶标范围广、易合成、易修饰和稳定性好等优点[20-21]。基于金纳米粒子和核酸适配体的比色分析已成为研究的热点[22]。当核酸适配体与目标物质发生特异性结合时,核酸适配体自身的构象会随之发生变化[23-26]。
本研究根据金纳米粒子表面等离子共振吸收特性构建了一种脱落酸快速检测新方法。以筛选的脱落酸核酸适配体[27]为识别单元,当体系中不存在脱落酸时,核酸适配体缠绕在纳米金粒子表面,由于核酸链带负电荷,增加了金纳米表面的静电斥力,从而使金纳米粒子能够在较高盐浓度条件下仍然保持其良好的分散性,溶液呈红色。当体系中存在目标物质脱落酸时,脱落酸与其适配体发生特异性结合诱导适配体构象发生变化,刚性增强,从金纳米粒子表面解离下来,失去保护的金纳米粒子在盐存在条件下出现一定程度的团聚,颜色从红色变为蓝色。金纳米粒子这种表面等离子共振吸收光谱的变化可通过紫外-可见分光光度计仪进行识别,从而实现脱落酸的检测。
1 材料与方法
1.1 试剂和材料
脱落酸 (Sigma-Aldrich,USA);脱落酸适配体序列:5’-GCG GAT GAA GAC TGG TGT GAG GGG ATG GGT TAG GTG GAG GTG GTT ATT CCG GGA ATT CGC CCT AAA TAC GAG CAA C-3’,由生工生物工程(上海)股份有限公司合成;甲醇和氯化钠 (国药集团化学试剂有限公司,中国,分析纯);PBS缓冲液(pH 7.4,Solarbio);胶体金(13.5±1.0) nm,由河南农业大学机电工程学院实验室制备;整个试验过程均使用去离子水。
1.2 仪器和装置
紫外-可见分光光度计 (南京菲勒仪器有限公司);摇床;迷你金属浴;涡旋混合器;LX-手掌型离心机 (其林贝尔仪器制造有限公司,南京)。
1.3 分析方法
1.3.1 验证试验 100 μL金纳米溶胶中分别加入:(1) 60 nmol·L-1适配体+100 mmol·L-1NaCl(a);(2) 60 nmol·L-1适配体+5 μmol·L-1脱落酸+100 mmol·L-1NaCl(b);(3) 100 mmol·L-1NaCl(c)。首先金纳米溶胶加入适配体反应30 min,然后再加入脱落酸37 ℃下孵育1 h,最后再分别加入100 nmol·L-1的NaCl进行光谱扫描。
1.3.2 NaCl浓度条件的优化 100 μL金纳米溶液与60 nmol·L-1适配体反应30 min后,加入5 μmol·L-1脱落酸,37 ℃下孵育1 h,最后分别加入40、60、80、100、120 nmol·L-1的NaCl进行光谱扫描。
1.3.3 脱落酸定量检测 进行脱落酸定量检测时,将30 μL 1 μmol·L-1脱落酸核酸适体与100 μL金纳米溶胶室温下混合30 min,然后分别加入100 μL 的5、20、50、100、200 μmol·L-1脱落酸,加入170 μL的去离子水, 37 ℃下反应1 h,接着加入100 μL NaCl,最终总体积为500 μL,混匀后立即用紫外-可见分光光度计在300~800 nm范围内扫描记录表面等离子共振吸收光谱。
2 结果与分析
2.1 植物激素脱落酸的检测原理
由柠檬酸钠还原法制备得到的金纳米粒子表面结合有柠檬酸根负离子,粒子间存在静电斥力,具有较好的分散性,溶液呈红色。加入一定浓度的脱落酸适配体后,适配体N原子与Au原子通过形成Au-N配位键从而使核酸适配体吸附在金纳米表面,增加了金纳米表面的静电斥力,在较高的盐浓度下仍然分散良好,溶液呈红色。加入目标分析物脱落酸后,脱落酸与核酸适配体特异性结合,失去保护的金纳米粒子在盐存在的条件下发生团聚,溶液呈蓝色,吸收光谱发生变化,金纳米粒子的团聚程度与脱落酸浓度的高低密切相关,从而实现目标脱落酸的检测。
2.2 检测脱落酸的可行性验证
为了进一步验证该方法检测植物激素脱落酸的可行性,按照1.3.1的分析方法,加入不同物质后金纳米粒子的紫外-可见吸收光谱如图1所示。加入NaCl溶液后,金纳米粒子之间的电荷平衡被破坏,发生团聚,在700 nm附近出现一个新的吸收峰 (曲线c)。加入适配体后,受适配体保护的金纳米粒子在盐存在的条件下,仍能保持金纳米粒子原有的吸收光谱,最大吸收峰在522 nm(曲线a)。加入目标分析物后,适配体与脱落酸发生特异性结合,从金纳米粒子表面解离下来,失去保护的金纳米粒子在盐条件下发生团聚,吸收光谱在550~650 nm范围内发生变化。本试验在该波长范围内选取620 nm作为新的特征吸收波长,采用A620/A522比值的大小来评价金纳米团聚程度,A620/A522比值越大,团聚程度越高,目标物浓度越大,从而实现脱落酸的检测。
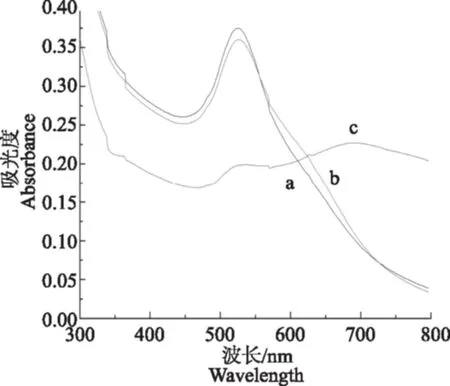
图1 金纳米粒子加入不同物质的紫外-可见吸收光谱Fig.1 UV-Vis absorption spectra of AuNP solutions after addition of different materials
2.3 NaCl浓度条件的优化
金纳米粒子凝聚程度与盐浓度密切相关,按照1.3.2的分析方法,随着NaCl浓度的增加,金纳米粒子颜色从红色变为蓝色。根据加入脱落酸前后吸收光谱比值的变化Δ(A620/A522)判断最佳的NaCl浓度,如图2所示。从图2可以看出,随着NaCl浓度的增加,Δ(A620/A522)逐渐增大,这是因为随着NaCl浓度的增大,金纳米团聚程度增大,当NaCl浓度增大为100 mmol·L-1时,Δ(A620/A522)达到最大。而当NaCl浓度增大到120 mmol·L-1时,Δ(A620/A522)略有降低,这可能是因为当NaCl浓度大于100 mmol·L-1,金纳米粒子发生了过聚集状态。因此,最佳NaCl浓度为100 mmol·L-1。
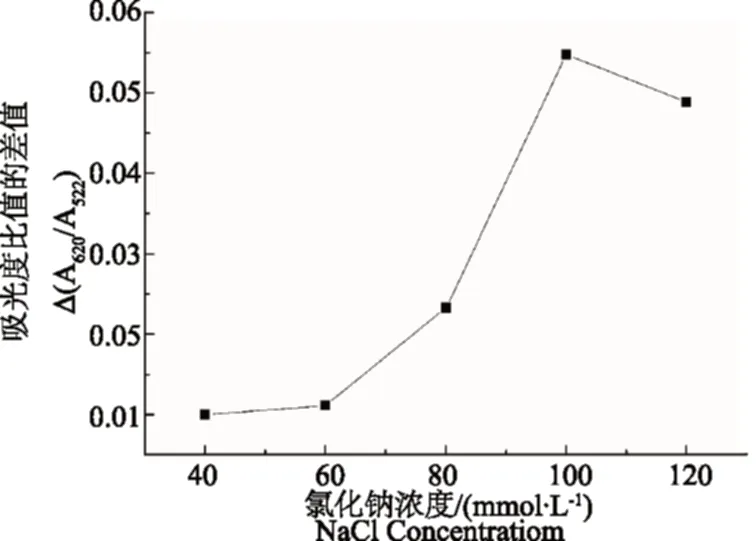
图2 NaCl浓度对金纳米离子吸收光谱比值变化的影响Fig.2 Effect of NaCl concentration on Δ(A620/A522)
2.4 脱落酸的定量检测
在上述优化NaCl浓度条件下采用该方法定量检测植物激素脱落酸,将不同浓度的脱落酸与一定量的金纳米-适配体混合,37 ℃孵育1 h,然后加入100 μL 500 mmol·L-1NaCl,用振荡器混合均匀,按照1.3.3分析方法,然后转入微量比色皿中,进行紫外-可见吸收光谱测试,结果如图3所示。随着脱落酸浓度的增大,620 nm处吸光度逐渐增大。用A620/A522比值定量反应脱落酸浓度,如图4所示。其中横坐标为脱落酸浓度,纵坐标为A620/A522比值。从图4可以看出,当脱落酸浓度在5~200 μ mol·L-1范围时,浓度与A620/A522比值呈线性相关,线性方程为A620/A522=0.378 1+0.001 2C,线性系数为0.996,具有较好的线性关系。

图3 不同浓度脱落酸的紫外-可见吸收光谱图
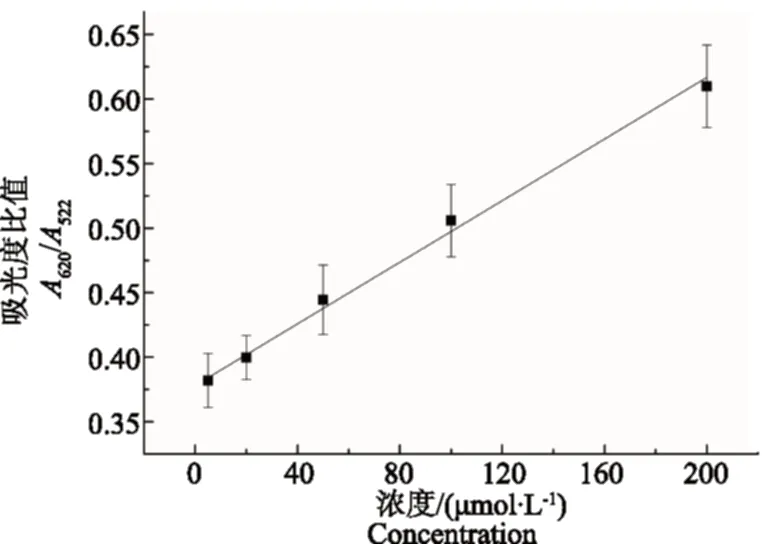
图4 脱落酸浓度与A620/A522比值之间的关系Fig.4 Calibration curve of the adsorption ratio (A620/A522) versus the concentration of ABA
3 结论
本研究采用自动扫描紫外-可见分光光度计获取金纳米粒子在加入不同目标分析物脱落酸后金纳米粒子表面等离子共振吸收光谱特性,建立了快速检测植物激素脱落酸方法。通过试验分析了金纳米粒子凝聚程度与NaCl浓度的关系,建立了2个特征波长下吸光度比值A620/A522与检测目标物脱落酸浓度曲线。结果表明,目标物脱落酸存在与否吸收光谱具有显著差异,在优化NaCl浓度条件下,脱落酸浓度在5~200 μmol·L-1范围时,吸光度比值(A620/A522)与样品浓度具有较好的线性关系,其相关系数为0.996。基于金纳米粒子表面等离子共振吸收光谱特性为植物激素脱落酸快速定量检测提供了一条有效的途径。
[1] COLEBROOK E H, THOMAS S G, PHILLIPS A L, et al. The role of Gibberellin signaling in plant responses to abiotic stress [J]. The Journal of Experimental Biology, 2014, 217: 67-75.
[2] TANK J G, PANDYA R V, THAKER V S. Phytohormones in regulation of the cell division and endoreduplication process in the plant cell cycle [J]. RSC Advances, 2014, 34: 12605-12613.
[3] 郭文雅, 赵京献, 郭伟珍. 脱落酸 (ABA ) 生物学作用研究进展 [J]. 中国农学通报, 2014, 30(21): 205-210.
[4] 郝格格, 孙忠富, 张录强, 等. 脱落酸在植物逆境胁迫研究中的进展 [J]. 中国农学通报, 2009, 25(18): 212-215.
[5] 丁君辉, 李耀国, 童建华. 脱落酸对水稻种子萌发的影响[J]. 作物研究, 2012, 26(4): 328-330.
[6] 周振华, 楚霞, 沈国励, 等. 间接竞争ELISA 方法用于脱落酸的检测 [J]. 化学传感器, 2009, 29(3): 29-33.
[7] LIU X, MA L, LIN Y W, et al. Determination of abscisic acid by capillary electrophoresis with laser-induced fluorescence detection[J]. Journal of Chromatography A, 2003, 121: 209-213.
[8] 张蕾, 关洪亮, 何治柯. 基于量子点的脱落酸检测方法研究 [J]. 中国科学:化学, 2010, 40(1): 70-75.
[9] 穆琳瑛, 王满苹, 王顺, 等. 光学表面等离子共振生物传感器检测脱落酸的试验研究 [J]. 河南农业大学学报, 2010, 48(1): 75-79.
[10]范光宇, 刘颖慧, 赵治海, 等. 高效液相色谱法测定谷子叶尖组织中4种植物激素 [J]. 河北农业大学学报, 2015, 38(1): 25-28.
[11]BOSCO R, CASER M, VANARA F, et al. Development of a rapid LC-DAD/FLD method for the simultaneous determination of auxins and abscisic acid in plant extracts [J]. Journal of Agricultural and Food Chemistry, 2013, 61(46): 10940-10947.
[12]MÜLLER A, DÜCHTING P, WEILER E W. A multiplex GC-MS/MS technique for the sensitive and quantitative single-run analysis of acidic phytohormones and related compounds and its application toArabidopsisthaliana[J]. 2002, Planta, 216: 44-56.
[13]夏群, 辛培勇, 褚金芳. 全自动在线固相萃取-液相色谱-串联质谱法同时检测水稻中6 种内源性植物激素 [J]. 分析化学, 2016, 44(3): 409-415.
[14]师君丽, 孔光辉, 逄涛, 等. 超高效液相色谱-电喷雾串联四级杆质谱法快速测定烟草中8种植物生长调节剂残留 [J]. 分析科学学报, 2016, 32(4): 510-514.
[15]LU Q M, ZHANG W M, GAO J, et al. Simultaneous determination of plant hormones in peach based on dispersive liquid-liquid micro-extraction coupled with liquid chromatography-ion trap mass spectrometry [J]. Journal of Chromatography B, 2015, 192: 8-13.
[16]ALHASAN A A, DALY S A, HENDAWY M M, et al. Rapid Induced Aggregation of gold nanoparticles by diolefinic dyes [J]. Journal of Nanomaterials and Molecular Nanotechnology, 2014, 3(2): 136-142.
[17]KHLEBTSOV N G, TRACHUK L A, MELNIKOV A G. The effect of the size, shape, and structure of metal nanoparticles on the dependence of their optical properties on the refractive index of a disperse medium [J]. Optics and Spectroscopy, 2005, 98: 77-83.
[18]LINK S, SAYED M A. Size and temperature dependence of the plasmon absorption of colloidal gold nanonanoparticles [J]. Journal of Chromatography B, 1999, 103:4212-4217.
[19]STORHOFF J J, ELGHANIAN R, MUCIC R C, et al. One-pot colorimetric differentiation of polynucleotides with single base imperfections using gold nanoparticle probes [J]. Journal of the American Chemistry Society, 1998, 120:1959-1964.
[20]TUERK C, GOLD L. Systematic evolution of ligands by exponential enrichment: RNA ligands to bacteriophage T4 DNA polymerase [J]. Science, 1990, 249: 505-510.
[21]TOMBELLI S, MINUNNI M, MASCINI M. Analytical applications of aptamers[J]. Biosensors and Bioelectronics, 2005, 20: 2424-2434.
[22]ROUSHANI M, SHAHDOST F. A highly selective and sensitive cocaine aptasensor based on covalent attachment of the aptamer-functionalized AuNPs onto nanocomposite as the support platform [J]. Analytica Chimica Acta, 2015, 853: 214-221.
[23]GOPINATH S B, LAKSHMIPRIYA T, AWAZU K. Colorimetric detection of controlled assembly and disassembly of aptamers on unmodified gold nanoparticles [J]. Biosensors and Bioelectronics, 2014, 51: 115-123.
[24]GUIEU V, RAVELET C, PERRIER S, et al. Aptamer enzymatic cleavage protection assay for the gold nanoparticle-based colorimetric sensing of small molecules [J]. Analytica Chimica Acta, 2011, 706(2): 349-353.
[25]WANG Y, YANG F, YANG X R. Colorimetric biosensing of mercury (II) ion using unmodified gold nanoparticle probes and thrombin-binding aptamer [J]. Biosensors and Bioelectronics, 2010, 25 (8): 1994-1998.
[26]ZHENG Y, WANG Y, YANG X R. Aptamer-based colorimetric biosensing of dopamine using unmodified gold nanoparticles[J]. Sensors and Actuators B: Chemical, 2011, 156: 95-99.
[27]GROZIO A L, GONZALEZ V M, MILLO E, et al. Selection and characterization of single stranded DNA aptamers for the hormone abscisic acid [J]. Nucleic Acid Therapeutics, 2013, 23: 222-331.
(责任编辑:蒋国良)
Rapid detection of abscisic acid based on the surface plasmon resonance absorption properties of gold nanoparticles
ZHU Juanhua1, WANG Shun1, LI Wei2, CHANG Keke1, GUO Qingqian1, SUN Haifeng1, WANG Manping3, JIANG Min4, ZHANG Hao1, HU Jiandong1,5
(1.College of Mechanical and Electrical Engineering, Henan Agricultural University, Zhengzhou 450002, China; 2.School of Science, Henan Agricultural University, Zhengzhou 450002, China; 3.Anyang University, Anyang 455000, China; 4.College of Life Sciences, Henan Agricultural University, Zhengzhou 450002, China; 5.State Key Laboratory of Wheat and Maize Crop Science, Zhengzhou 450002, China)
In this paper, a novel rapid method of detecting abscisic acid was demonstrated based on the surface plasmon resonance absorption properties of gold nanoparticles. The absorption spectra of AuNPs was recorded by an ultraviolet-visible spectrophotometer, and its feasibility was verified by experiments. Under the optimized NaCl condition, the standard concentration of 5, 20, 50, 100, 200 μmol·L-1were detected, respectively. There was a good linear relationship between the concentrations of ABA and the ration of absorbance (A620/A522) with the correlation coefficient R of 0.996.
gold nanoparticles; surface plasmon resonance; plant hormones; abscisic acid
2016-08-12
国家自然科学基金项目 (U1304305, 31671581);小麦玉米作物学重点实验室项目(SKL2014ZH-06, 39990026)
朱娟花(1975-),女,河南郏县人,副教授,硕士,从事测试技术与信号处理方面的研究。
胡建东(1965-),男,江西新余人,教授,博士,博士研究生导师。
1000-2340(2017)01-0066-05
S24
A

