基于预期用途的移动健康产品监管分类要求
李澍,王浩,罗维娜,王晨希,任海萍
中国食品药品检定研究院 医疗器械检定所,北京 100050
基于预期用途的移动健康产品监管分类要求
李澍,王浩,罗维娜,王晨希,任海萍
中国食品药品检定研究院 医疗器械检定所,北京 100050
移动健康产品的预期用途界定是一个关于产业监管的关键问题,因为产品的预期用途决定了相应食品药品监管部门是否对其行使监管权力。一般来说,食品药品监管部门监管职能的第一步是判断该产品是否属于医疗器械,即产品的预期用途是否属于诊断、预防、监护、治疗疾病。许多移动健康产品目前是为了解决一般的健康和保健问题,然而保健、医学诊断或治疗的分界线却不明确。本文介绍了国内外的一些初步的监管思路,随着该领域产业的蓬勃发展和新的业态出现,思路必将会逐步明晰。
移动健康产品;移动医疗器械;用途界定;预期用途;医学诊断
引言
保障公共健康水平的不断提高是监管部门和移动医疗器械产品开发和制造商们共同承担的责任。近几年,移动健康产业发展迅速,主要得益于互联网的发展,高速数据传输、无线通讯技术以及各种软件和硬件设施的应用,很多社交工具(例如微信、脸书)打破了传统通信方式的桎梏,使得个体消费者几乎在任何地方都可以保持“在线”[1]。移动健康产品同样为医生和患者提供了便利,让他们在传统医疗设施之外能够自由地传送和接收医疗服务。随着中国逐步进入老龄化设备、医疗消费压力增加和日益增长的慢性病患者比例,以及对移动设备的熟悉程度的提高,移动健康产品可能会成为中国乃至世界医疗系统中至关重要的组成部分[2]。移动健康产品的范围非常广泛,有些具有医疗用途,有些仅具有一般健身用途。到底是否需要监管,是根据预期用途来确定的。对于需要特殊监管的产品到底如何进行监管,以保证新技术、新产品的安全性和有效性是各国食品药品监管部门也一直在不断研究优化的问题[3]。
针对移动健康产品,欧盟、日本、加拿大等国及国际医疗器械监管者论坛均无特殊有针对性的法规和标准要求。只有美国FDA发布的少数几个指导原则Mobile Medical Applications[4](2015年9月9日)、General Wellness:Policy for Low Risk Devices[5](2016年7月28日)、Radio Frequency Wireless Technology in Medical Devices[6]对个人移动健康监护系统软件技术和部分硬件技术给出指导意见。但还远远不够,仍有诸多监管问题需要讨论并制定相应规范。概括来说,全世界医疗器械监管部门还主要依靠现有的医疗设备监管框架来约束移动健康产品和移动医疗器械。然而现存的框架可能在某些方面并不适应移动类产品的发展。因此,需要针对移动健康产品的特殊性,进行具体的分析。
1 移动健康产品预期用途的界定及挑战
虽然医疗器械的定义,不同国家之间有所不同,但都是依据预期用途而定。任何关于医疗器械法规对于产品适用性的决定,都应该基于其预期目的和使用方式。基于产品的预期用途,满足医疗器械法律定义的产品须受相关监管部门的监管。我国根据产品的风险等级将医疗器械分为一类、二类或三类。一类风险最低,三类风险等级最高。三类设备需受到最高水平的审查,需要最大量的安全性和有效性的证据,以获得市场的认可。
以上规则和框架对于移动健康产品和移动医疗器械同样适用,如果该产品是用于“为医疗或者诊断目的提供信息”,则属于医疗器械;但如果仅用于“帮助用户进行健康管理”,则属于移动健康产品。然而,在对移动健康产品和移动医疗器械的预期用途进行确认时,由于健康和医疗用途之间的模糊区域使得二者预期用途确认面临着巨大的挑战[7]。
评估移动医疗器械预期用途的挑战主要源于很多产品用途的方式都与健康深深交织着,有时较难进行区分产品在什么时候停止服务于健康功能,并开始服务于医疗目的。美国移动健康管理联盟曾给出的一个典型的由于预期用途变化导致FDA监管水平变化的例子(图1)[8]。普通的体重秤如果仅用于跟踪减肥的情况,是不涉及疾病或病症的,应属于常规的移动健康产品,不需受监管部门的监管;如果是用于医生实时管理体重-测量与充血性心力衰竭时,就属于移动医疗器械,就要受监管部门的监管。但在这二者之间还有用于营养师管理肥胖,用于医生监护减肥手术的恢复,用于医生管理糖尿病患者的用途,就出现了介于非监管和监管的模糊地带。显然,预期用途的不同,就会导致产品监管方式的不同,造成监管和未管制产品之间的模糊地带的产生。但确定的是,在某个位置,体重秤就从不受管制到由监管部门监管。幸运的是,在这一区段,各国监管部门均允许企业具有一定程度的自由裁量权,在促进技术发展的同时保障了产品安全有效[9-10]。下面,具体针对一般健康产品(包括自由裁量权产品)和移动医疗器械的监管思路进行具体的介绍。
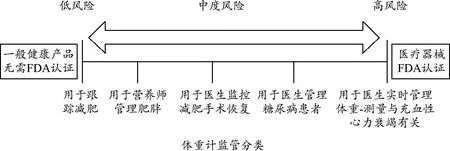
图1 预期用途的变化,导致监管风险的变化
2 针对一般健康产品(包括自由裁量权产品)的监管分类要求
通常情况下,当一个产品的预期仅用于一般健康用途,并对于用户安全的风险非常低,此类产品属于低风险一般健康产品范畴。低风险一般健康产品需要同时满足以下几个条件:首先,无创,也就是说它不刺入或穿透皮肤和粘膜;其次,即便未按预期使用也不会对用户安全产生风险;再次,未引发新的监管问题及生物相容性的问题。一个产品是否属于低风险一般健康产品,除了要满足上述要求外,监管部分还需要参考同类医疗器械的监管要求来进行判断。一般健康产品的判断流程,见图2。
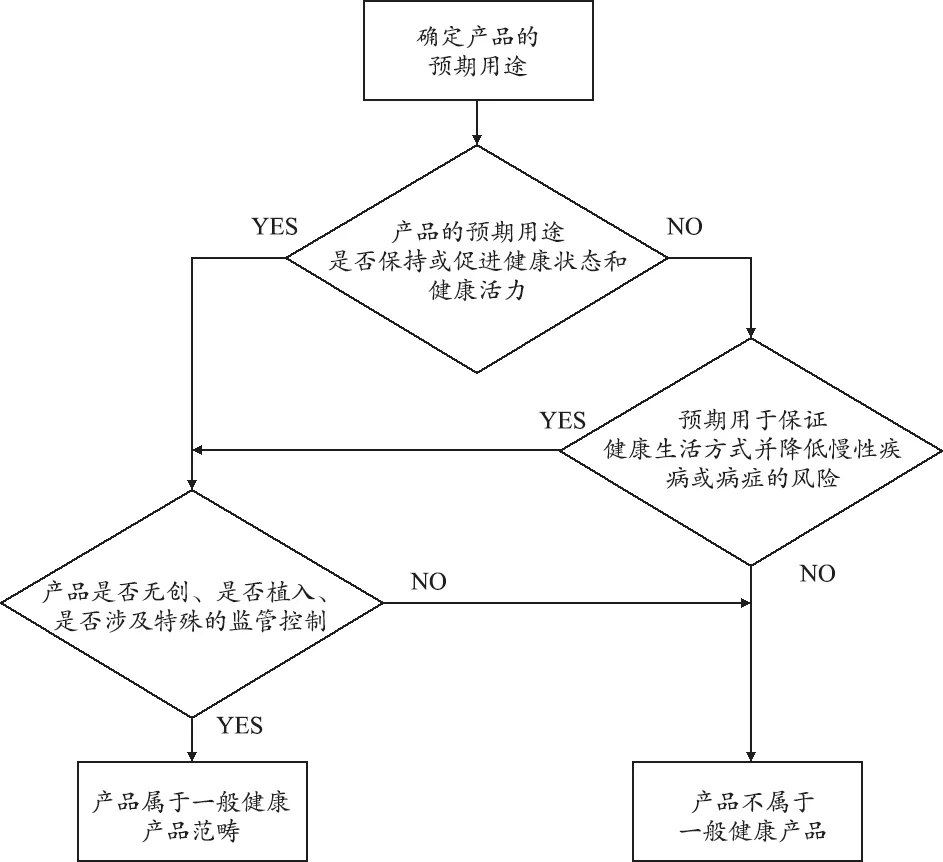
图2 一般健康产品的判断流程
美国FDA在于2016年7月28日发布的《一般健康产品:低风险医疗器械监管政策指南》中明确表示FDA不强制要求对低风险的一般健康产品进行监管,同时允许企业根据产品的实际情况进行自我定义,FDA亦不会强制要求这类产品满足上市前及上市后的法规要求。国内同样可以采取以上监管策略,在保证安全有效的同时促进产业和技术的发展。
低风险一般健康产品一般分为两类,第一类产品预期用途为保持或促进健康状态和健康活力,不涉及疾病或病症。例如:仅用于体重管理、锻炼健身、放松与压力管理、精神敏锐度提高、自尊心提升、睡眠管理和性功能改善的产品。从该类产品的预期用途可以看出,此部分产品和医疗目的无关,不必按照医疗器械进行监督管理。
第二类产品所宣称的预期用途为保证健康的生活方式并降低慢性疾病或病症的风险,举例来说:包括:① 预期用于促进、追踪和帮助选择健康的生活方式,从而降低某些慢性疾病或症状的风险;② 预期用于促进、追踪和选择健康的生活方式,从而提高某些慢性疾病或症状患者的生活质量。例如:用于心脏病、高血压、II型糖尿病等慢性疾病或病症的日常管理产品[12]。从该类产品的预期用途可以看出,该类产品的预期用途大部分和医疗相关,属于介于一般健康产品和医疗器械的中间地带。对于以上产品,为了促进技术革新,在保证产品安全有效的前提下,同样可以适当放宽监管要求,促进产业深度发展。
3 针对移动医疗器械的监管分类要求
对于不属于低风险一般健康产品的范畴,而是符合医疗器械定义的移动医疗器械产品,则需要按照现有的医疗器械监管体系进行监管。需要根据产品的预期用途、结构特点、风险等级及使用环境等来划分医疗器械分类和等级;并根据申报产品形式,来确定相应的监管范围,包括以零附件形式注册、以整机形式注册、以硬件和软件组合形式注册等。
同时在近2年,我国国家食品药品监督管理总局也陆续发布了一些移动医疗器械分类界定的文件,如对于糖尿病管理应用程序,通过蓝牙连接特定的血糖仪,将血糖值从血糖仪传输到移动设备,同时,具有药物计算(用药剂量指导)功能被定为三类管理等。建议在参考以上分类文件的同时,按照下述步骤进行分类:
首先,可以参考《医疗器械分类目录》进行分类。在目录中会有各类医疗器械产品通用名称、品名举例和管理类别建议等内容可以作为分类的参考。
其次,对于依据分类目录仍然不能明确其分类的产品,就要根据医疗器械分类判定表(表1)(《医疗器械分类规则》的附件)进行分类判定。
对于上述方法仍不能判断监管分类的移动医疗期器械,可以登录中国食品药品检定研究院网站(http://www.nifdc. org.cn)的二级站点医疗器械标准管理研究所页面,注册并登陆“医疗器械分类界定信息系统”,按照相关要求提交分类界定所需材料。医疗器械标准管理研究所会不定期组织专家讨论会,对企业所提交分类材料进行集中讨论确定分类意见后报国家食药监总局批准后回复企业分类意见。
4 小结
总体看来,产品的预期用途在区分移动健康产品和移动医疗器械起到非常重要的作用,它直接决定了产品的监管方式,然而,在对产品预期用途进行确认时,由于健康和医疗用途之间的模糊区域使得预期用途的确认和监管分类面临着巨大的挑战。目前,美国也仅仅有一些初步的监管思路,我国也还没有明确的规定。随着该领域产业的蓬勃发展和新的业态出现,思路必将会逐步明晰。

表1 医疗器械分类判定表
[1] Colin K.移动医疗:医疗实践的变革和机遇[M].北京:科学出版社,2014.
[2] 宗文红.国外移动医疗监管对我国的启示[J].中国卫生信息管理杂志,2015,4(12):340-345.
[3] 王姝淼,郑秋莹.手机健康软件Apps的监管问题研究[J].管理观察,2013, (22):81-83.
[4] Mobile Medical Applications - Guidance for Industry and Food and Drug Administration Staff[R].https://www.fda.gov/ MedicalDevices/DigitalHealth/MobileMedicalApplications/ default.htm,2015.
[5] General Wellness:Policy for Low Risk Devices Guidance for Industry and Food and Drug Administration Staff[R].https:// www.fda.gov/ucm/groups/fdagov-public/@fdagov-meddevgen/documents/document/ucm429674.pdf,2016.
[6] Radio Frequency Wireless Technology in Medical Devices-Guidance for Industry and Food and Drug Administration Staff[R].https://www.fda.gov/Medical Devices/Device Regulation and Guidance/Guidance Documents/ucm077210.htm,2013.
[7] 滕晓菲,张元亭.移动医疗:穿戴式医疗仪器的发展趋势[J].中国医疗器械杂志,2006,30(5):330-340.
[8] ANON.Talking Data:2015年移动医疗行业数据报告,中文互联网数据研究资讯中心[R].http://www.199it.com/archives/352577. html,2015.
[9] 刘丽杭,陈小玲,阳历.移动医疗服务发展的现状、问题及对策[J].中国全科医学,2011,14(28):3302-3304.
[10] 王兰永.互联网医疗探索与思考[J].信息与电脑:理论版,2014, (8):75-76.
[11] 王新蕾,杨丽,刘乃丰.物联网建设下的移动医疗[J].中国医药导报,2012,9(29):149-151.
[12] 严春美,吕晓荣,许云红.移动医疗服务技术研究进展与发展前景[J].传感器与微系统,2013,32(2):1-3.
[13] 王美山,闵连星.移动医疗应用市场的发展现状与对策研究[J].财讯,2016,(8):117-118.
[14] 张燕艳.移动医疗发展中的主体行为及其影响研究[D].杭州:杭州电子科技大学,2016.
[15] 刘锦泰.移动医疗服务的应用现状、问题及对策[J].中外女性健康研究,2016,(7):50-51.
[16] 沈鹏悦,耿蕊,寿文静,等.中医移动医疗发展现状及存在的问题[J].智慧健康,2016,2(10):29-33.
本文编辑 苏欣
Regulatory Requirements for Mobile Health Products Based on Intending Use
LI Shu, WANG Hao, LUO Wei-na, WANG Chen-xi, REN Hai-ping
Institute for Medical Devices Control, National Institutes for Food and Drug Control, Beijing 100050, China
The intending use of mobile health products is a key issue in the regulation of the medical device industry, since the intending use of the mobile health product determines whether the food and drug regulatory authorities take regulatory actions. In general, the first step for the food and drug regulatory authority is to understand whether the product belongs to the medical device, that is, whether the intending use of the product belongs to the diagnosis, prevention, monitoring and treatment of disease. Many mobile health products are currently designed to address general health and healthcare issues, but the boundaries of healthcare, medical diagnosis or treatment are not clear. This article described some of the early stage regulatory ideas at home and abroad. With the rapid development of the industry and the emergence of new formats, the regulatory policy will gradually develop.
mobile health products; mobile medical devices; define of use; intended use; medical diagnosis
TP274
A
10.3969/j.issn.1674-1633.2017.06.002
1674-1633(2017)06-0006-03
2017-03-29
国家重点研发计划(2016YFC0103202);国家体育总局科研课题(2015B100)。
任海萍,中国食品药品检定研究院光机电医疗器械检验室主任,主要研究方向为有源医疗器械、医用软件的检测及质量控制。
通讯作者邮箱:renhaiping@nifdc.org.cn

