金丝桃苷对小鼠T淋巴细胞亚群及血清细胞因子的影响
白 军,李博文,刘淑红
(1.杨凌职业技术学院,陕西杨凌 712100;2.上海海利生物技术股份有限公司,上海 201403;3.杨凌金海生物技术有限公司,陕西杨凌 712100)
金丝桃苷对小鼠T淋巴细胞亚群及血清细胞因子的影响
白 军1,李博文2,刘淑红3
(1.杨凌职业技术学院,陕西杨凌 712100;2.上海海利生物技术股份有限公司,上海 201403;3.杨凌金海生物技术有限公司,陕西杨凌 712100)
观察金丝桃苷对小鼠免疫系统的作用,将Balb/c小鼠随机分成5组,空白对照组(在第1、3、5天腹腔注射生理盐水)、免疫抑制组(在第1、3、5天腹腔注射环磷酰胺)、给药组(在第1、3、5天腹腔注射环磷酰胺,第1~7天每天以150/300 mg/kg金丝桃苷水溶液灌胃)和阳性对照组(在第1、3、5天腹腔注射环磷酰胺,第1~7天每天以0.2 mg/kg黄芪多糖水溶液灌胃)。用ELISA法测定小鼠T淋巴细胞亚群CD3、CD4、CD8以及细胞因子IL-4、IL-6、IL-10、IFN-γ、TNF-α的水平。结果表明,与空白对照组相比,免疫抑制组的CD3、CD4、CD8水平以及血清细胞因子IFN-γ、TNF-α水平显著降低(P<0.05),IL-4、IL-6及IL-10水平显著升高(P<0.05)。给予金丝桃苷后第8天,与免疫抑制组相比,CD3、CD4、CD8水平以及血清细胞因子IFN-γ、TNF-α水平极显著升高(P<0.01),IL-4、IL-6、IL-10水平极显著降低(P<0.01)。金丝桃苷能通过提高免疫抑制小鼠T淋巴细胞亚群的CD3、CD4、CD8水平以及细胞因子IFN-γ及TNF-α水平,降低IL-4、IL-6、IL-10水平,来拮抗环磷酰胺所致的免疫机能抑制,提高机体免疫功能。
金丝桃苷;免疫抑制;T淋巴细胞亚群;血清细胞因子
金丝桃苷(hyperoside)又名槲皮素-3-O-β-D-吡喃半乳糖苷,是一种黄酮醇苷类化合物,广泛存在于多种植物体内,如蔷薇科、金丝桃科、桔梗科、唇形科等植物的果实与全草中。该化合物具有多种功能,不仅可以保护神经系统、心血管系统和消化系统,还具有解痉镇痛及降血脂作用[1-3]。
目前,对金丝桃苷的报道仅限于提取、分离及药理活性等方面,关于其对免疫系统的作用报道很少。
本试验将金丝桃苷给予免疫力低下的小鼠,通过测定小鼠体内血清中的CD3、CD4、CD8、IL-4、IL-6、IL-10、IFN-γ及TNF-α水平,来探讨金丝桃苷对免疫抑制小鼠T淋巴细胞亚群及血清细胞因子的影响。结果发现,金丝桃苷能通过提高免疫抑制小鼠血清中的CD3、CD4、CD8、IFN-γ、TNF-α水平,降低IL-4、IL-6、IL-10水平,来拮抗环磷酰胺所致的免疫机能抑制,改善机体免疫功能。本研究将有助于在分子水平阐明免疫调节的机理,具有重要的理论和实用意义。
1 材料与方法
1.1 材料
1.1.1 实验动物 Balb/c小鼠,8周龄,体重18 g~22 g,雌雄各半,购自常州卡文斯实验动物有限公司。
1.1.2 药物 金丝桃苷提取于贯叶连翘,纯度约为95.5%;环磷酰胺购自上海华联制药有限公司;黄芪多糖购自成都市腾飞动物药业有限公司,临用前将金丝桃苷和黄芪多糖溶解于灭菌水,配制成相应浓度的溶液。
1.1.3 试剂 小鼠CD3、CD4、CD8、IL-4、IL-6、IL-10、IFN-γ、TNF-α ELISA试剂盒,均购自金百生物股份有限公司。
1.2 方法
1.2.1 动物分组及模型制备 将Balb/c小鼠随机分成5组,每组12只。Ⅰ组为空白对照组,在第1、3、5天腹腔注射1 mL生理盐水。Ⅱ组为免疫抑制(模型)组,在第1、3、5天腹腔注射1 mL环磷酰胺。Ⅲ组为低剂量药物组,在第1、3、5天腹腔注射1 mL环磷酰胺,第1~7天每天以150 mg/kg金丝桃苷水溶液灌胃。Ⅳ组为高剂量药物组,在第1、3、5天腹腔注射1 mL的环磷酰胺,第1~7天每天以300 mg/kg金丝桃苷水溶液灌胃。Ⅴ组为阳性对照组,在第1、3、5天腹腔注射1 mL的环磷酰胺,再于第1天~第7天每天以0.2 mg/kg黄芪多糖水溶液灌胃。给药后第8天对所有小鼠进行眼静脉采血,分离血清后置-20℃冰箱保存待用。
1.2.2 ELISA检测 血清中的T淋巴细胞亚群CD3、CD4、CD8以及细胞因子IL-4、IL-6、IL-10、IFN-γ、TNF-α的测定严格按照试剂盒说明书的操作步骤进行。
1.2.3 数据的统计学处理 数据采用SAS9.0软件进行分析,结果以平均值±标准差表示,采用新复极差检验法进行多重比较,以P<0.05为差异显著性,P<0.01为差异极显著性为判断标准。
2 结果
2.1 金丝桃苷对免疫抑制小鼠T淋巴细胞亚群的影响
小鼠注射环磷酰胺后,免疫抑制模型组T淋巴细胞亚群CD3、CD4、CD8水平及CD4/CD8值与空白对照组相比较,显著降低(P<0.05),说明免疫抑制小鼠造模成功。给予免疫抑制小鼠高低剂量金丝桃苷治疗后,小鼠血清中CD3、CD4、CD8水平及CD4/CD8值较免疫抑制模型组均有极显著升高(P<0.01),表明小鼠免疫功能得以提高,表明在对T淋巴细胞亚群的影响方面,金丝桃苷的治疗效果优于黄芪多糖(表1)。
2.2 金丝桃苷对免疫抑制小鼠血清细胞因子的影响
小鼠注射环磷酰胺后,与空白对照组相比较,免疫抑制模型组小鼠血清中IL-4、IL-6、IL-10水平显著升高(P<0.05),IFN-γ和TNF-α水平显著降低(P<0.05),说明免疫抑制小鼠造模成功。给予免疫抑制小鼠高低两个剂量金丝桃苷治疗后,小鼠血清中IL-4、IL-6和IL-10水平较免疫抑制模型组均有极显著降低(P<0.01),三者水平甚至比空白对照组还低。相比之下,高低剂量的金丝桃苷治疗后小鼠血清中IFN-γ和TNF-α水平较免疫抑制模型组均有极显著升高(P<0.01)。同样地,金丝桃苷对FN-γ和TNF-α水平的提高均也存在剂量依赖关系(表2)。
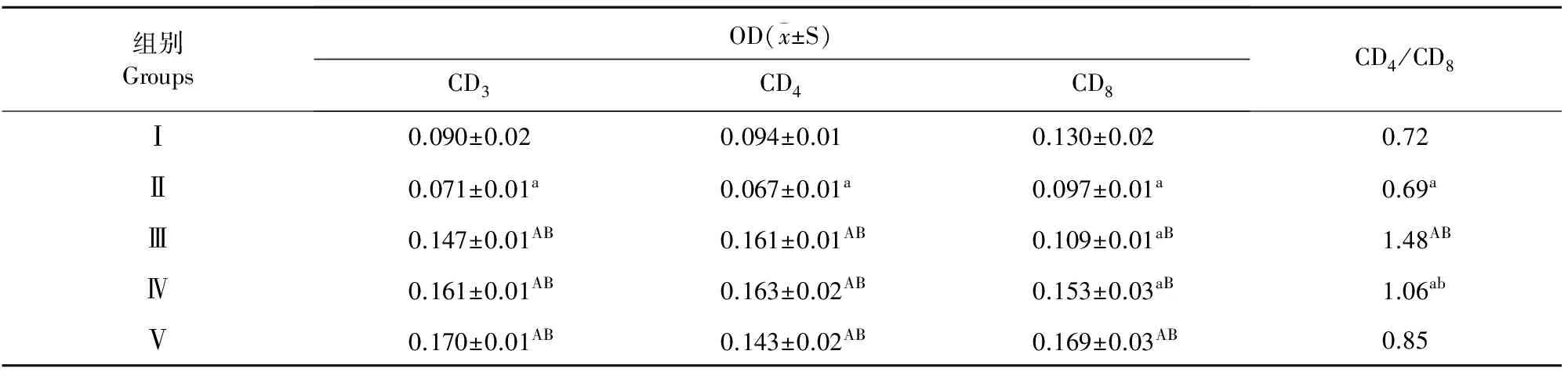
表1 小鼠血清CD3、CD4、CD8测定结果(n=12)
注:a表示与空白对照组有显著差异(P<0.05),A表示与空白对照组有极显著差异(P<0.01);b表示与免疫抑制组有显著差异(P<0.05),B表示与免疫抑制组有极显著差异(P<0.01)。
Note:a stands for significant difference with normal control at 0.05 level,A stands for significant difference with normal control at 0.01 level; b stands for significant difference with normal control at 0.05 level,B stands for significant difference with normal control at 0.01 level.
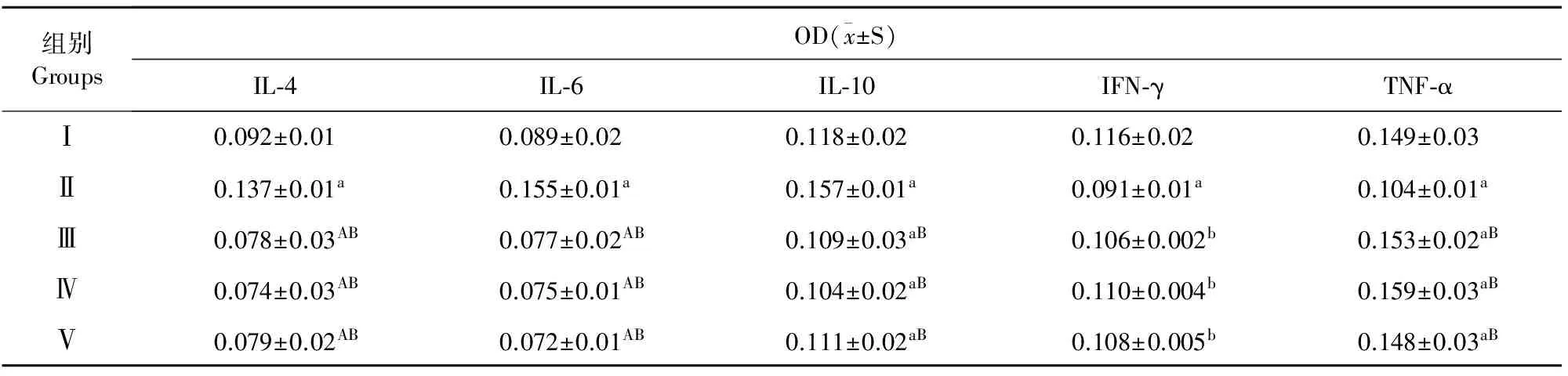
表2 小鼠血清IL-4、 IL-6、 IL-10、IFN-γ及TNF-α的测定结果(n=12)
注:a表示与空白对照组有显著差异(P<0.05),A表示与空白对照组有极显著差异(P<0.01);b表示与免疫抑制组有显著差异(P<0.05),B表示与免疫抑制组有极显著差异(P<0.01)。
Note:a stands for significant difference with normal control at 0.05 level,A stands for significant difference with normal control at 0.01 level; b stands for significant difference with normal control at 0.05 level,B stands for significant difference with normal control at 0.01 level.
3 讨论
3.1 金丝桃苷对免疫抑制小鼠T淋巴细胞亚群CD3、CD4及CD8的影响
小鼠注射环磷酰胺后,血清中CD3、CD4、CD8的水平显著降低。给予金丝桃苷进行治疗后,免疫抑制小鼠血清中CD3、CD4、CD8水平极显著升高。CD3是T细胞表面的表面标志[4],CD3水平升高意味着成熟T细胞数量在增加。CD4是辅助T淋巴细胞(Th)和效应T淋巴细胞的表面标志,Th通过释放各种细胞因子来辅助B淋巴细胞和效应T淋巴细胞活化,上调机体的免疫功能[5],CD4水平升高也预示着机体免疫功能的增强。CD8是细胞毒性T细胞(Tc)和抑制性T细胞(Ts)的表面标志。Ts是通过释放抑制因子来抑制B淋巴细胞和效应T淋巴细胞活化,来下调机体的免疫功能[6]。理论上,CD8水平应该降低,但在本研究中CD8水平反而升高,与理论有矛盾之处,其原因亟待进一步研究。CD4与CD8二者相互制约,相互诱导,形成机体的T细胞网络[7],二者的比值反应了机体免疫水平的高低,也是机体疾病严重程度及愈后状况的重要指标之一[8]。若二者比值降低说明机体处于免疫紊乱状态;相反,若二者比值升高,说明机体免疫功能增强。在本研究中,小鼠处于免疫功能低下时(免疫抑制),CD4/CD8二者的比值降低,给予金丝桃苷治疗后,CD4/CD8二者的比值升高,表明机体从免疫损伤中恢复,免疫功能增强,这与理论相符。
3.2 金丝桃苷对免疫抑制小鼠IL-4、IL-6及IL-10的影响
小鼠注射环磷酰胺后,血清中IL-4、IL-6、IL-10水平显著升高。给予金丝桃苷进行治疗后,IL-4、IL-6、IL-10水平极显著降低。IL-4,IL-6,IL-10均由Th2细胞分泌,主要介导机体的体液免疫反应[9]。IL-4主要作用是增加机体体液免疫应答,抑制Th1细胞介导的免疫应答。本研究中,经金丝桃苷治疗后,IL-4水平显著降低,可能是由于机体内的Th1应答强于Th2应答,导致Th2应答被抑制,从而使其分泌IL-4的能力降低。IL-6是细胞因子网络中的一种关键成分,在炎症性疾病中大多都会增高[10]。本研究中,环磷酰胺的注射导致小鼠机体内的IL-6水平显著升高,表明机体处于免疫抑制状态,经金丝桃苷治疗后,IL-6水平之所以显著降低,也可能是由于Th2应答受到抑制,分泌IL-6的量减少所致。IL-10是公认的炎症与免疫抑制因子。本研究中,环磷酰胺的注射导致小鼠机体内的IL-10水平显著升高,发挥其负性调节作用,使得机体免疫功能下降。经金丝桃苷治疗后,免疫抑制小鼠体内的IL-10水平显著降低,这可能与IL-4、IL-6水平降低的原因相同,都是由于抑制了Th2应答。上述研究结果与理论一致,Th1细胞和Th2细胞存在交互负反馈调节,当机体Th2应答被抑制时,产生的IL-4、IL-6及IL-10的量减少。
3.3 金丝桃苷对免疫抑制小鼠IFN-γ及TNF-α的影响
小鼠注射环磷酰胺后,血清中IFN-γ和TNF-α水平显著降低。给予金丝桃苷进行治疗后, IFN-γ和TNF-α水平极显著升高。IFN-γ被称为Ⅱ型干扰素,能通过抑制T细胞及B细胞的功能起到免疫调节作用。肿瘤坏死因子(TNF)是由抗原激活巨噬细胞产生,能激活诱导T、B细胞分化。TNF-α是一种自分泌型的激活因子,也是IL-1、IL-8、GM-CSF等细胞因子旁分泌的诱导因子。本研究中,给小鼠注射环磷酰胺后,小鼠机体内的TNF-α水平显著降低,当给予金丝桃苷药物治疗后,TNF-α水平显著升高,提示,金丝桃苷能够通过提高免疫抑制小鼠机体的TNF-α水平来提高机体免疫功能。
[1] 宋必卫,陈志武,马传庚,等.金丝桃苷对中枢神经系的一般药理作用[J].安徽医科大学学报,1995,30(4):253-255.
[2] 王启海,陈志武.金丝桃苷对离体大鼠腹主动脉的舒张作用及其机制研究[J].中草药,2010,41(5):766-770.
[3] 周长征.黄酮类化合物的降血脂作用研究进展[J].北方药学,2012,9(4):100-101.
[4] 吕昌龙,李殿俊,李 一.医学免疫学[M].北京:高等教育出版社,2012.
[5] 钱江潮.传染性单核细胞增多症患儿淋巴细胞亚群的变化[J].温州医学院学报,2002,33(6):405-406.
[6] 王明圣,李 立,罗 燕.传染性单核细胞增多症患儿T细胞亚群变化及临床意义[J].中华妇幼临床医学杂志(电子版).2006,2(1):38-39.
[7] 曹晓军,倪惠萍.传染性单核细胞增多症患儿T细胞亚群变化及临床意义[J].江苏大学学报,2007,17(5):429-431.
[8] 叶中绿,庞伟君,黄秀兰.EB病毒感染患儿细胞因子水平与T细胞亚群检测的临床意义[J].现代预防医学,2008,35(12):2306-2308.
[9] Mosmann T R,Coffman R L.Heterogeneity of cytokine secretion patterns and functions of helper T cells[J].Adv Immunol,2009,46:111-181.
[10] 李 萍,曹建平,赵丽娟.类风湿关节炎患者血清TNF,IL-6水平及意义[J].上海免疫学杂志,2008,18(6):368-371.
Effects of Hyperoside on T Cell Subset and Serum Cytokines in Mice
BAI Jun1,LI Bo-wen2,LIU Shu-hong3
(1.YanglingVocationalandTechnicalCollege,Yangling,Shaanxi,712100,China; 2.ShanghaiHileBio-technologyCo,Ltd.,Shanghai,201403,China; 3.YanglingJinhaiBio-technologyCo,Ltd.,Yangling,Shaanxi,712100,China)
To investigate the effects of hyperoside on the immune system of mice,the Balb/c mice were randomly divided into 5 groups:blank control group (intraperitoneal injection of saline on days 1,3 and 5),immunosuppressed group (intraperitoneal injection of cyclophosphamide on days 1,3 and 5),drug group (intraperitoneal injection of cyclophosphamide on days 1,3 and 5; gavage administration of 150/300 mg/kg hyperoside on days 1-7),positive control group (intraperitoneal injection of cyclophosphamide on days 1,3 and 5,gavage administration of 0.2 mg/kg astragalus polysaccharide on days 1-7).Then the levels of T cell subset (CD3,CD4,CD8) and five serum cytokines (IL-4,IL-6,IL-10,IFN-γ,TNF-α) were measured by ELISA.The expressions of CD3,CD4,CD8,IFN-γ,and TNF-α decreased significantly and the levels of IL-4,IL-6 and IL-10 increased significantly compared with blank control group.After treatment with hyperoside,the levels of CD3,CD4,CD8,IFN-γ and TNF-α increased very significantly,while the levels of IL-4,IL-6,and IL-10 reduced very significantly compared with the immunosuppressed group.Hyperoside can improve the immune function by increasing the levels of CD3,CD4,CD8,IFN-γ and TNF-α,and decreasing the levels of IL-4,IL-6 and IL-10 in immunosuppressed mice.
hyperoside; immunosuppression; T cell subset; serum cytokine
2016-11-03
白 军(1981-),男,河南驻马店人,讲师,硕士研究生,主要从事养猪及猪病防治教学及科研工作。
S852.4
A
1007-5038(2017)06-0048-04

