黄秋葵种质资源及相关品种选育研究进展
张少平,邱珊莲,张 帅,郑云云,吴松海,何炎森,郑开斌
(福建省农业科学院亚热带农业研究所,福建漳州363005)
黄秋葵种质资源及相关品种选育研究进展
张少平,邱珊莲,张 帅,郑云云,吴松海,何炎森,郑开斌
(福建省农业科学院亚热带农业研究所,福建漳州363005)
简述黄秋葵及其近缘种相关资源分布及收集保存利用现状;总结黄秋葵资源相关RAPD、SRAP、ISSR及SSR等遗传多样性分子评价;归纳黄秋葵育种相关研究,介绍非洲西部及中国广泛种植的黄秋葵新品种及其来源;提出今后应加大具有特色性状黄秋葵及其近缘种资源收集、人工驯化栽培及提纯等工作,开展黄秋葵多倍体及辐射诱变等育种,争取获得一批雄性不育系材料,更好地为黄秋葵杂交育种服务。
黄秋葵;种质资源;遗传育种
0 引言
黄秋葵(Abelmoschus esculentu)作为一种特色蔬菜,目前已广泛栽培于世界各地[1-2],在美国被称为植物伟哥,日韩称之为绿色人参,印度称之为神奇乡土蔬菜,中国俗称有秋葵、黄葵、补肾菜、洋辣椒、羊角椒、羊角豆、咖啡黄葵等[3-4],属一年生(热带地区为多年生)日中性自花授粉植物[5-6]。黄秋葵一般按植株高矮可分为高(2 m及以上)、中(1.5 m左右)及矮(1 m及以下)3种株型;依果实横断面分为五角、八角及圆果等类型;按嫩果色泽可分为乳黄色、绿色及紫色等品种;依果实长短分为长果及短果2种形状。黄秋葵是食、药、饲用及工业加工等兼用型植物[7-8],食用型黄秋葵果荚润滑柔嫩,可清炒、煮食、凉拌、做汤、制罐及速冻加工等。黄秋葵嫩果富含蛋白质、纤维素、不饱和脂肪酸以及铁、钙、锰、钾、锌等矿物质,具有很高的食用价值[9-10],此外还富含可溶性多糖、生物碱及黄酮等多种生物活性成分[11-12],有助消化、抗癌、抗肿瘤、治糖尿病、消炎、健胃、保肝及增强人体耐力等药用保健功效[13-14]。
黄秋葵作为一种世界性蔬菜,广泛种植于非洲、欧美及东南亚等地,中国种植黄秋葵历史虽然悠久,但长期以来一直作为一种稀有特色蔬菜小范围零星种植。近年来,随着黄秋葵所含特殊成分及其营养保健功效的发掘,黄秋葵得以大面积推广种植,相关优良品种也引起了广泛关注。笔者将从黄秋葵资源收集、保存利用以及相关品种选育、利用等相关研究展开论述。
1 黄秋葵及其近缘种资源
1.1 秋葵属相关资源介绍
黄秋葵为锦葵科(Malvaceae)秋葵属(Abelmoschus)植物,该属植物除世界范围广泛栽培的普通黄秋葵(Abelmoschus esculentus)外,还有少量人工种植作为蔬菜食用的黄秋葵近缘种西非秋葵(Abelmoschus caillei),作为药用植物种植的黄蜀葵(Abelmoschus manihot)以及少量种植以种子榨油的为目的的黄葵(Abelmoschus moschatus),而在全世界分布的该属9个种[15]中,其他5种秋葵属植物皆为野生种(详细归纳见表1)。据《中国植物志》,结合相关报道(详细总结见表2),中国黄秋葵近缘种秋葵属植物有7种(其中黄蜀葵又分为黄蜀葵原变种及刚毛黄蜀葵),除普通黄秋葵广泛分布及种植于全国各地外,其他6种黄秋葵近缘种大多野生分布于中国特定地区,可作为中药利用。
因此,世界范围内秋葵属植物种类较少,可供人类利用的资源更是不多,除普通黄秋葵逐渐被人们认识外,其他资源大多不被广大民众所熟知。而中国地域辽阔,所分布秋葵属植物相对丰富,已遍布世界范围内9种秋葵属资源中的7种,因此,中国从事黄秋葵及其近缘种相关植物研究具有资源优势。
1.2 黄秋葵资源收集保存现状
拥有丰富的黄秋葵资源是筛选出良好品种的重要基础,同时也是进行有性杂交品种选育的基本保证,在黄秋葵资源收集保存及利用方面,国际生物多样性中心(The Bioversity International)联合法国发展研究中心(The Institut de Recherche pour le Développement,IRD)于1982—1986年进行了部分西非国家黄秋葵种质资源的收集利用,并在法国蒙彼利埃市发展研究中心成立了黄秋葵资源核心库。在此基础上,美国国家种质资源系统[National Plant Germplasm System(NPGS), United States]成立并保存了来自于包括亚洲和非洲等地的黄秋葵相关资源3000多份。如今,总部设在台南的亚蔬世界中心(The World Vegetable Center,简称AVRDC)及其合作机构继续进行了世界各地相关黄秋葵资源收集利用工作,仅2008—2009年期间,就收集了来自包括马里、几内亚、塞内加尔及尼日尔等地黄秋葵新资源102份。2013年以来,福建省农业科学院亚热带农业研究所在福建省科技重大专项等项目的资助下,广泛开展了黄秋葵相关资源的收集利用等工作,目前该研究所已收集保存了国内外黄秋葵种质资源300多份,同时,进行了黄秋葵相关资源的鉴定、提纯及育种等相关研究。
由此可知,亚洲、非洲、欧洲及南北美洲等地都广泛开展了黄秋葵种质资源的收集工作。通过大量收集及保存不同种黄秋葵资源,再进行田间种植观察,一方面可从中筛选出新的优良品种。同时,通过对黄秋葵资源收集、种植调查、提纯复壮及杂交育种等工作,可获得黄秋葵优良的杂交新品种,从而更好地服务于商品化生产。
1.3 黄秋葵资源相关分子评价
随着分子生物学技术的发展,许多分子标记技术已被越来越普遍地应用于不同植物资源的鉴别及指纹图谱的构建[16-18]。然而,由于黄秋葵细胞内含有丰富的果胶类多糖等次生物质,降低了从中提取总DNA的产量和质量[19-20],但黄秋葵DNA提取技术的改进,推进了利用分子生物学技术进行黄秋葵种质资源及其亲缘关系的鉴定。关于所用非特异引物进行黄秋葵分子标记鉴定方面:Aladele等[21]利用RAPD技术进行来自于亚洲及西非的93份黄秋葵资源聚类分析,Gulsen等[22]利用SRAP技术进行来自于土耳其不同黄秋葵资源鉴定,张绪元等[23]及Yuan等[24]分别利用ISSR分子标记进行国内外部分黄秋葵资源评价;在SSR分子标记进行黄秋葵资源相关研究方面:Sawadogo等[25]利用SSR分子标记,共设计18对引物进行来自布基纳法索的20种黄秋葵分子鉴定,结果发现其中2种黄秋葵基因与其他18种差异明显。Schafleitner等[26]通过高通量测序技术进行黄秋葵相关转录组基因测序,所得153 414Unigene中共检测到935个SSR位点,该研究从中合成199对SSR随机引物中有161对引物能扩增出多态性条带,该研究从中筛选出19对引物进行65种黄秋葵亲缘关系鉴定,结果表明,65种黄秋葵中的其中7种与其他资源为同种,而不同的58种黄秋葵资源分为3类。

表1 世界范围内9个种秋葵属植物

表2 中国7种黄秋葵近缘种秋葵属植物
黄秋葵种质资源极为丰富,一些不同种黄秋葵资源可通过其外部特征如颜色、果形、植株高矮等进行辨别,但也存在一些外观相似且不容易直接通过肉眼观察出的不同种黄秋葵。以上所用不同分子标记进行不同来源地黄秋葵资源鉴定,其结果皆表明不同来源地黄秋葵资源差异明显且总体可分为2~3个种群。今后进一步利用分子标记进行黄秋葵资源相关研究不仅可有效区分不同种黄秋葵资源,同时还可以有目的地为进行适当亲缘关系种黄秋葵有性杂交育种提供理论依据。
2 黄秋葵育种相关研究
2.1 资源稳定性相关研究
为了解不同黄秋葵资源在不同环境条件下长势情况,Ariyo等[27]对来自于尼日利亚不同地区30份黄秋葵资源种植于不同环境,后以14种不同表型特征进行多元分析,聚类结果统计表明,黄秋葵资源在不同地区种植由于受环境影响,其产量相关的一些重要特征表现不稳定;Alake等[28]收集非洲西部不同地区的25份黄秋葵资源,分别栽种于5种不同环境,进行其品种间适用性、稳定性和丰产性的基因型和环境互作的AMMI模型分析,发现不同黄秋葵对环境适应能力表现不同。
比较不同环境下黄秋葵长势情况可知,许多黄秋葵由于环境差异导致其种质资源发生变异,从而极大地丰富及多样化了黄秋葵种质资源,同时,由于黄秋葵稳定性及适用性不同,根据不同地域条件,有选择性地选育或引种适合当地栽培的黄秋葵新品种显得极为重要。而部分黄秋葵资源对环境变化不明显,此类稳定性较好的黄秋葵资源作为新品种或作为育种中间材料都具有较好的推广价值。
2.2 特征差异与产量
为获得高产优良黄秋葵新品种,许多学者开展了黄秋葵不同外部特征比较分析研究。Oppong等[29]对25份来自于加纳的黄秋葵种质资源外型特征进行分析,结果表明,黄秋葵产量与其单株叶片数、分枝数、株高、开花天数、果荚数量、单果重、种子千粒重等均呈显著正相关。洪建基等[30]以60份黄秋葵资源为材料,对其31个生物学特性进行了遗传多样性分析,结果表明,丰富的黄秋葵资源的植物学和生物学特征间存在明显相关性。Oppong等[31]及曾日秋等[32]进行了不同来源地黄秋葵资源的质量及数量性状的聚类分析,发现这些遗传性极为丰富的资源,可很好地作为黄秋葵育种改良材料。Nandan等[33]进行了42份黄秋葵组合后的杂种优势与基因互作相关研究,获得4个具有明显杂种优势的杂交新组合,该组合开花期、单果重及种子千粒重等均表现为特殊配合力较一般配合力显著,且非加性效应明显,而其单株产量的一般配合力更具优势且加性效应明显。Wammanda等[34]进行双列杂交研究黄秋葵产量与其构成因素遗传变化规律,通过配合力及杂种优势分析再次表明黄秋葵杂种优势明显。
黄秋葵种质资源丰富,遗传变异差异明显,其作为自交作物,产量及产量组成性状的杂种优势明显。同时,黄秋葵产量与其植物学和生物学特征间存在明显正相关,因此为了有效鉴定和评价丰富的黄秋葵种质资源,更好地服务于黄秋葵杂交新品种选育,根据黄秋葵外型特征即可初步判断其相关产量。
2.3 新品种相关介绍
目前黄秋葵主要种植地区有非洲、亚洲的印度、斯里兰卡、菲律宾,以及美国和巴西等地[35]。由于气候优势,非洲地区的尼日利亚、科特迪瓦、加纳等国一直为世界上黄秋葵重要生产地,然而其育种相对落后。多年来,因为美国及印度等国家育种工作的进展,许多黄秋葵杂交新品种相继被推出。一些优良新品种被引进到部分中西非国家,由于良好的综合表现,一直被广泛大量种植(详细总结见表3)。中国种植黄秋葵历史悠久,其中栽培历史久远的地方有江西萍乡,福建省建宁、泰宁及将乐等地[36-38],然而起初只有少量栽培。近年来,随着人们消费水平提高及保健意识的增强,黄秋葵作为一种特色保健蔬菜已越来越受人们青睐。目前,台湾、福建、广东、海南、北京、浙江及江西等省市都有大面积种植,国内黄秋葵商品化生产取得了较大进步,然而在新品种选育等方面与国外还存在较大差距,因此,国内大面积种植的黄秋葵一般为进口种(相关总结见表4),只有少量品种为国内筛选及选育(详见表5)。
综上可知,美国、印度等地所选育的黄秋葵优良新品种在满足当地生产的同时,也进一步促进了非洲地区黄秋葵产业的发展。而国内黄秋葵产业化种植起步较晚,新品种筛选及选育等研究落后,但发展势头较好,因此,在国内从事黄秋葵产业化种植及相关育种研究前景广阔。
3 中国黄秋葵种质资源相关研究展望
3.1 进一步加大黄秋葵相关资源收集
黄秋葵已广泛分布于世界各地,其资源长期在不同环境条件下的自然及人工选择,已形成了种类丰富、遗传多样的种质资源[39]。美国、法国以及日本等国相关机构早已广泛开展了全世界不同地区黄秋葵种质资源的收集保存等工作,然而国内目前还未有类似机构[40]。

表3 中西非国家广泛种植的部分黄秋葵品种

表4 中国引种植的部分黄秋葵品种
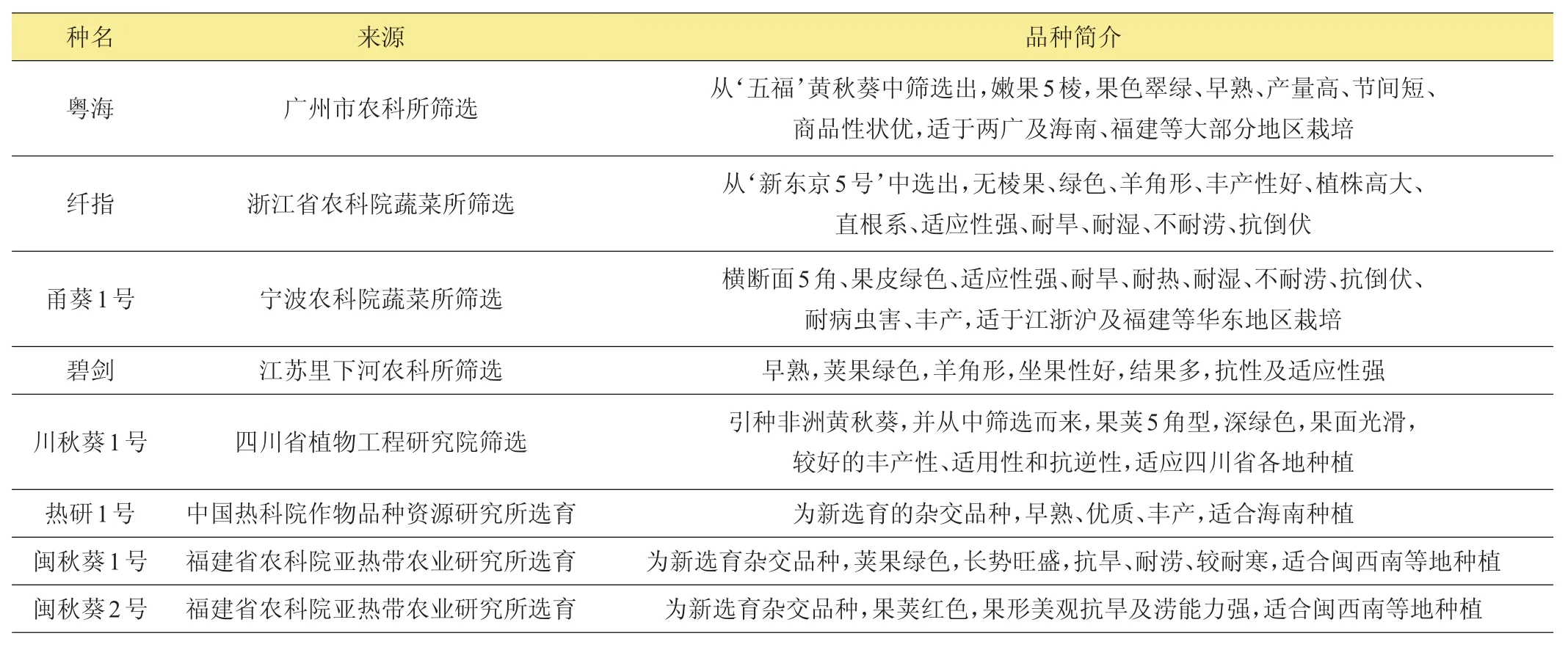
表5 中国筛选的部分黄秋葵品种
深入开展世界范围内黄秋葵种质资源的收集、保存等相关工作,同时有选择地进行黄秋葵近缘种中一些独具特色性状资源的收集,如抗寒种A.angulosus、抗黄脉花叶病毒种A.tetraphyllus及A.manihot等[41-43],富含某些特殊成分种A.moschatus[44]以及炒食不含粘胶质种A.caillei[45]等相关近缘种资源收集、人工驯化栽培及提纯育种等工作,为黄秋葵种质创新及相关育种利用提供丰富的材料。然而,在进行国外黄秋葵相关种质资源收集过程中,需要加强黄秋葵相关病虫害检验检疫等工作,避免引进一些感染特殊病虫害相关资源[46-48],从源头上保证引种材料的质量。
3.2 加大黄秋葵育种相关研究
黄秋葵已成为一种重要的特色蔬菜,许多国家都加大了黄秋葵育种相关研究工作,且推出了许多优良的新品种。而国内黄秋葵及其近缘种等相关资源丰富,黄秋葵种植也具有一定规模,但商品化种植的一些优良品种几乎都是从台湾或国外引进,这极不利于黄秋葵产业的发展。
因此,在进行黄秋葵种质资源实生选种及杂交育种的同时,需大力发展黄秋葵多倍体育种以及辐射诱变等育种,争取获得一批优良的中间材料(如雄性不育系等),从而更好地为黄秋葵杂交育种服务。同时,开展黄秋葵抗病虫害转基因相关研究[49],以获得一批口感好、营养丰富、抗逆性强、产量高的黄秋葵新品种,对促进国内黄秋葵产业的可持续发展具有非常重要的现实意义。
[1]Sanjeet K,Sokona D,Adamou H,et al.Okra(Abelmoschusspp.)in West and Central Africa:Potential and progress on its improvement [J].African Journal ofAgricultural Research,2010,5(25):3590-3598.
[2]Chandra S,Saha R,Pal P.Arsenic Uptake and Accumulation in Okra(Abelmoschus esculentus)as Affected by Different Arsenical Speciation[J].Bull Environ Contam Toxicol,2016,96(3):395-400.
[3]Gemede H F,Haki G D,Beyene F,et al.Proximate,mineral,and antinutrient compositions of indigenous Okra (Abelmoschus esculentus)pod accessions:implications for mineral bioavailability [J].Food Sci Nutr,2015,4(2):223-233.
[4]王萍,肖文君,胡帅,等.黄秋葵不同品系和不同组织部位的果胶和咖啡因含量比较研究[J].激光生物学报,2015,24(2):175-179.
[5]Olayiwola M O,Ariyo O J.Relative Discriminatory Ability of GGE Biplot and YSi in the Analysis of Genotype×Environment Interaction in Okra (Abelmoschusesculentus)[J].International Journal of Plant Breeding and Genetics,2013,12(7):146-158.
[6]Osekita O S,Ariyo O J,Kehinde O B.Variation and inter-character association in the segregating F3populations arising from two crosses of okra(Abelmoschus esculentus(L.)moench)[J].Moor J Agric Res,2000,1(1):32-36.
[7]Oyelade O J,Ade-Omowaye B I O,Adeomi V F.Influence of variety on protein,fat contents and some physical characteristics of okra seeds[J].J Food Eng,2003,57(2):111-114.
[8]Fan S,Zhang Y,Sun Q,et al.Extract of okra lowers blood glucose and serum lipids in high-fat diet-induced obese C57BL/6 mice[J].J Nutr Biochem,2014,25(7):702-709.
[9]Chao P Y,Lin S Y,Lin K H,et al.Antioxidant activity in extracts of 27 indigenous Taiwanese vegetables[J].Nutrients,2014,6(5):2115-2130.
[10]Hacibekiroglu I,Kolak U.Aflatoxins in various food from Istanbul, Turkey[J].FoodAddit Contam Part B Surveill,2013,6(4):260-264.
[11]Li Y X,Yang Z H,Lin Y,et al.Antifatigue Effects of EthanolExtracts and Polysaccharides Isolated fromAbelmoschus esculentus[J].Pharmacogn Mag,2016,12(47):219-224.
[12]Chen H,Jiao H,Cheng Y,etal.InVitroand In Vivo Immunomodulatory Activity of Okra(Abelmoschus esculentusL.) Polysaccharides[J].J Med Food,2016,19(3):253-265.
[13]Mishra N,Kumar D,Rizvi S I.Protective Effect ofAbelmoschus esculentusAgainst Alloxan-induced Diabetes in Wistar Strain Rats [J].J Diet Suppl,2016,13(6):634-646.
[14]Tian Z H,Miao F T,Zhang X,et al.Therapeutic effect of okra extract on gestational diabetes mellitus rats induced by streptozotocin[J].Asian Pac J Trop Med,2015,8(12):1038-1042.
[15]Kaledzi P D,Adi E B,Peprah S,et al.Genetic diversity,correlation and path analyses ofokra (Abelmoschusspp.(L.)Moench) germplasm collected in Ghana[J].International Journal of Development and Sustainability,2014,2(2):1396-1415.
[16]Hulya.RAPD markers assisted varietal identification and genetic purity test in pepper Capsicum annuum[J].Scientia Horticulture, 2003,97(8):211-218.
[17]Caikwad A B,Behera T K,Singh A K,et al.Amplified fragment length polymorphism analysis provides strategies for improvement of bitter gourd(Momordica charantiaL.)[J].HortScience,2008,43 (1):127-133.
[18]康乐,王海洋.我国生物技术育种现状与发展趋势[J].中国农业科技导报,2014,16(1):16-22.
[19]Manoj-Kumar A,Reddy K N,Manjulatha M,et al.Polysaccharidefree nucleic acids and proteins ofAbelmoschus esculentusfor versatile molecular studies[J].Mol Biol(Mosk),2012,46(4):598-604.
[20]黄捷,陈晓斌,叶花兰,等.黄秋葵基因组DNA提取及鉴定[J].中国农学通报,2008,24(4):99-103.
[21]Aladele S E,Ariyo O J,Lapena R.Genetic relationships among West African okra(Abelmoschus caillei)and Asian genotypes (Abelmoschus esculentus)using RAPD[J].Afr J Biotech,2008,14(7): 1426-1431.
[22]Gulsen O,Karagul S,Abak K.Diversity and relationships among Turkish okragermplasm by SRAP and phenotypicmarker polymorphism[J].Biologia Bratislava,2007,62(1):41-45.
[23]张绪元,黄捷,刘国道.43份黄秋葵种质的ISSR分析[J].热带作物学报,2009,30(3):293-298.
[24]Yuan C Y,Zhang C,Wang P,et al.Genetic diversity analysis of okra(Abelmoschus esculentusL.)by inter-simple sequence repeat (ISSR)markers[J].Genet Mol Res,2014,13(2):3165-3175.
[25]Sawadogo M,Ouedraogo J T,Balma D,et al.The use of cross species SSR primers to study genetic diversity of okra from Burkina Faso[J].Afr J Biotech,2009,11(8):2476-2482.
[26]Schafleitner R,Kumar S,Lin C Y,et al.The okra(Abelmoschus esculentus)transcriptome as a source for gene sequence information and molecular markers for diversity analysis[J].Gene,2013,517(1): 27-36.
[27]Ariyo O J.Variation and heritability of fifteen characters on okra (AbelmoschusEsculentus(L.)Moench)[J].Trop Agric,1990,67(3): 213-216.
[28]Alake C O,Ariyo O J.Comparative Analysis of Genotype X EnvironmentInteraction Techniques in WestAfrican Okra (Belmoschus caillei,A.Chev Stevels)[J].Journal of Agricultural Science,2012,4(4):9752-9760.
[29]Oppong S D,Akromah R,Nyamah E Y,et al.Evaluation of some okra belmoschus germplasm in Ghana[J].African Journal of Ptant Science,2012,6(5):166-178.
[30]洪建基,曾日秋,姚运法,等.黄秋葵种质资源遗传多样性及相关性分析[J].中国农学通报,2015,31(28):79-84.
[31]Oppong S D,Akromah R,Nyamah E Y,et al.Characterization of okra(Belmoschus spp.L.)germplasm based on morphologica1 characters in Ghana[J].Journal of Plant Breeding and Crop Science, 2011,13(3):367-378.
[32]曾日秋,洪建基,姚运法,等.黄秋葵资源的植物学特征特性与生态适应性评价[J],热带作物学报,2015,3(3):523-529.
[33]Nandan M,Asati B S,Mamidwar S R.Heterosis and Gene Action in Okra[J].Bangladesh JAgri1 Res,2007,32(3):421-432.
[34]Wammanda D T,Kadams A M,Jonah P M.Combining abi1ity analysis and heterosis in a dial1el cross of okra(Abelmoschus esculentusL.Moench)[J].African Journal of Agricultural Research, 2010,5(16):2108-2115.
[35]Abdelmageed A H A.Inheritance studies of some economic characters in okra(Abelmoschus esculentus(L.)Moench)[J].Trop Sub-TropAgroecosyst,2010,12(1):619-627.
[36]徐丽,高玲,刘迪发.环境对6个黄秋葵栽培种加荚量的影响[J],中国农学通报,2015,31(19):74-79.
[37]刘维侠,曹振木,党选民,等.保健蔬菜黄秋葵遗传育种研究进展[J].热带农业工程,2012,36(6):26-29.
[38]曹亮,周佳民,朱校奇,等.黄秋葵种质资源、引种栽培及功效成分研究进展[J].中南药学,2012,10(9):695-697.
[39]Westengen O T,Jeppson S,Guarino L.Global exsitu crop diversity conservation and the Svalbard Global Seed Vault:assessing the current status[J].PloS one,2013,8(5):641-646.
[40]郑殿升.中国引进的栽培植物[J].植物遗传资源学报,2011,12(6): 910-915.
[41]Guo J M,Lu Y W,Shang E X,et al.Efficacy and safety of FlosAbelmoschus manihot(Malvaceae)on type 2 diabetic nephropathy: Asystematic review[J].Phytomedicine.2015,22(5):5795.
[42]Zhang L,Li P,Xing C Y,et al.Efficacy and Safety ofAbelmoschus manihotfor Primary Glomerular Disease:A Prospective, Multicenter Randomized Controlled Clinical Trial[J].Am J Kidney Dis,2014,64(1):57-65.
[43]Molfetta I,Ceccarini L,Macchia M,et al.Abelmoschus esculentus(L.)Moench.andAbelmoschus moschatusMedik:seeds production and analysis of the volatile compounds[J].Food Chem,2013,141(1): 34-40.
[44]Dokka M K,Seva L,Davuluri S P,et al.Isolation and purification of trypsin inhibitors from the seeds ofAbelmoschus moschatusL.[J]. Appl Biochem Biotechnol,2015,175(8):3750-3762.
[45]Ariyo O J.Genetic diversity in West African okra(Abelmoschus caillei)(A.Chev.)Stevels-Multivariate analysis of morphological and agronomic characteristics[J].Genetic Resources and Crop Evolution,1993,40(1):25-32.
[46]Akhtar S,Khan A J,Singh A S,et al.Identification of a disease complex involving a novel monopartite begomovirus with beta-and alphasatellites associated with okra leaf curl disease in Oman[J]. Arch Virol,2014,159(5):1199-1205.
[47]Chandran S A,Packialakshmi R M,Subhalakshmi K,et al.First report of an alphasatellite associated with Okra enation leaf curl virus[J].Virus Genes,2013,46(3):585-587.
[48]Mairuae N,Connor J R,Lee S Y,et al.The effects of okra (Abelmoschus esculentusL.)on the cellular events associated with Alzheimer's disease in a stably expressed HFE neuroblastoma SHSY5Y cell line[J].Neurosci Lett,2015,603(31):6-11.
[49]Narendran M,Deole S G,Harkude S,et al.Efficient genetic transformation of okra(Abelmoschus esculentus(L.)Moench)and generation of insect-resistant transgenic plants expressing the cry1Ac gene[J].Plant Cell Rep,2013,32(8):1191-1198.
Research Progress of Breeding and Germplasm Resources of Okra
Zhang Shaoping,Qiu Shanlian,Zhang Shuai,Zheng Yunyun,Wu Songhai,He Yansen,Zheng Kaibin
(Subtropical Agriculture Research Institute,Fujian Academy of Agricultural Sciences,Zhangzhou 363005,Fujian,China)
The research progress of okra and its close relative species were reviewed,including distribution, collection,preservation and utilization.Evaluation of genetic diversity of okra germplasm resources was summed up,related to RAPD,SRAP,ISSR,SSR and etc.The basic theoretical research on okra hybridization was summarized.A series of new species widely grow in west and central Africa and China were introduced.At the same time,the authors pointed out that further research on collection,artificial domestication cultivation and purification should be strengthened for the specific okra and its close relative species.In addition,it was proposed to get a group of male sterile line material by okra polyploid and radiation mutation breeding,in order to better serve okra hybridization.
Okra;Germplasm Resource;Genetic Breeding
S63
:A论文编号:cjas16110023
福建省科技重大专项“黄秋葵新品种选育及产业化推广”(2013NZ0002-3);福建省科技创新平台建设项目“福建省原生蔬菜产业技术公共服务平台建设项目”(2014N2006);福建省属公益类科研院所基本科研专项“特色蔬菜色素的基因研究及开发利用”(2016R1012-4);福建省农业科学院科技创新团队PI项目“植物源天然产物提取及功效评价”(2016PI-2)。
张少平,男,1975年出生,江西抚州人,农艺师,硕士,主要从事特色蔬菜功能成分及相关分子生物学研究。通信地址:363005福建省漳州市龙文区朝阳镇登科洲省农科院亚热带农业研究所,Tel:0596-2122522,E-mail:zspnc@163.com。
郑开斌,男,1966年出生,福建莆田人,研究员,博士,主要从事作物品质育种相关研究。通信地址:363005福建省漳州市龙文区朝阳镇登科洲省农科院亚热带农业研究所,Tel:0596-2122522,E-mail:409119296@qq.com。
2016-11-16,
:2016-12-30。

