白酒糟对黔北麻羊瘤胃发酵及血浆生化指标的影响
袁 鑫 吴文旋,2* 吴佳海 田兴舟 莘海亮
(1.贵州大学动物科学学院,贵阳550025;2.贵州大学新农村发展研究院,贵阳550025;3.贵州省草业研究所,贵阳550006;4.黔东南民族职业技术学院,凯里556000)
白酒糟对黔北麻羊瘤胃发酵及血浆生化指标的影响
袁 鑫1吴文旋1,2*吴佳海3*田兴舟1莘海亮4
(1.贵州大学动物科学学院,贵阳550025;2.贵州大学新农村发展研究院,贵阳550025;3.贵州省草业研究所,贵阳550006;4.黔东南民族职业技术学院,凯里556000)
本试验旨在研究白酒糟(产自贵州美酒河流域)对黔北麻羊瘤胃发酵及血浆生化指标的影响。以6只年龄、体重基本一致的黔北麻羊为试验动物,采用3×3拉丁方试验设计,将其分成3组,每组2个重复,每个重复1只羊。对照组饲喂基础饲粮,试验1组和试验2组以白酒糟分别替代基础饲粮中20%、40%的精料。试验期45 d,分3期,每期15 d,包括10 d预试期和5 d正试期。正试期采集血浆和瘤胃液样品,测定瘤胃液pH、缓冲力、氨态氮和挥发性脂肪酸浓度,瘤胃液微晶纤维素酶、羧甲基纤维素酶、纤维二糖酶、木聚糖酶活性以及血浆葡萄糖、尿素氮、总蛋白、白蛋白、总胆固醇、肌酐含量。结果显示:1)3组黔北麻羊瘤胃液pH、缓冲力差异不显著(P>0.05);氨态氮浓度均处于正常范围,试验1组氨态氮浓度显著高于试验2组(P<0.05)。2)试验1组瘤胃液木聚糖酶活性显著高于对照组(P<0.05),各组间瘤胃液微晶纤维素酶、羧甲基纤维素酶、纤维二糖酶活性差异不显著(P>0.05)。3)试验1组瘤胃液乙酸浓度最高,显著高于试验2组(P<0.05);瘤胃液总挥发性脂肪酸浓度也最高,显著高于对照组和试验2组(P<0.05);3组瘤胃液丙酸和丁酸浓度、乙酸/丙酸差异均不显著(P>0.05)。4)各组血浆生化指标无显著差异(P>0.05)。由此可见,白酒糟替代40%以内精料不会对黔北麻羊瘤胃发酵与血浆生化指标产生不良影响,相比较而言,以20%水平较优。
白酒糟;瘤胃发酵指标;血浆生化指标;黔北麻羊
酒糟(distiller’s grains)是酿酒的副产物,是一种传统的动物饲料原料。众多研究发现,在反刍物饲粮中添加一定水平的酒糟可促进采食,提高生长性能,降低饲养成本,增加养殖效益[1-3]。贵州作为酿酒大省,美酒河流域(赤水、习水、仁怀沿线)利用当地特产红高粱和小麦为原料,另加入少量稻壳作膨松剂,酿制生产茅台、习酒等著名白酒,酒糟资源丰富且来源稳定,有较高的饲料利用价值。此种白酒糟与其他类型酒糟存在一定的区别,酿造方法独特,蛋白质含量较高,含有16种水解氨基酸[4-5]。
黔北麻羊属贵州特有山羊品种,源产于美酒河流域沿线,当地已有近600年饲养记录,主要分布在贵州省北部遵义市习水县、仁怀市、赤水市及周边部分地区,与其他羊种存在明显差异,于2009年被鉴定为新的山羊遗传资源[6],学术研究价值独特。长期以来,美酒河流域源产白酒糟一直是黔北麻羊的传统饲料,但由于黔北麻羊品种认定时间较晚,目前较少见到有关其白酒糟营养研究的文献报道,值得深入研究。
本课题组前期研究发现,饲喂低水平(21%以下)美酒河流域酒糟可有效提高黔北麻羊羔羊的生长性能与养分消化率,改善血浆免疫性能指标[7-8]。作为反刍动物营养的重要内容,深入研究瘤胃发酵状态对开发利用饲料资源具有重要的学术意义和生产价值。为更深入了解白酒糟对黔北麻羊的潜在理论意义,进一步扩展白酒糟在黔北麻羊中的应用范围,有必要进行此方面的试验。由于羔羊瘤胃尚未发育完全,瘤胃微生物区系不完善、代表性不强,不能真实反映瘤胃发酵状态,同时,采集羔羊瘤胃液存在不少困难,本试验以成年黔北麻羊为试验动物。本试验旨在研究白酒糟替代饲粮中精料对黔北麻羊瘤胃发酵及血浆生化指标的影响,以期为合理开发饲料资源、降低生产成本、提升养殖技术水平、提高养殖效益、促进黔北麻羊产业可持续健康发展提供理论基础。
1 材料与方法
1.1 试验设计与饲养管理
采用3×3拉丁方设计,将6只年龄、体重[(37.5±1.2) kg]基本一致的成年黔北麻羊分成3组,每组2个重复,每个重复1只羊。对照组饲喂基础饲粮,试验1组和试验2组以白酒糟分别替代基础饲粮中20%、40%的精料。白酒糟概略养分水平见表1。
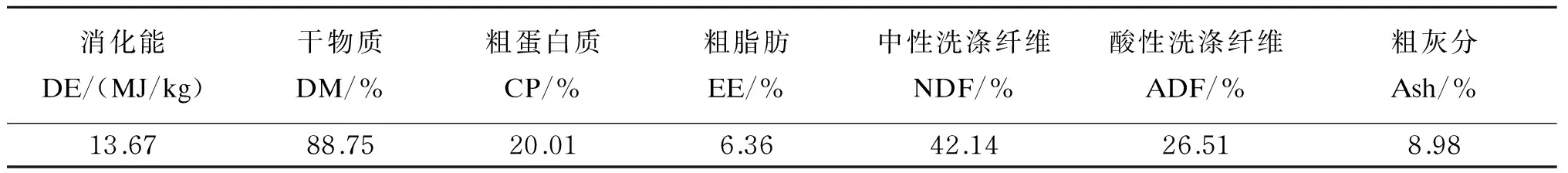
表1 白酒糟概略养分水平(干物质基础)Table 1 Proximate nutrient levels of white distiller’s grains (DM basis)
黔北麻羊基础饲粮参照我国《肉羊饲养标准》(NY/T 816—2004)[9]配制。试验饲粮组成及营养水平见表2。整个试验持续45 d,分3期,每期15 d,包括10 d预试期和5 d正试期(采样期)。预试期主要用于观察山羊健康和适应试验饲粮。山羊单饲于自制金属代谢笼内,每天09:00、18:00清槽后饲喂,自由饮水,保证圈舍光照、干燥通风。试羊进行统一驱虫、消毒等管理。
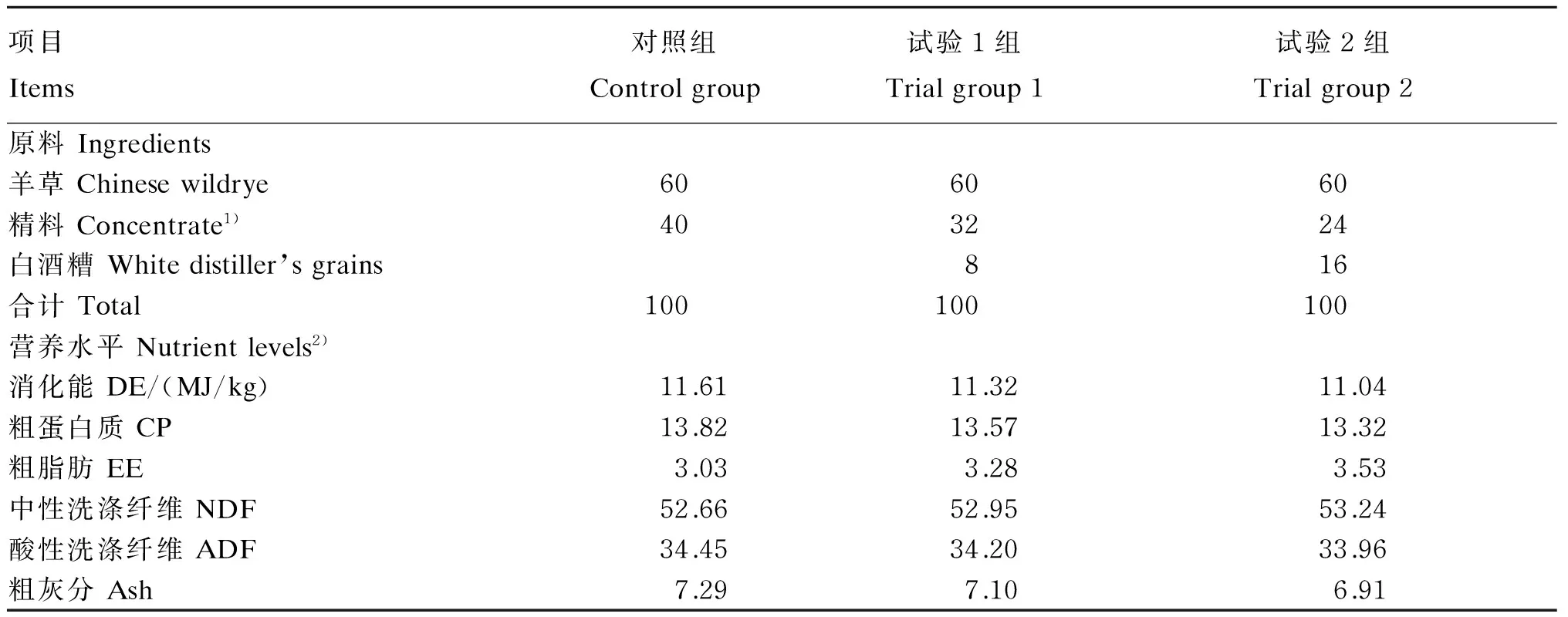
表2 试验饲粮组成及营养水平(风干基础)Table 2 Composition and nutrient levels of trial diets (air-dry basis) %
1)精料组成(风干基础)Concentrate composition (air-dry basis):玉米corn 70%,麸皮wheat bran 10%,菜籽粕rapeseed meal 10%,豆粕soybean meal 6%,预混料premix 2%,磷酸氢钙CaHPO41%,食盐NaCl 1%。
2)消化能根据《中国饲料成分及营养价值表(2013年第24版)》计算,其余营养水平为实测值。DE was calculated according toTablesofFeedCompositionandNutritiveValueinChina(24th Edition, 2013), while other nutrient levels were measured values.
1.2 指标测定
1.2.1 饲粮营养水平
每2 d采集1次饲粮,置于-20 ℃冰箱中冷冻保存。试验结束后,将饲粮置于65 ℃烘箱中烘干,粉碎制成分析试样,参照《饲料分析及饲料质量检测技术》[10]测定营养水平。采用凯氏定氮法测定粗蛋白质(CP)含量,采用乙醚浸提法测定粗脂肪(EE)含量,采用灼烧法测定粗灰分(ash)含量,参照Van Soest纤维素分析法[11]测定中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量。
1.2.2 瘤胃发酵指标
正试期晨饲前,用胃管式瘤胃液采样器抽取足量瘤胃液,4层纱布过滤,立即测定瘤胃液pH和缓冲力(buffer capacity),剩余瘤胃液置于10 mL离心管用于分析氨态氮(NH3-N)浓度、纤维素酶活性和挥发性脂肪酸(VFA)浓度。瘤胃液缓冲力参照Tucker等[12]提出的缓冲力指数法进行测定,具体操作如下:混匀采集瘤胃液,吸取10 mL放入30 mL的烧杯内用0.1 mol/L的盐酸滴定,至pH=5,根据所耗的盐酸的量来计算缓冲力。计算公式如下:
瘤胃液缓冲力(mL/L)=滴定盐酸毫升数×103/20。
NH3-N浓度测定用比色法进行测定[13]。纤维素酶活性参照王加启[14]的方法测定。采用气相色谱仪(岛津GC-14B)测定挥发性脂肪酸浓度,色谱条件:色谱柱CP-WAX(30.00 m×0.53 mm×1.00 μm);火焰氢离子检测器(FID)、气化室温度均为200 ℃;柱温从100 ℃升至150 ℃(程序升温法),每分钟升高3 ℃,灵敏度为101,衰减为52;以巴豆酸为内标物[15]。
1.2.3 血浆生化指标
正试期采集瘤胃液前,用一次性装有肝素钠的采血管经颈静脉采血,常温下805×g离心15 min,收集血浆于1.5 mL离心管中,置于-20 ℃冰箱中保存,使用全波段酶标仪(Synergy H4,美国BioTek)以葡萄糖氧化酶法测定葡萄糖(Glu)含量,以脲酶法测定尿素氮(UN)含量、以二喹啉甲酸(BCA)法测定总蛋白(TP)含量,以溴甲酚绿法测定白蛋白(Alb)含量、以甘油磷酸氧化酶-过氧化物酶(GPO-PAP)法测定总胆固醇(TC)含量,以肌氨酸氧化酶法测定肌酐(Cr)含量。检测试剂盒及使用方法由南京建成生物工程研究所提供。
1.3 试验数据分析
利用SAS 8.0统计软件进行数据统计分析,组间差异性多重比较采用LSD法,显著水平定为P<0.05,试验数据以平均值±标准差(mean±SD)表示。
2 结 果
2.1 适口性与干物质采食量
经观察,白酒糟未影响饲粮适口性。由表3可知,对照组、试验1组、试验2组干物质采食量差异不显著(P>0.05)。

表3 不同比例白酒糟替代精料对黔北麻羊干物质采食量的影响Table 3 Effects of substitution of concentrate with white distiller’s grains at different proportions on DMI of Qianbeima goats g/d
2.2 瘤胃内环境和纤维素酶活性
由表4可知,白酒糟对黔北麻羊瘤胃液pH、缓冲力影响不大,各组未表现出显著差异(P>0.05)。瘤胃液NH3-N浓度以试验1组最高,显著高于试验2组(P<0.05)。试验1组木聚糖酶活性显著高于对照组(P<0.05),其余纤维素酶活性各组间差异不显著(P>0.05)。
2.3 瘤胃液挥发性脂肪酸浓度
由表5可知,瘤胃液乙酸浓度以试验1组最高,与对照组差异不显著(P>0.05),较试验2组高19.34%,差异显著(P<0.05)。3组瘤胃液丙酸、丁酸浓度及乙酸/丙酸无显著差异(P>0.05)。瘤胃液总挥发性脂肪酸(TVFA)浓度以试验1组最高,较对照组和试验2组分别高10.22%、15.42%,差异显著(P<0.05)。丙酸和丁酸浓度、乙酸/丙酸、乙酸占总挥发性脂肪酸百分比、丙酸占总挥发性脂肪酸百分比和丁酸占总挥发性脂肪酸百分比各
组间差异不显著(P>0.05)。
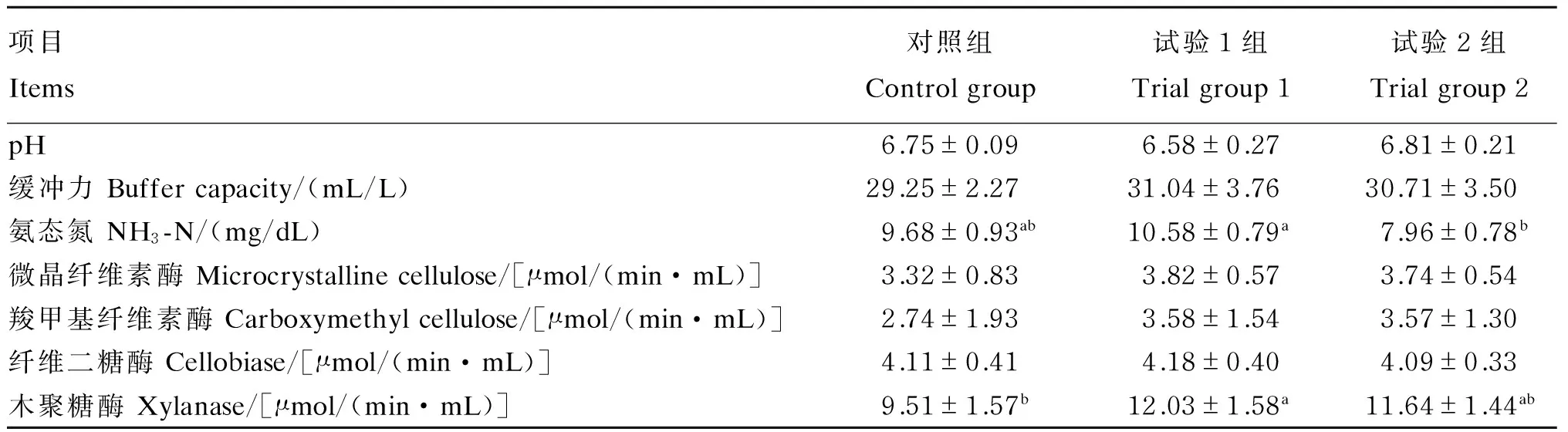
表4 不同比例白酒糟替代精料对黔北麻羊瘤胃内环境和纤维素酶活性的影响Table 4 Effects of substitution of concentrate with white distiller’s grains at different proportions on ruminal internal surrounding and cellulase activities of Qianbeima goats

表5 不同比例白酒糟替代精料对黔北麻羊瘤胃液挥发性脂肪酸浓度的影响Table 5 Effects of substitution of concentrate with white distiller’s grains at different proportions on rumen fluid VFA concentrations of Qianbeima goats
2.4 血浆生化指标
由表6可知,白酒糟对黔北麻羊血浆Glu、UN、TP、Alb、TC、Cr含量影响较小,各组间差异均不显著(P>0.05)。
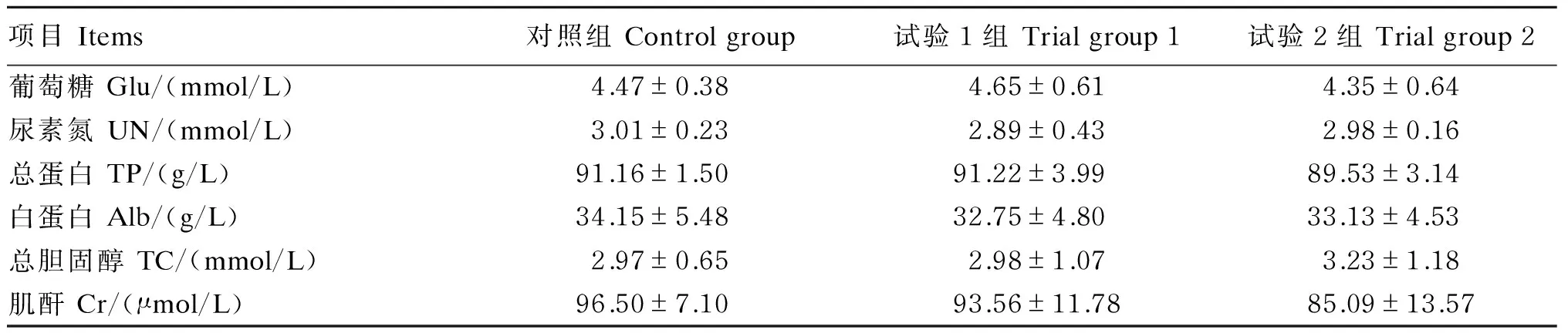
表6 不同比例白酒糟替代精料对黔北麻羊血浆生化指标的影响Table 6 Effects of substitution of concentrate with white distiller’s grains at different proportions on plasma biochemical indexes of Qianbeima goats
3 讨 论
3.1 白酒糟对黔北麻羊瘤胃发酵的影响
3.1.1 瘤胃液pH
pH是衡量瘤胃消化代谢状况是否正常的重要指标。瘤胃液pH主要受唾液分泌、饲粮组成等因素的影响[16]。Depeters等[17]指出,瘤胃液pH在6.6~6.8有利于纤维消化,低于6.4时,纤维消化率会下降。一般认为,6.2~6.8是瘤胃液pH正常范围。生产实践中,pH降低更易发生,对机体危害更大。pH若过低(<5.8),将抑制纤维素分解菌活性,使瘤胃微生物分解纤维素的能力下降,对粗饲料消化率下降[18]。因此,检测pH是研究瘤胃发酵的最重要指标。本试验中,各组瘤胃液pH的波动较小,在6.58~6.81变化,处于正常范围。吴丹等[19]指出,用白酒糟进行的宣汉黄牛瘤胃体外发酵,发酵液pH处于6.68~6.82,也在正常范围内。王潍波等[20]在玉米酒糟对徐淮白山羊试验中也有类似报道,pH在6.30~6.45。这与本试验结论一致,说明一定水平内的白酒糟替代精料不会对黔北麻羊瘤胃发酵产生负面影响。
3.1.2 瘤胃液缓冲力
瘤胃液缓冲力是动物咀嚼、反刍饲粮所产生的唾液和饲粮发酵产物(主要为碳酸氢根盐和磷酸氢根盐)产生的缓冲能力,是反映瘤胃发酵状况的一个重要指标。瘤胃液缓冲力与pH的变化关系紧密,可在一定范围内缓冲pH的快速降低或升高,有利于维持瘤胃内环境的相对稳定,是保证瘤胃微生物活性和瘤胃健康的重要因素。本试验中,各组瘤胃液缓冲力差异不显著,说明白酒糟替代40%精料未对瘤胃液缓冲力造成不利影响。杨璐玲等[21]发现,啤酒糟对崂山羊有类似效应。张显东[22]研究表明,不同类型粗饲料对绵羊的瘤胃缓冲力的影响不大。上述结果与本试验类似,说明在40%替代水平范围内,白酒糟不会影响黔北麻羊咀嚼和反刍功能,瘤胃缓冲力未发生改变,仍能维持瘤胃正常发酵状态。
3.1.3 NH3-N浓度
碳关税模块包括两个部分:一是通过碳排放因子对相应的碳排放系数进行计算,二是通过对出口商品含碳量进行碳关税的征收。具体碳排放系数计算如式(5)所示:
NH3-N是饲粮蛋白质、内源性蛋白质、非蛋白氮在瘤胃发酵的重要产物,为瘤胃微生物合成菌体蛋白质提供氮源。反刍动物瘤胃液NH3-N浓度正常数值范围较广,在6.3~27.5 mg/dL[23-24]。NH3-N浓度高于30.0 mg/dL说明饲粮中氮源得不到充分利用,甚至产生瘤胃氨中毒;NH3-N浓度低于5.0 mg/dL,则使菌体蛋白的合成效率降低,同时会影响瘤胃微生物的活性,进一步限制微生物对纤维素的降解[25-26]。
本试验发现,白酒糟替代水平增至40%时,NH3-N浓度显著低于20%替代水平。这与瘤胃降解蛋白质效率降低有关,其原因可能为:1)白酒糟中尚残留有一定水平的甲醇、乙醇和部分酸败性 物质,过高水平时干扰了瘤胃内环境,从而影响瘤胃微生物对蛋白质的分解;2)白酒糟中含有较多谷壳等低营养物质,粗纤维含量较高,微生物对饲粮粗蛋白质的降解速率及氮的释放速度随即下降。虽然从差异性角度分析,试验1组显著高于试验2组,但总体来看,各组瘤胃液NH3-N浓度处于7.96~10.58 mg/dL,属正常范围,说明在40%替代水平的白酒糟不会对黔北麻羊瘤胃发酵造成危害。黄雅莉等[27]报道,50%啤酒糟替代豆粕对水牛瘤胃液NH3-N浓度没有显著影响,与本试验结论一致。吴丹等[19]用不同方法处理酒糟在体外发酵的试验中也得到类似结果。
3.1.4 纤维素酶活性
纤维素酶是多种复合物的总称,包括外切葡萄糖酶、内切葡萄糖酶、纤维糊精酶和葡萄糖苷酶等,是反刍动物分解利用纤维饲料的主要物质[28]。测定瘤胃纤维素酶活,可反映瘤胃微生物对饲粮纤维素的分解能力,为粗饲料利用评定提供依据。本试验中,2个白酒糟替代水平对瘤胃液3种纤维素酶活性(微晶纤维素酶、羧甲基纤维素酶、纤维二糖酶)没有产生显著影响;同时,试验1组木聚糖酶活性还显著高于对照组。这可能是因为当饲粮中白酒糟水平为20%时,微生物分解饲粮所产生的NH3-N浓度与能量的供应水平正好达到适宜瘤胃微生物健康生长的环境,促进了瘤胃发酵,使纤维分解菌分泌酶的能力相应提升,有效地促进饲粮纤维物质的分解利用。杨璐玲等[21]研究指出,在崂山山羊饲粮中补饲15%的酒糟,可显著提高瘤胃液微晶纤维素酶、羧甲基纤维素酶、纤维二糖酶、木聚糖酶活性。林奕[29]在关于精料和酒糟之间的组合效应的研究中也发现,40%以内酒糟对瘤胃液纤维素酶活性的提高有积极作用。总体来说,一定水平的酒糟有益于瘤胃发酵。
3.2 白酒糟对黔北麻羊瘤胃液挥发性脂肪酸浓度的影响
养分在瘤胃发酵产生的挥发性脂肪酸,是反刍动物能量的主要来源。本试验发现,白酒糟替代20%精料显著提高了乙酸、总挥发性脂肪酸浓度;同时各组乙酸占总挥发性脂肪酸百分比、丙酸占总挥发性脂肪酸百分比、丁酸占总挥发性脂肪酸百分比和乙酸/丙酸差异不显著,说明该水平白酒糟未对黔北麻羊Glu代谢、能量利用效率等产生影响。但当白酒糟水平增至40%时,乙酸、丙酸、挥发性脂肪酸浓度均有所下降,其原因与上文分析的纤维素酶活性下降类似,即白酒糟中残留的甲醇、乙醇、酸败性物质及稻壳等营养价值较低的物质影响了瘤胃微生物区系,降低了纤维素分解菌的活性,降低了挥发性脂肪酸的释放。陈光吉等[30]指出,添加9.25%的发酵酒糟未对牦牛瘤胃液乙酸/丙酸造成影响。贺鸣等[31]发现,添加30%玉米或高粱酒糟均可使瘤胃液乙酸、丙酸、丁酸及总挥发性脂肪酸浓度及乙酸/丙酸达到瘤胃发酵的最佳水平。总体来看,本试验以20%水平白酒糟较好。这可为生产实践提供技术积累。
3.3 白酒糟替代精料对黔北麻羊血浆生化指标的影响
血浆生化指标可反映机体的代谢变化,用于判断体内代谢是否正常。血浆Glu的含量是衡量动物机体内能量水平的指标;血浆UN含量是机体蛋白质及氨基酸代谢的废物之一,可反映动物对蛋白质的利用率高低;血浆TP、Alb含量是反映免疫能力的指标,在维持血液胶体渗透压、体内代谢物质运输、营养等方面均有很重要的作用;血浆TC、Cr含量是脂质代谢指标,其数值的高低代表着动物机体脂质代谢水平的高低。
余群莲等[32]研究结果显示,添加77.8%的白酒糟替代精料对肉牛血浆Glu、UN含量的影响不显著。Radunz等[33]试验表明,在冬季给妊娠山羊饲喂酒糟对其血浆Glu含量影响较小。Gurung等[34]也证实,干酒糟及其可溶物添加水平达到31%时,山羊血浆UN含量无显著变化。上述研究结果与本试验类似,血浆代谢产物(Glu、UN)含量未受到显著影响,均处于正常范围以内。本试验中,各组血浆TP、Alb含量差异不显著,说明40%以内的白酒糟不会对黔北麻羊血浆生化指标产生不利的影响。孟杰[35]用白酒糟替代30%的玉米秸秆发现对肉牛血浆TP含量很小。王丽等[36]、冯健[37]也有类似报道。石风华[38]研究结果显示,饲粮中酒糟比例不影响肉牛血浆TC含量,可部分替代玉米。本试验发现,3组血浆TC、Cr含量差异不显著,提示白酒糟对血浆脂质代谢未产生影响。综上所述,血浆代谢指标不受白酒糟水平的影响。
4 结 论
① 在本试验条件下,白酒糟替代40%以内精料对黔北麻羊瘤胃发酵与血浆生化指标无不良影响。
② 综合分析,白酒糟替代20%精料可在一定程度上有利于瘤胃发酵,为适宜替代水平。
[1] HAM G A,STOCK R A,KLOPFENSTEIN T J,et al.Wet corn distillers byproducts compared with dried corn distillers grains with solubles as a source of protein and energy for ruminants[J].Journal of Animal Science,1994,72(12):3246-3257.
[2] 陶忠海,方园,方福平,等.酒糟发酵生物料饲喂育肥牛的生长性能及经济效益[J].贵州农业科学,2014,42(3):105-108.
[3] COZZI G,POLAN C E.Corn gluten meal or dried brewers grains as partial replacement for soybean meal in the diet of Holstein cows[J].Journal of Dairy Science,1994,77(3):825-834.
[4] 李芳香,张稳,郁建平,等.茅台酱香型酒糟基本成分的测定与分析[J].贵州农业科学,2016,44(9):114-116.
[5] 陈兴唏,季克良.茅台酒的独特性概述[J].酿酒科技,2006(2):79-84.
[6] 罗卫星,史忠辉,刘贞德,等.黔北麻羊种质特性研究初报[J].山地农业生物学报,2010,29(5):466-470.
[7] 袁鑫,田兴舟,朱伦琴,等.贵州美酒河流域白酒糟对黔北麻羊羔羊生长性能、氮代谢及血浆免疫指标的影响[J].动物营养学报,2015,27(9):2940-2946.
[8] 杨春红,吴文旋,吴佳海,等.白酒糟对黔北麻羊羔羊饲粮养分消化率、血浆生化指标的影响[J].动物营养学报,2016,28(5):1581-1588.
[9] 中华人民共和共农业部.NY/T 816—2004肉羊饲养标准[S].北京:中国标准化出版社,2008.
[10] 张丽英.饲料分析及饲料质量检测技术[M].3版.北京:中国农业大学出版社,2007.
[11] VAN SOEST P J,ROBERTSON J B,LEWIS B A.Methods for dietary fiber,neutral detergent fiber,and nonstarch polysaccharides in relation to animal nutrition[J].Journal of Dairy Science,1991,74(10):3583-3597.
[12] TUCKER W B,HOGUE J F,ASLAM M,et al.A buffer value index to evaluate effects of buffers on ruminal milieu in cows fed high or low concentrate,silage,or hay diets[J].Journal of Dairy Science,1992,75(3):811-819.
[13] 冯宗慈,高民.通过比色测定瘤胃液氨氮含量方法的改进[J].内蒙古畜牧科学,1993(4):40-41.
[14] 王加启.反刍动物营养学研究方法[M].北京:现代教育出版社,2011.
[15] 熊本海,卢德勋,高俊.绵羊瘤胃VFA吸收效率及模型参数的研究[J].动物营养学报,1999,11(增刊):248-255.
[16] 王仁杰.异位酸对南江黄羊体外瘤胃发酵、生产性能及血液指标的影响[D].硕士学位论文.雅安:四川农业大学,2012.
[17] DEPETERS E J,BATH D L.Canola meal versus cottonseed meal as the protein supplement in dairy diets[J].Journal of Dairy Science,1986,69(1):148-154.
[18] 韩正康,陈杰.反刍动物瘤胃的消化和代谢[M].北京:科学出版社,1988.
[19] 吴丹,王之盛,薛白,等.不同加工方法对白酒糟营养价值和体外瘤胃发酵的影响[J].动物营养学报,2011,23(8):1422-1429.
[20] 王潍波,赵国琦,王瑞龙,等.不同蛋白日粮对山羊瘤胃环境参数的影响[J].饲料工业,2008,29(20):44-48.
[21] 杨璐玲,吕永艳,张杰杰,等.啤酒糟对瘤胃发酵参数及纤维素酶活性的影响[J].动物营养学报,2013,25(10):2414-2421.
[22] 张显东.不同种类粗饲料及添加缓冲剂对绵羊瘤胃发酵的影响[D].硕士学位论文.哈尔滨:东北农业大学,2004.
[23] MURPHY J J,KENNELLY J J.Effect of protein concentration and protein source on the degradability of dry matter and proteininsitu[J].Journal of Dairy Science,1987,70(9):1841-1849.
[24] ORTEGA M E,STERN M D,SATTER L D.The effect of rumen ammonia concentrate on dry matter disappearanceinsitu[J].Journal of Dairy Science,1979,62(Suppl.1):76.
[25] 刘哲,张昌吉,郝正里,等.饲喂含不同秸秆的全日粮颗粒料对绵羊瘤胃及血液代谢参数的影响[J].中国饲料,2005(11):12-14.
[26] 韩帅.育肥方式对呼伦贝尔羊和绒山羊瘤胃发酵及瘤胃微生物数量的影响[D].硕士学位论文.呼和浩特:内蒙古农业大学,2014.
[27] 黄雅莉,邹彩霞,黄连莹,等.啤酒糟部分替代豆粕对水牛体外瘤胃发酵特性和甲烷生成的影响[J].动物营养学报,2012,24(3):563-570.
[28] FONDEVILA M,DEHORITY B A.Interactions between fiberobacter succinogenes,prevotlla ruminicola,and ruminococcus flavefaciens in the digestion of cellulose from forages[J].Journal of Animal Science,1996,74(3):678-684.
[29] 林奕.白酒糟、玉米和豆粕之间组合效应及其对瘤胃发酵特性影响的研究[D].硕士学位论文.雅安:四川农业大学,2009.
[30] 陈光吉,彭忠利,宋善丹,等.发酵酒糟对舍饲牦牛生产性能、养分表观消化率、瘤胃发酵和血清生化指标的影响[J].动物营养学报,2015,27(9):2920-2927.
[31] 贺鸣,李胜利.发酵酒糟对肉牛和奶牛生产性能的影响[J].中国饲料,2004(5):24-27.
[32] 余群莲,王之盛,邹华围,等.精料与白酒糟的不同比例对夏季肉牛生产性能及血液生化指标的影响[J].中国畜牧兽医,2011,38(4):16-19.
[33] RADUNZ A E,FLUHARTY F L,SUSIN I,et al.Winter-feeding systems for gestating sheep Ⅱ.Effects on feedlot performance,glucose tolerance,and carcass composition of lamb progeny[J].Journal of Animal Science,2011,89(2):478-488.
[34] GURUNG N K,SOLAIMAN S G,RANKINS D L,et al.Effects of distillers dried grains with solubles on feed intake,growth performance,gain efficiency and carcass quality of growing Kiko×Spanish male goats[J].Journal of Animal and Veterinary Advances,2009,8(10):2087-2093.
[35] 孟杰.几种农副产品饲料的化学成分、能量价值和饲喂肉牛的生长性能与肉品质比较[D].博士学位论文.北京:中国农业大学,2014.
[36] 王丽,张英杰,刘月琴,等.饲粮白酒糟添加水平对山羊生产性能、营养物质表观消化率及血清生化指标的影响[J].动物营养学报,2014,26(2):519-525.
[37] 冯健.补饲HBP发酵饲料对延边黄牛产肉性能、血液指标及牛肉品质的影响[D].硕士学位论文.延吉:延边大学,2013.
[38] 石风华.非常规饲料替代玉米饲喂肉牛对瘤胃发酵、养分消化率、生产性能和胴体品质的影响[D].博士学位论文.北京:中国农业大学,2014.
*Corresponding authors: WU Wenxuan, professor, E-mail: wwx3419@126.com; WU Jiahai, professor, E-mail: wujiahai2003@aliyun.com
(责任编辑 王智航)
Effects of White Distiller’s Grains on Rumen Fermentation and Plasma Biochemical Indexes ofQianbeimaGoats
YUAN Xin1WU Wenxuan1,2*WU Jiahai3*TIAN Xingzhou1XIN Hailiang4
(1.CollegeofAnimalScience,GuizhouUniversity,Guiyang550025,China; 2.InstituteofNewRuralDevelopment,GuizhouUniversity,Guiyang550025,China; 3.InstituteofPrataculturalScienceofGuizhouProvince,Guiyang550006,China; 4.QiandongnanNationalPolytechnic,Kaili556000,China)
The present study was conducted to investigate the effects of white distiller’s grains (fromMeijiuriver area inGuizhouprovince) on rumen fermentation and plasma biochemical indexes ofQianbeimagoats. Six goats with similar age and body weight were selected as experiment animals and assigned to 3 groups with 2 replicates per group and 1 goat per replicate using 3×3 Latin square design. Goats in control group were fed a basal diet, and concentrates in diet for goats in trial group 1 and trial group 2 were replaced with 20% and 40% white distiller’s grains, respectively. The trial lasted for 45 d consisted of 3 periods with 10 d of pre-trial period and 5 d trial period each. Plasma and rumen fluid samples were collected in trial period to determine pH, buffer capacity, the concentrations of ammonia nitrogen and volatile fatty acid, the activities of microcrystalline cellulose, carboxymethyl cellulose, cellobiase and xylanase in rumen fluid, and the contents of glucose, urea nitrogen, total protein, albumin, total cholesterol and creatinine in plasma. The results were showed as follows: 1) there was no significant difference for pH and buffer capacity in rumen fluid in 3 groups (P>0.05); the highest NH3-N concentration in rumen fluid was found in trial group 1, and was significantly higher than that in trial group 2 (P<0.05), however, they were all listed in the normal range. 2) The activity of xylanase in rumen fluid in trial group 1 was significantly higher than that in control group (P<0.05), and the activities of microcrystalline cellulose, carboxymethyl cellulose and cellobiase were not significantly affected (P>0.05). 3) Trial group 1 had the highest concentrations of acetate in rumen fluid, which was significantly higher than that in trial group 2 (P<0.05); the concentration of total volatile fatty acid in trial group 1 was significantly higher than that in control group and trial group 2 (P<0.05); there were no significant differences of propionate and butyrate concentration and acetate/propionate in 3 groups (P>0.05). 4) There were no significant differences of plasma biochemical indexes in 3 groups (P>0.05). The above results indicate that up to 40% replacement level of concentrate with distiller’s grains does not exert negative effects on rumen fermentation and plasma biochemical indexes, and 20% replacement level is recommended in the practice.[ChineseJournalofAnimalNutrition, 2017, 29(6):2188-2195]
white distiller’s grains; rumen fermentation index; plasma biochemical index;Qianbeimagoat
10.3969/j.issn.1006-267x.2017.06.042
2016-12-01
国家自然科学基金(31360563);贵州山区牧草产业化生产技术研究集成与应用(黔科合重大专项字[2014]6017号);贵州大学科技兴村人才培育基地建设项目;黔东南科合J字[2016]015号
袁 鑫(1992—),男,江苏宿迁人,硕士研究生,从事动物营养与饲料科学研究。E-mail: 1184520995@qq.com
*通信作者:吴文旋,教授,硕士生导师,E-mail: wwx3419@126.com;吴佳海,研究员,E-mail: wujiahai2003@aliyun.com
S826
A
1006-267X(2017)06-2188-08

